坛紫菜蛋白质提取工艺优化及其特性分析
2022-06-11徐海菊冯尚坤陈正冬鲍若晗
徐海菊,冯尚坤,陈正冬,鲍若晗
(台州科技职业学院,浙江台州 318020)
随着人类对优质蛋白质需求的不断增长,海洋藻类作为新型蛋白质的来源越来越受到人们的广泛关注。坛紫菜(Porphyra haitanensis),隶属红藻门(Rhodophyta)、红藻纲(Rhodophyceae)、红毛菜科(Bangiaceae)、法紫菜属(Pyropia),是一种生长在沿海潮间带中高潮区的岩礁或筏架上的大型藻类,是我国特有的经济海藻之一,主要分布在浙江、福建和广东等省[1-3]。
坛紫菜味道鲜美,含有大量人体所必需的蛋白质、多糖、氨基酸、矿物质和维生素,有着“营养宝库”的美称[4-6]。坛紫菜蛋白质含量达到31.33%~50.94%,脂肪含量0.34%~1.04%,具有低脂肪高蛋白的特点[7]。针对这一特点,对其蛋白质进行研究和综合开发利用,可以提供人们对于高品质蛋白质的需求。但目前对于坛紫菜蛋白质的提取与特性研究较少,而且不同种类的紫菜蛋白在含量、组成与特性方面存在较大差异,因此开展坛紫菜蛋白的提取工艺和特性研究,对提高坛紫菜原料附加值具有十分重要的意义。
传统提取方法如水溶液提取法、组织破碎法和反复冻融法,存在着产品耗时长、易变性、提取率低和能耗高等缺点。随着提取技术的发展,新型提取方法如超声波辅助提取法、微波辅助提取法和液氮研磨法被应用到蛋白质的提取过程中,具有设备简单、安全环保、无化学残留、耗时短、效率高等优势。本研究以坛紫菜为原料,研究开发一种超声波辅助提取坛紫菜蛋白质的方法,并对其蛋白质的理化性质及抗氧化特性进行研究,旨在为坛紫菜资源的开发利用提供一定的理论依据和技术支撑。
1 材料与方法
1.1 材料与仪器
坛紫菜 采自浙江省台州市路桥海胜水产养殖场,水洗,除去泥沙等杂质,晾干备用;总蛋白定量测试盒(BCA法)、ABTS试剂盒、T-AOC测定试剂盒
南京建成生物工程研究所;Bradford蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;DPPH 色谱纯,上海麦克林生化科技有限公司;氯化钙、磷酸氢二钠、磷酸二氢钠、硫酸铜、硫酸钾、浓硫酸、硫酸铵等 均为分析纯;金龙鱼大豆油 超市购买。
DHG-9145A型电热恒温鼓风干燥箱 上海一恒科技有限公司;JY99-IIDN超声波细胞破碎仪 上海沪析实业有限公司;Avanti J-26高速冷冻离心机
贝克曼库特尔;SUNRISE吸光酶标仪 瑞士TECAN公司;GB204电子天平 瑞士METTLER公司;FOSS 2300全自动凯氏定氮仪 上海艾研生物科技有限公司;Delta320精密pH计 梅特勒-托利多仪器公司;751石英比色皿 宜兴市伟鑫仪器有限公司;Alpha1-4冷冻干燥机 德国Christ;UV2550紫外可见分光光度计 日本SHIMADZU公司;T50均质机 德国IKA公司。
1.2 实验方法
1.2.1 超声波法辅助提取蛋白的单因素实验 坛紫菜蛋白提取工艺流程[8-10]:坛紫菜→50 ℃烘干至恒重→高速粉碎机粉碎→过120目筛→称取藻粉→按料液比(w:v)加入溶剂→磁力搅拌器搅拌均匀→超声辅助提取→4 ℃,10000 r/min离心15 min→取上清液→测定蛋白含量。
以上工艺流程中蛋白质提取率的计算公式如下:

式中,坛紫菜粉蛋白质含量测定采用凯氏定氮法,上清液中蛋白质含量测定采用BCA试剂盒测定。
单因素实验根据前期预实验及参考文献[9-10],考察了不同溶剂(蒸馏水、20 mmol/L pH7.0 PBS、20 mmol/L CaCl2)、超声发生时间和间隔时间(2、3、4、5、6、7、8 s)、料液比(50:4、50:5、50:6、50:7、50:8、50:9、50:10 mg/:mL)、pH(3、4、5、6、7、8、9)、超声功率(180、540、900、1260、1440、1620 W)和超声全程时间(10、20、30、40、50、60 min)对坛紫菜蛋白提取率的影响。单因素实验时,其他条件分别按固定为蒸馏水、超声发生时间和超声间隔时间为4 s、料液比50:5 mg/mL、pH7、超声功率1260 W、超声全程时间20 min。
1.2.2 坛紫菜粉蛋白质含量的测定 采用微量凯氏定氮法测定蛋白质含量,参照GB 5009.5-2016《食品中蛋白质的测定》[11]。
1.2.3 正交试验设计 在单因素实验结果的基础上,以超声全程时间(A)、pH(B)、超声功率(C)确定正交试验设计自变量及水平,以蛋白质提取率为考察指标,进行三因素三水平正交试验,以确定超声处理的最佳工艺条件。试验因素水平见表1。
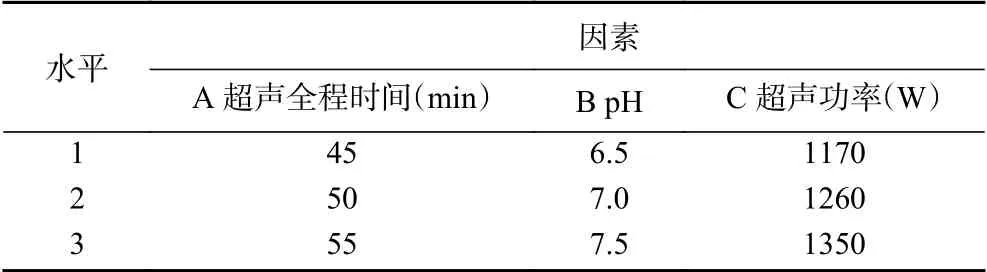
表1 正交试验因素水平设计Table 1 Factor level charts of orthogonal test
1.2.4 坛紫菜蛋白制备过程中的光谱学特征 坛紫菜蛋白的制备工艺流程:超声离心得到的蛋白溶液,装入透析袋,放入饱和度为60%硫酸铵溶液中盐析,在4 ℃下静置过夜后,离心20 min(4 ℃,4900 r/min),收集沉淀,加入少量蒸馏水溶解后置于透析袋除盐,在4 ℃下连续透析48 h,中间换水4~5次,截留液用PEG 20000浓缩后冷冻干燥得到蛋白质粉末。
对不同工艺阶段后的组分进行200~700 nm全波长扫描,得到光谱扫描图。
1.2.5 坛紫菜蛋白特性分析
1.2.5.1 等电点的测定 取得到的蛋白提取液,50 mL共7份,调整pH分别为3、4、4.5、5、6、7、8、9;
10000 r/min离心分离15 min后取上清液,用Bradford蛋白浓度测定试剂盒测定,记录在595 nm处的吸光度,吸光度最小时的pH即为坛紫菜蛋白的等电点。
1.2.5.2 乳化性质的测定 根据Pearce等[12]的方法测定。配制6 mL 0.1%(w/v)的样品复溶液,将pH分别调到3.5、4、4.5、5、5.5然后加入2 mL的金龙鱼大豆油,利用高速分散器1×104r/min均质1 min后,立刻从底部取25 μL样液,加入0.1%的SDS溶液5 mL混匀。以SDS溶液为空白,测定其在500 nm处的吸光值。放置15 min后,再测定一次。乳化活性及乳化稳定性的计算公式如下:
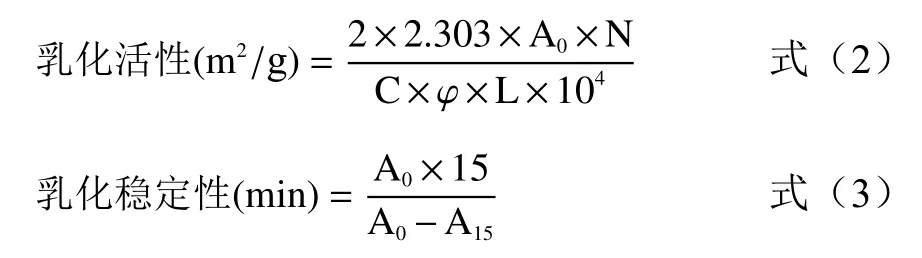
式中:C为溶液中的蛋白质浓度(g蛋白/mL);φ为油相在乳化液中所占的比例(0.25);L为比色杯宽度(1 cm);N为稀释倍数;A0为初始乳化液的吸光度值;A15为15 min后的吸光度值。
1.2.5.3 起泡性质的测定 参照Fernandez等[13]的方法略有改动。取20 mL 2%(w/v)的蛋白溶液,分别调pH至3.5、4、4.5、5、5.5后,在高速分散器中以1×104r/min均质2 min,测量此时泡沫和溶液的总体积V0及搅拌停止30 min后泡沫和溶液的总体积V1,起泡性及泡沫稳定性按如下公式表示:
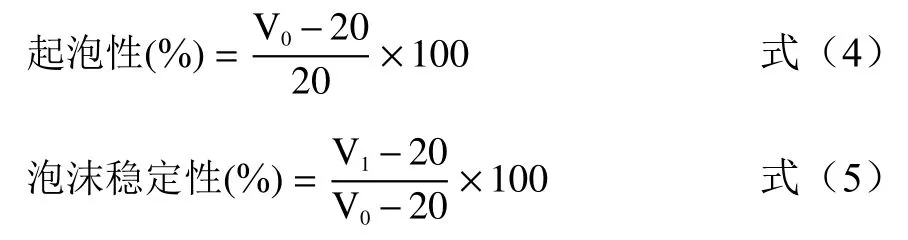
式中:V0表示搅拌停止时泡沫和溶液的总体积,mL;V1表示搅拌停止30 min后泡沫和溶液的总体积,mL。
1.2.5.4 坛紫菜蛋白质的抗氧化能力测定 按试剂盒说明书进行测定。样品浓度0、5、10、20、40、50 mg/mL,每个浓度重复实验3次,取平均值,按下式计算总抗氧化能力。

1.2.5.5 DPPH自由基清除能力测定 采用96孔板测定样品的DPPH自由基清除活性[14]。在96孔板内,精确移取20 μL样品(浓度0~10 mg/mL)+180 μL的0.2 mmol/L的DPPH溶液,室温下将二者混合均匀,避光放置30 min,517 nm处测定其吸光值,用A样品表示。空白组以无水乙醇代替样品,对照组以无水乙醇代替DPPH溶液,其吸光值分别用A对照和A空白表示。以Trolox做阳性对照。

式中:A样品表示样品+DPPH;A对照表示样品+无水乙醇;A空白表示无水乙醇+DPPH。
1.2.5.6 ABTS+自由基清除能力测定 参照ABTS试剂盒说明书配制ABTS所需工作溶液。用样品配制溶液对标准品进行稀释,把10 mmol/L Trolox标准溶液依次稀释成0.1、0.2、0.4、0.8、1 mmol/L。于96孔板内分别加入工作液和样品,将加好样品的孔板混和均匀,室温孵育6 min后测定405 nm处的吸光值。
1.3 数据处理
实验数据以平均值±标准差表示,采用Excel软件进行数据整理及作图,采用SPSS Statistics 23.0软件进行统计分析,Ducan氏法进行显著性差异分析,P<0.05,差异显著。
2 结果与分析
2.1 坛紫菜粉蛋白质含量
本实验所采用的原料坛紫菜的蛋白质含量为21.02%±0.11%(以干基计),远高于海带(10.2%~10.7%)[15]、脆江蓠(10.12%~14.13%)[16]和羊栖菜(6.05%)[17]中蛋白质含量,表明坛紫菜是一种蛋白含量较高的可食用海藻资源。
2.2 单因素实验结果
2.2.1 不同溶剂对提取率的影响 由表2可知,用不同溶剂溶解坛紫菜粉时,进行超声波破碎细胞后得到的蛋白质提取率有所不同,其中以蒸馏水和20 mmol/L pH7.0 PBS为溶剂进行超声波细胞破碎后,蛋白质提取率显著高于以20 mmol/L CaCl2为溶剂时的提取率(P<0.05)。考虑到简便操作,本实验选取蒸馏水为溶剂。

表2 不同溶剂时的坛紫菜蛋白质提取率Table 2 Protein extraction rate of Porphyra haitanensis in different solvents
2.2.2 超声间隔时间对蛋白质提取率的影响 由图1可见,固定超声发生时间为4 s时,随着超声间隔时间的增加,坛紫菜蛋白质的提取率先上升后迅速下降,在4 s时达到最高点,在5~7 s范围内保持平稳,到达8 s时又迅速下降,之后随着超声间隔时间的增加,超声实际作用时间减少,不利于蛋白质的溶出。因此,选择超声细胞破碎仪的占空比为50%(即超声发生时间4 s,超声间隔时间4 s),此时超声破碎效率最高。
2.2.3 料液比对提取率的影响 从图2可见,随料液比的增加,坛紫菜蛋白质提取率呈先上升后下降的趋势。当料液比为50:8 mg/mL时,提取率达到最大,达到47.28%,其他后随着料液比的增加,提取率开始呈下降趋势。这是由于当溶剂用量较低时,藻粉溶液粘度大,液体难以产生空化泡,导致超声波处理效果弱化;随着溶剂用量增大,溶液粘度降低,超声波的空化作用加强,蛋白质提取率上升;当料液比继续增加时,由于细胞壁破裂导致的内容物大量溶出,使得溶液的粘度大幅升高,影响了蛋白质的溶出量,因而提取率下降[18]。此外,料液比过高带来提取液中蛋白质浓度降低的问题,这也是实际生产时应当考虑的问题。
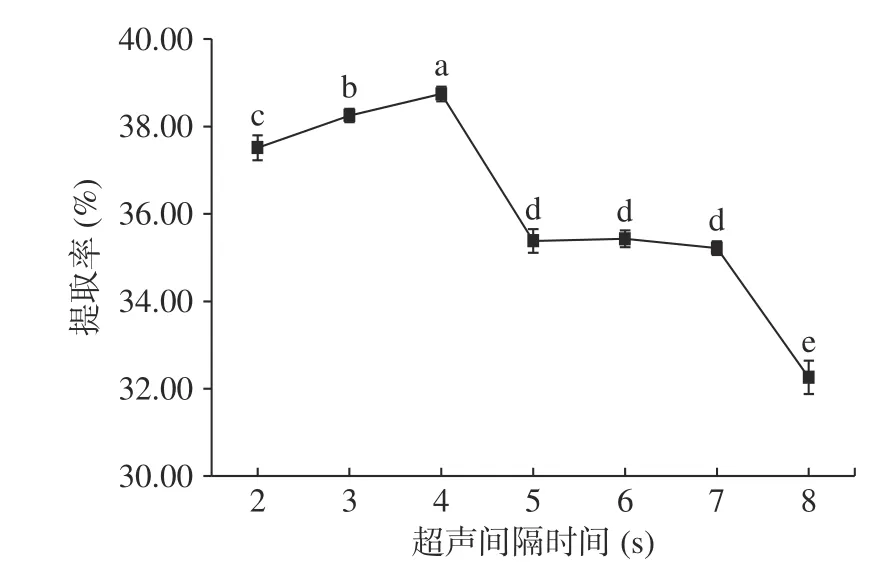
图 1 超声间隔时间对蛋白质提取率的影响Fig.1 Effect of ultrasonic interval time on protein extraction rate
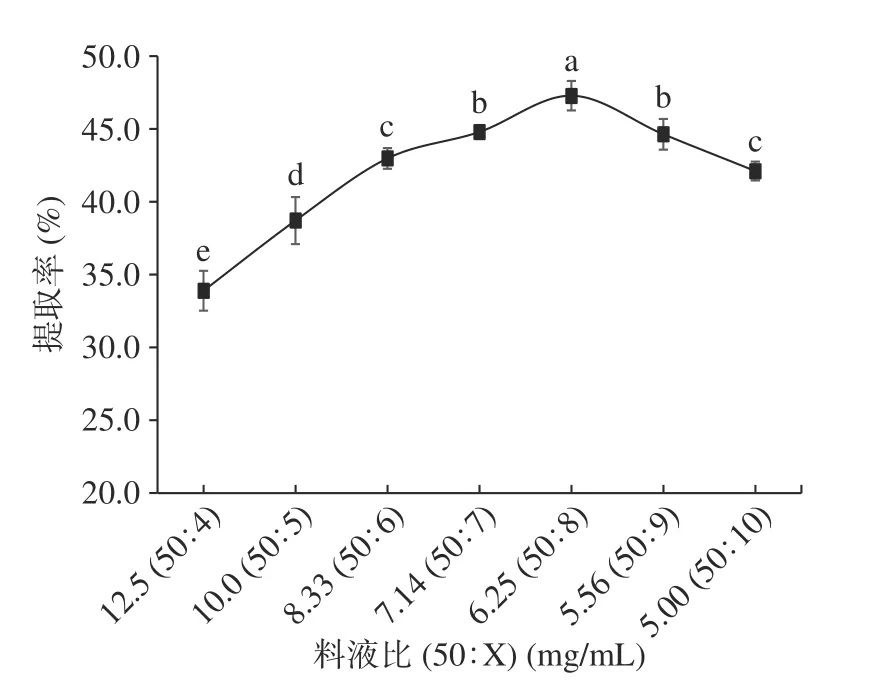
图 2 料液比对蛋白质提取率的影响Fig.2 Effect of solid-liquid ratio on protein extraction rate
2.2.4 pH对蛋白质提取率的影响 由图3可知,在pH3~9范围内,溶液pH对舌状蜈蚣藻蛋白质提取率的影响比较明显。随着pH的增大,提取率呈现先增加随后趋于平衡的趋势,当pH为7时达到最大值。这可能是因为随着pH的升高,两性解离性质使得蛋白质分子的表面电荷增加,蛋白质对水的亲和性增强,与此同时,一部分非水溶性蛋白转变为水溶性的蛋白;但是当pH升高到偏碱性条件时,蛋白质容易变性,导致在水溶液中的溶解度降低,使得提取率稍有降低[19]。
2.2.5 超声功率对提取率的影响 由图4可见,随着超声功率的增加,蛋白质的提取率呈现逐渐提高趋势,在1260 W处到达最高点后降低,各处理组间存在显著性差异(P<0.05)。超声功率影响超声作用,超声功率越高,空化强度越大,超声效果越好,有效成分分离越快。在超声功率较小时,超声强度不足以完全破碎细胞壁,随着空化效应和机械效应的增强,蛋白质分子与水分子之间相互作用增强,促进蛋白质的溶解[20]。到达1260 W时,蛋白质得以完全充分地溶出,然而继续增大超声功率,产生的热效应使部分蛋白质发生变性,形成沉淀,在后续操作中被除去,因此提取率下降。考虑到生产成本和仪器使用寿命,超声波功率选择1080~1440 W较为合适。
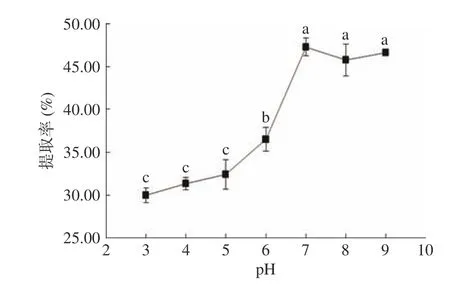
图 3 pH对蛋白质提取率的影响Fig.3 Effect of pH on protein extraction rate

图 4 超声功率对蛋白质提取率的影响Fig.4 Effect of ultrasonic power on protein extraction rate
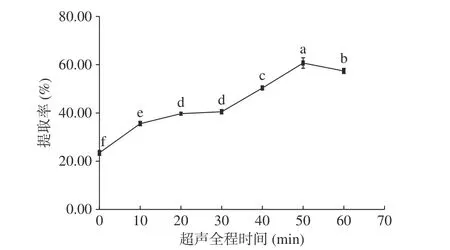
图 5 超声全程时间对蛋白质提取率的影响Fig.5 Effect of whole ultrasonic time on protein extraction rate
2.2.6 超声全程时间对提取率的影响 由图5可见,保持其它条件不变,改变超声全程时间时,坛紫菜蛋白质提取率随时间的延长先升高后下降。与对照组(0 min,即未经过超声处理)相比,处理组的蛋白质提取率显著提高(P<0.05)。由于溶胀作用,对照组中也会有蛋白质溶出,这正是溶胀法提取蛋白的原理。但由于溶胀法的效率太低,不利于实际的大规模生产,同时也说明了利用超声波破碎细胞壁提取蛋白质的必要性。
在0~50 min范围内,随着时间的延长蛋白质提取率升高,这是因为延长超声时间能让更多细胞的细胞壁破碎,使细胞内蛋白质更多地溶解出来。当时间超过50 min时,溶液温度随着超声时间的延长而增高,原本位于蛋白质结构内部的疏水基团暴露,蛋白质分子间通过非共价键相互聚集形成沉淀,因此蛋白质提取率下降[21]。
2.3 正交试验结果与验证实验
由表3可见,各因素对坛紫菜蛋白质提取率的影响程度不一致。影响由大到小分别为:A>C>B,即超声全程时间对提取率的影响最大,其次是超声功率,最后是pH,最优水平组合为A2B2C3,即超声全程时间50 min,pH7,超声功率1350 W。
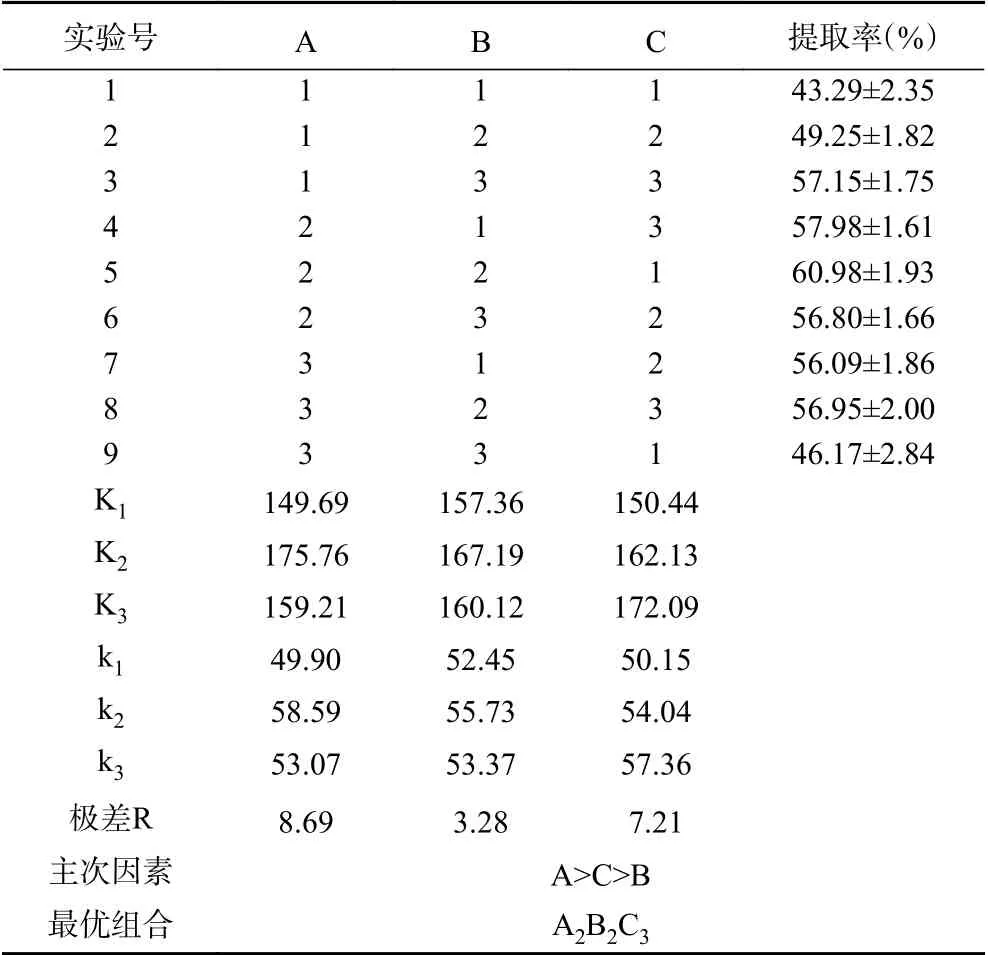
表3 正交试验结果Table 3 Results of orthogonal test
从正交表中可以看出,最优水平组合A2B2C3并不在正交试验的9组实验中,因此在A2B2C3(超声时间50 min,pH7,超声功率1350 W)条件下进行三次验证实验,测得坛紫菜蛋白质的提取率为60.98%±1.01%。以同样作为藻类蛋白的提取工艺为参考,提取率在50%左右[22-24]。
2.4 坛紫菜蛋白质制备过程中的紫外-可见光光谱特征
将超声破碎提取得到的上清液、盐析后蛋白提取液以及透析后的蛋白质溶液进行200~700 nm全波长扫描,得到完整的光谱扫描图如图6~图8所示。
图6中出现了4个吸收峰,分别在326、494、540、668 nm处。326 nm处的特征吸收峰,说明上清液中含有维生素等物质,因为维生素等物质的特征吸收峰在330 nm附近[25]。668 nm处的吸收峰则表明蛋白提取液中含有少量的叶绿素a[26]。
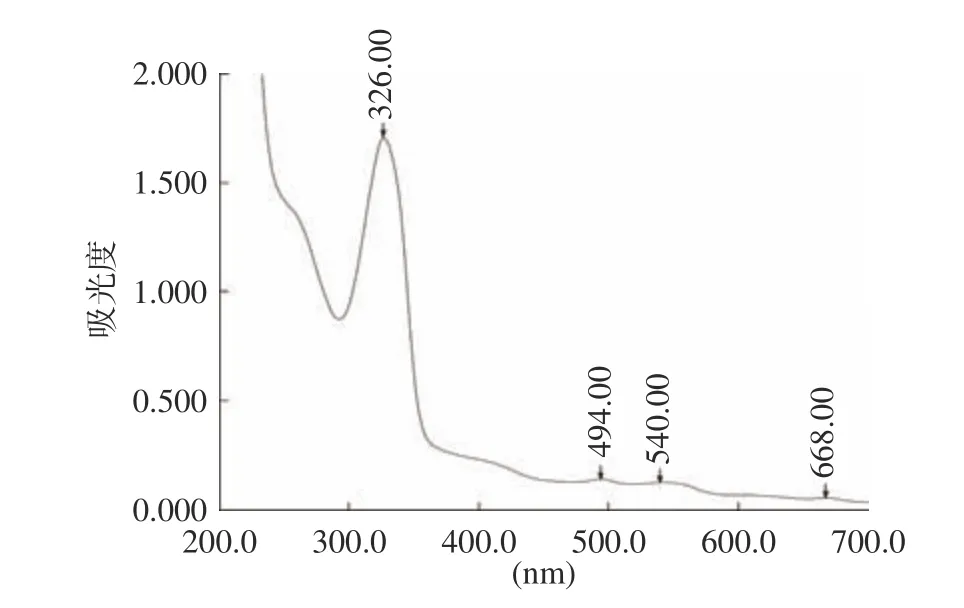
图 6 超声后蛋白提取液吸收光谱图Fig.6 Absorption spectrogram of protein extract after ultrasound
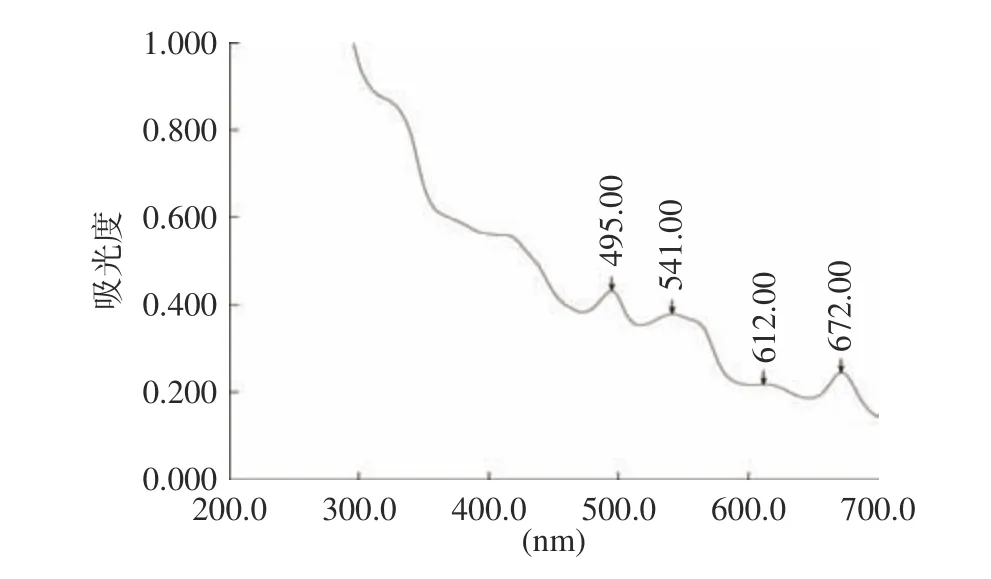
图 7 盐析后蛋白提取液吸收光谱图Fig.7 Absorption spectrogram of protein extract after salting out
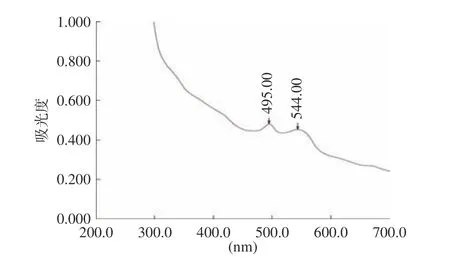
图 8 透析后蛋白提取液吸收光谱图Fig.8 Absorption spectrogram of protein extract after dialysis
如图7所示,盐析后的蛋白提取液的4个吸收峰,分别在495、541、612、672 nm处。与盐析之前对比,326 nm处的高吸收峰消失,说明通过盐析除去了大部分的维生素等杂质。同时,经过硫酸铵盐析,蛋白质的浓度有所提高,从而使得612 nm处的微弱吸收峰显现出来,说明上清液中可能存在藻蓝蛋白,因为藻蓝蛋白的特征吸收峰在620 nm附近。而图8在495和544 nm处存在吸收峰,说明经过透析后,藻蓝蛋白的吸收峰消失,提示若想从坛紫菜蛋白质提取物中进一步获得高纯度的藻红蛋白,盐析和透析等分离纯化操作是必要的[27]。
从图6~图8可以看出,上清液在220~280 nm曲线吸收较高,是因为大部分氨基酸在紫外区的吸收峰多集中在200~220 nm,苯丙氨酸(Phe)的吸收峰在222与259 nm,酪氨酸(Tyr)的吸收峰在231及272 nm,色氨酸(Trp)的吸收峰在227与279 nm[26]。
同时,通过对比超声提取液、盐析液及透析后溶液吸收光谱的特征吸收峰,可以发现吸收峰的红移现象,如表4所示。据文献报道,蛋白质的纯度、溶液pH不同都会影响其光谱特性[27]。

表4 坛紫菜蛋白质制备过程中溶液吸收光谱图的特征吸收峰Table 4 Characteristic absorption peaks of solution absorption spectra during protein preparation of Porphyra haitanensis
2.5 坛紫菜蛋白质的特性
2.5.1 等电点 由图9可见,当pH在3~9变化时,吸光度值先下降然后上升,在pH4.5时,吸光度达到低谷,蛋白质的溶解度最小,说明此点即为坛紫菜蛋白质的等电点。

图 9 蛋白质等电点测定结果Fig.9 Determination results of protein isoelectric point
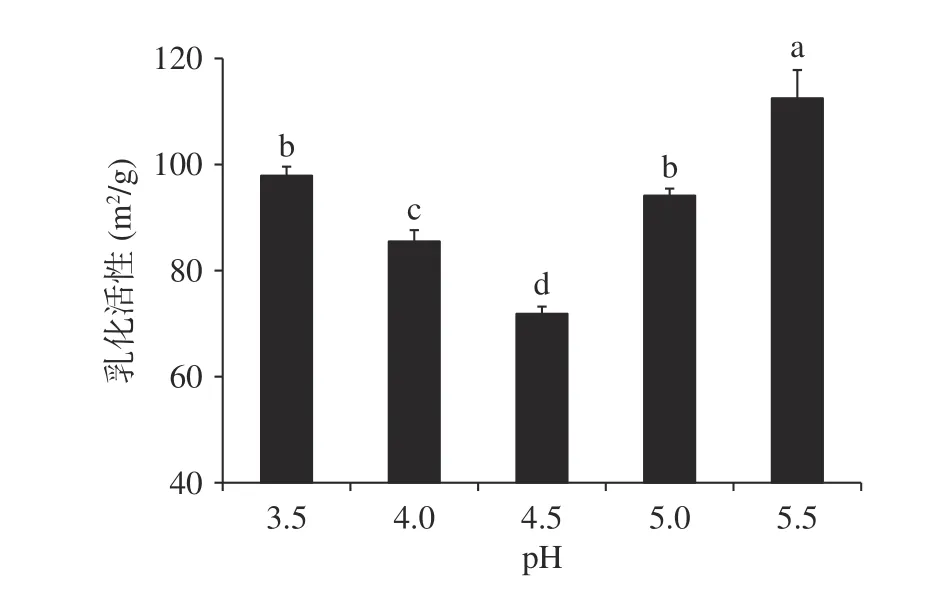
图 10 坛紫菜蛋白质的pH-乳化活性Fig.10 pH-emulsifying activity of Porphyra haitanensis protein
2.5.2 乳化性质 图10所示为坛紫菜蛋白质的乳化活性(EAI)随pH的变化情况。从图中可看出,在3.5~5.5范围内,随着pH增大,蛋白质的乳化活性先减弱后增强,在pH4.5时乳化活性最差。接近pI时,蛋白质溶解度小,对乳化作用的影响小。偏离pI时,蛋白质氨基酸侧链的离解,产生了有利于乳化体系稳定的静电斥力,避免了液滴聚集[28]。
由图11可见,与乳化活性一致,pH4.5时坛紫菜蛋白质的乳化稳定性达到最低值。这可能是由于蛋白浓度较低时,分子间相互作用较大,蛋白质与油相互作用较小,因此空气-油界面形成的膜较薄且不稳定[29]。坛紫菜蛋白在pH5.5时乳化活性可达112.49±5.33 m2/g,乳化稳定性为40.52±1.08 min,其乳化活性远高于吴凤娜[30]提取的海带蛋白(40 m2/g),但乳化稳定性与其(105 min)相比则较低。这也提示,坛紫菜蛋白质具有开发成天然乳化剂的潜力,可通过物理、化学和生物学方法对其进行蛋白质改性,使其获得更加良好的乳化性质。
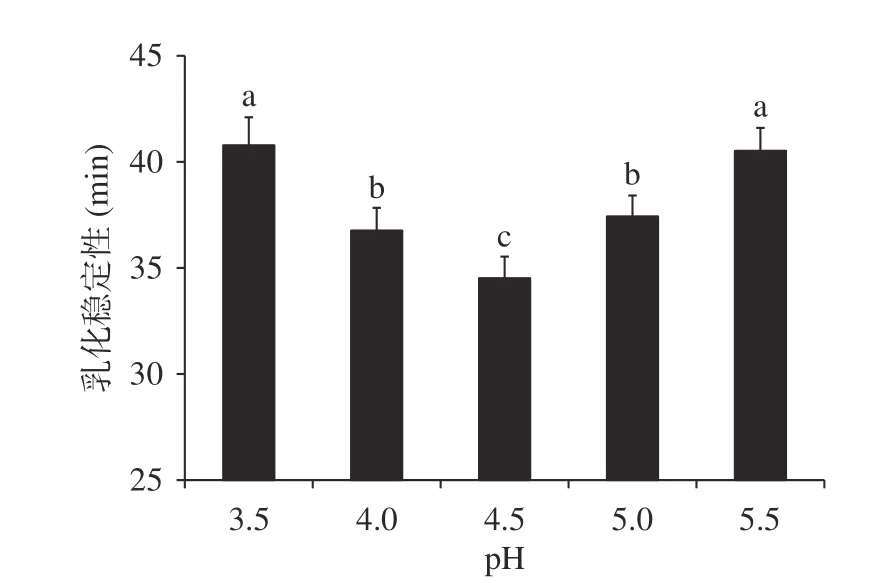
图 11 图11 坛紫菜蛋白质的pH-乳化稳定性Fig.11 pH-emulsifying stability of Porphyra haitanensis protein
2.5.3 起泡性质 由图12可见,在pH3.5~5.5范围内,随着pH增大,坛紫菜蛋白质的起泡性呈现先减弱后增强的趋势,在pH4.5时起泡性最差。这可能是由于偏离蛋白质等电点时,蛋白质的溶解性增强,使蛋白质黏度下降,从而增加了蛋白质的起泡性。在pH3.5~5.5时,坛紫菜蛋白质的起泡性在20.25%~24.75%范围内变动,而李玉娥等[31]提取的燕麦分离蛋白在pH2~9时,起泡性在8%~21%范围内变动。
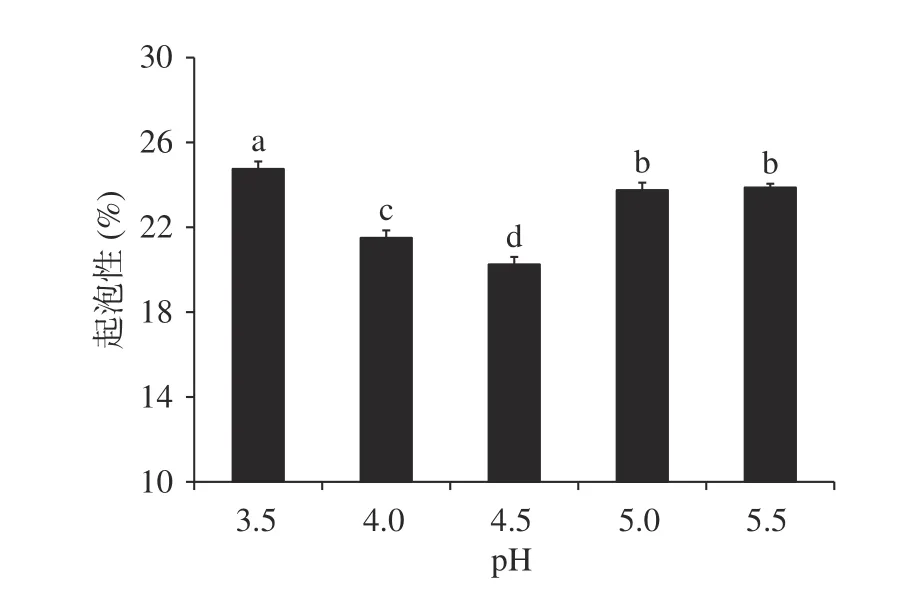
图 12 pH对蛋白质起泡性的影响Fig.12 Effect of pH on protein foaming
由图13可见,坛紫菜蛋白质的泡沫体系在接近pI时很稳定,一般来说具有良好发泡能力的蛋白质其泡沫稳定性一般很差。坛紫菜蛋白质在pH4.5时泡沫稳定性可达80.84%±2.95%,而许英一等[32]从提取的燕麦蛋白的泡沫稳定性最高在60%左右,吴凤娜[30]提取的海带蛋白的泡沫稳定性最高在80%左右,说明本实验提取的坛紫菜蛋白质具有良好的泡沫稳定性。
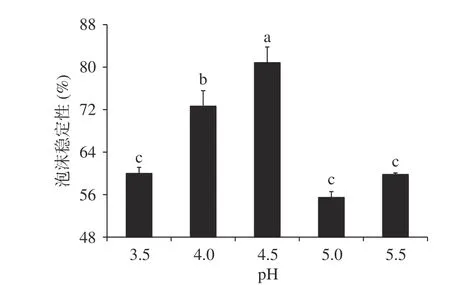
图 13 pH对蛋白质起泡稳定性的影响Fig.13 Effect of pH on protein foaming stability
2.6 坛紫菜蛋白质的抗氧化能力
2.6.1 总抗氧化能力 由图14可知,在0~50 mg/mL范围内,随着浓度提高,坛紫菜蛋白质总抗氧化能力先提高后趋于稳定,存在一定的量效关系。当浓度为50 mg/mL时,坛紫菜蛋白质的T-AOC值为2.89±0.09 U/mL,表明坛紫菜蛋白具有一定的抗氧化能力。总抗氧化能力(T-AOC)能够反映被测物中各种抗氧化物质和抗氧化酶等构成的总抗氧化水平,在医学领域、生物学研究中用于检测各种抗氧化物溶液的综合抗氧化活性。实验结果显示坛紫菜蛋白质具有开发为天然抗氧化剂的潜力。
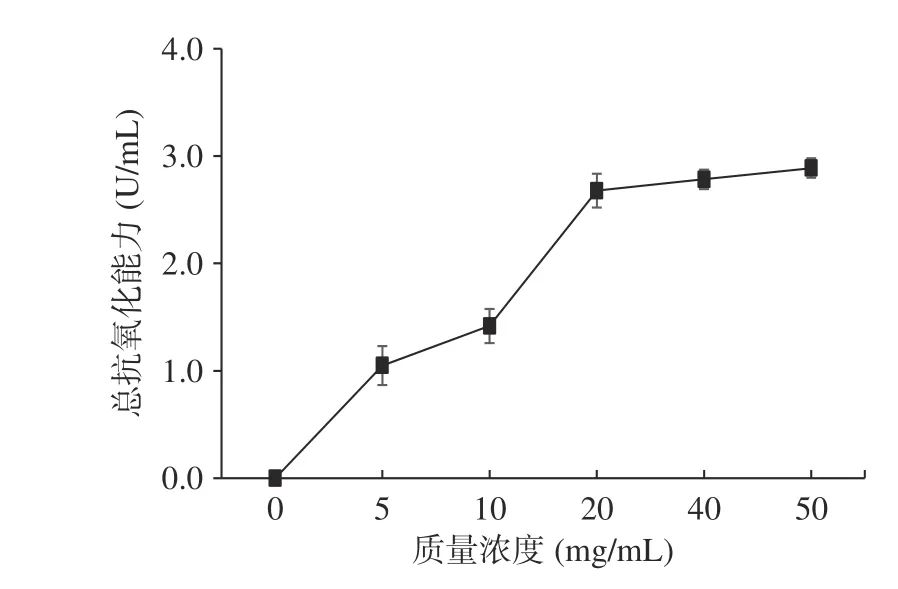
图 14 坛紫菜蛋白质的总抗氧化能力Fig.14 Total antioxidant capacity of Porphyra haitanensis protein
2.6.2 DPPH自由基清除能力 坛紫菜蛋白质对DPPH的清除作用见图15。在0~10 mg/mL范围内,坛紫菜蛋白质对DPPH自由基表现出一定的清除活性,且与其浓度水平成量效关系,即随浓度得升高,对DPPH的清除率也增强。经SPSS 22.0软件计算,其DPPH半数清除浓度IC50为3.79 mg/mL。坛紫菜蛋白质对DPPH的清除作用低于Trolox。
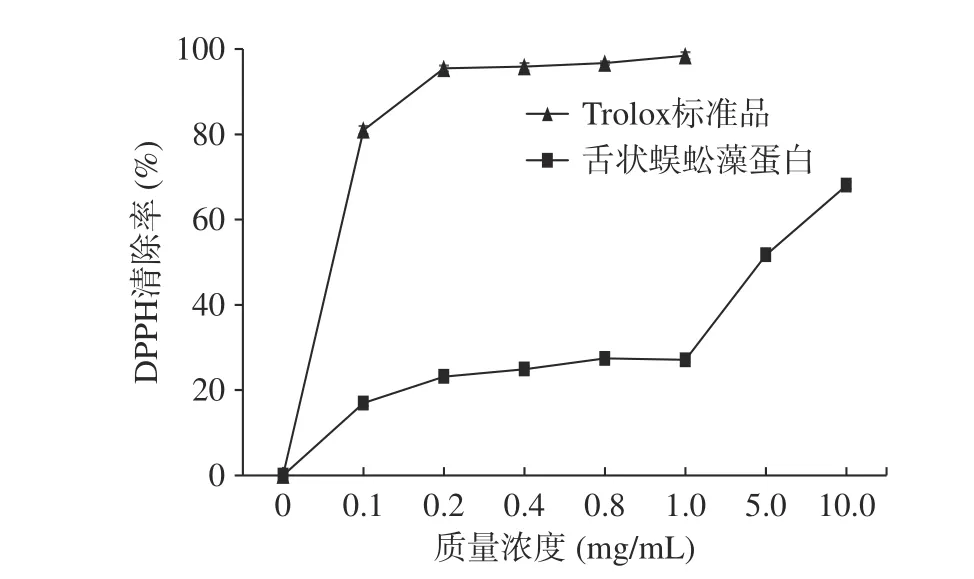
图 15 坛紫菜蛋白质的DPPH自由基清除能力Fig.15 DPPH free radical scavenging capacity of Porphyra haitanensis protein
当坛紫菜蛋白浓度10 mg/mL时,对DPPH的清除率达到68.04%±0.73%。而胡双飞等[14]所提取的螺旋藻粗蛋白,其DPPH清除率在10 mg/mL时接近60%,显著高于传统水提取方法提取的粗蛋白DPPH清除率,表明本实验所提取的坛紫菜蛋白质具有较强的DPPH自由基清除能力。
2.6.3 ABTS+自由基清除能力 以Trolox浓度为横坐标,OD值为纵坐标绘制标准曲线,如图16所示。
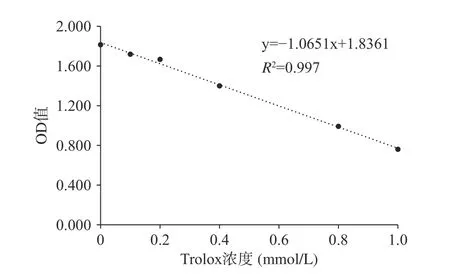
图 16 Trolox溶液标准曲线Fig.16 Standard curve of Trolox solution
如图17所示,当样品浓度从5到50 mg/mL时,坛紫菜蛋白质的TEAC值先增加后趋于稳定,表明坛紫菜蛋白质对ABTS+自由基有一定的清除作用。当蛋白浓度为50 mg/mL时,TEAC值达到0.83±0.08 mmol/L,即相当于具有0.83倍Trolox的ABTS+自由基清除能力。

图 17 坛紫菜蛋白质的TEAC值Fig.17 TEAC value of Porphyra haitanensis protein
由上述抗氧化结果分析可知,当坛紫菜蛋白质浓度在一定范围内增加时,清除自由基的能力也逐渐增强。增大到一定程度时,清除自由基的能力增长的趋势越来越缓慢,清除率难以达到较高水平。有文献报道,蛋白质在经体外模拟胃肠液消化后抗氧化能力增强[33-34],而与蛋白质消化产物的抗氧化作用紧密相关的是消化产物中的小分子肽类。生物活性肽所具有的功能活性比蛋白质更加丰富,这也提示,对于坛紫菜蛋白质的开发利用,可以从酶解获得生物活性肽的方面进行研究。
3 结论
本研究以坛紫菜为原料,确定了超声辅助提取坛紫菜蛋白质的最适提取工艺,其提取率达到60.98%±1.01%;对所提取的坛紫菜蛋白质特性指标和抗氧化特性分析显示其溶液具有较好的泡沫稳定性,坛紫菜蛋白质在5~50 mg/mL范围内具有较强的抗氧化活性,浓度为50 mg/mL时,总抗氧化能力为2.89±0.09 U/mL,ABTS+自由基清除能力相当于0.83±0.08 mmol/L Trolox,DPPH清除率在10 mg/mL时达到68.04%±0.73%。本研究内容是对坛紫菜蛋白质提取工艺和其特性的初步研究,下一步有待对其分离纯化,分子结构等方面开展研究,并根据其特性将提取到的坛紫菜蛋白应用于食品、化工等领域以发挥其功效作用。
