响应面法优化牛初乳免疫球蛋白热保护剂的配方
2022-06-11刘爱国刘立增
杨 红,刘爱国, ,刘立增,强 锋,杨 毅
(1.天津商业大学生物技术与食品科学学院,天津市食品与生物技术重点实验室,天津 300134;2.天津天狮学院,天津 301700;3.彼特锐斯(天津)商贸有限公司,天津 300300)
随着经济的迅速发展,功能性保健食品越来越受到大众的青睐,牛初乳作为一种富含免疫活性物质的功能性食品原料,在食品市场受到广泛关注。牛初乳是健康奶牛正常产犊三天内从乳腺分泌出来的乳汁,含有大量的优质蛋白质、维生素、矿物质、生物活性成分以及20多种病原体特异性抗体[1],因其具有增强人体免疫力[2]、促进组织生长[3]、预防上呼吸道感染[4]、修复受损组织[5]和调节肠道菌群[6]的功效,已成为近年来国内外研究热点。
IgG是牛初乳中最重要的生物活性蛋白之一,其是以二硫键连接两条重链和两条轻链,由四个多肽亚单位组成的“Y”型四肽链分子。新鲜的牛初乳中IgG的质量浓度是30~87 mg/mL[7],大约是常乳的50倍,具有极高的营养价值,因此,开发以牛初乳为原料的新型功能性食品具有一定的实际意义。但是IgG易受外界受热、酸、碱等不良环境因素影响而变性[8],牛初乳在实际食品加工过程中要经过巴氏杀菌和喷雾干燥等热处理工艺,IgG活性损失极为严重,其营养功效不能充分展现,因此,提高IgG的稳定性从而有效发挥其生理活性尤为重要。
目前对牛初乳IgG活性保护的相关研究已有报道,在牛初乳中加入糖、多元醇和氨基酸等物质具有的保护作用,可以有效提高牛初乳IgG的稳定性[9],研究表明,可能是由于这些物质增强了IgG分子中疏水相互作用,也可能是添加保护剂后的溶液中蛋白质分子优先溶剂化进而导致蛋白质的表面张力和溶液黏度的增加[10],在一定程度上,氨基酸对IgG的保护作用可能是由氨基酸的羧基引起的,不同种类的氨基酸因其羧基基团的数量和位置不同,其保护效果也存在明显差异[11]。Chao等[10]以蔗糖、乳糖、葡萄糖、半乳糖和麦芽糖等物质作为IgG热保护剂,研究发现,添加5%的果糖或麦芽糖保护效果最好,可以将残留IgG含量提高到31%,添加量大于30%会导致残留IgG含量下降。雷昌贵等[12]选取常用食品添加剂等对牛初乳IgG的热稳定性的影响进行探讨,研究发现磷酸氢二钠、蔗糖、乳酸钙、葡萄糖、羧甲基纤维素钠等食品添加剂对IgG有一定的保护作用。但以上相关报道主要集中在探究单一种类的物质对其活性的影响,且添加的物质缺乏功能性,关于IgG复合热保护剂的研究鲜有报道。
因此,本研究以牛初乳IgG作为研究对象,采用菊粉、甘氨酸、麦芽糖醇制备成复合热保护剂,以IgG活性保留率为响应值,采用响应面法对IgG复合热保护剂配方进行优化,并通过傅里叶变换红外光谱和内源性荧光光谱表征不同方式处理的牛初乳IgG结构。旨在为IgG在实际生产加工过程中的活性保持技术提供新思路,为牛初乳这一优质功能性食品原料的高值利用提供一定理论依据。
1 材料与方法
1.1 材料与仪器
牛初乳(产犊48 h内) 天津嘉立荷牧业有限公司第五牧场;凝乳酶(890 U) 山东悠乐滋生物科技有限公司进口分装;IgG标准品(36 μg/mL) 厦门慧嘉生物科技有限公司;麦芽糖醇、甘氨酸 食品级,河南万邦实业有限公司;菊粉 食品级,重庆骄王天然产物股份有限公司;磷酸二氢钾、磷酸氢二钠、硫酸铵分析纯,天津市光复科技发展有限公司;ELISA试剂盒 厦门慧嘉生物科技有限公司。
FA2004A电子天平 上海精天仪器有限公司;HW-S24电热恒温水浴锅 上海一恒科学仪器有限公司;EL20实验室pH计 梅特勒-托利多仪器有限公司;TG16-WS台式高速冷冻离心机 长沙湘仪离心机仪器有限公司;F-4600荧光分光光度计 日立高新技术公司;Nicolet傅里叶变换红外光谱仪 美国尼高力仪器有限公司;Spark-10M酶标仪 帝肯上海贸易有限公司。
1.2 实验方法
1.2.1 免疫球蛋白的提取 参照徐钦[13]的方法,并稍作修改,牛初乳于4 ℃,1000 r·min-1离心20 min除去上层脂肪,在脱脂后的牛初乳中,加入0.02%的凝乳酶反应30 min后,于4 ℃,8000 r·min-1离心30 min得到去除酪蛋白的乳清液。按1:1比例向乳清液中加入PBS缓冲液(pH7.4,0.01 mol/L),再缓慢滴加2倍于乳清体积的饱和(NH4)2SO4至终浓度为50%,4 ℃静置24 h后,于4 ℃,8000 r·min-1离心30 min,将沉淀用5%原乳清体积的PBS缓冲液(pH7.4,0.01 mol/L)溶解后装入透析袋,4 ℃透析48 h,中间更换溶液2~3次。以1% BaCl2或纳氏试剂检测透析液,直至无SO42-或NH4+出现为止,将透析所得产物冷冻干燥后即得IgG粗提物,-20 ℃储存待用。
1.2.2 IgG活性保留率计算 准确称取IgG粗提物5 g溶于PBS缓冲液(pH7.4,0.01 mol/L)中制成5 g/L的免疫球蛋白稀溶液备用,在室温条件下,用涡旋混合器充分混匀,在不同质量浓度下将热保护剂添加至IgG粗提物的稀释溶液中,待热保护剂充分溶解后,于75 ℃水浴5 min后立即用冰水水浴[14],空白对照组不添加任何热保护剂在同样条件下进行热处理。采用IgG酶联免疫试剂盒测定IgG质量浓度,按照试剂盒说明书进行操作,在450 nm处测得样品的吸光度,用下式计算IgG活性保留率[15]。

式中:a表示IgG加热后质量浓度,μg/mL;b表示IgG加热前质量浓度,μg/mL。
1.2.3 单因素实验 以IgG活性保留率为指标,分别选取甘氨酸添加量(0.1%、0.3%、0.5%、0.7%、0.9%)、菊粉添加量(5%、10%、15%、20%、25%)、麦芽糖醇添加量(5%、10%、15%、20%、25%)进行单因素实验,考察不同因素对牛初乳中IgG活性保留率的影响(每组因素添加量的中间值为固定添加量)。
1.2.4 响应面试验设计 在单因素实验的基础上,根据中心组合Box-Behnken设计原理,以IgG活性保留率为响应值,选取甘氨酸、菊粉和麦芽糖醇作为响应因子,进行3因素3水平响应面试验设计,确定IgG的最优复合热保护剂配方,试验因素水平见表1。
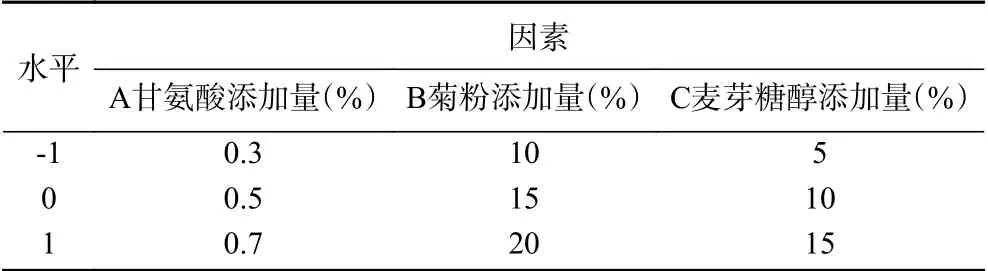
表1 响应面设计因素与水平Table 1 Factors and levels of response surface experiment
1.2.5 傅里叶红外变换光谱分析 根据曲金萍等[16]的方法用红外光谱测定样品的二级结构,将光谱纯KBr研磨成细粉,将待测样品与干燥的KBr按质量比50:1充分混合,制成均匀的圆形透明薄片,用红外光谱仪进行红外光谱扫描,得到红外光谱扫描图,用KBr制作空白压片。红外光谱分析条件为:透射模式,扫描波数4000~400 cm-1,扫描次数32次,分辨率4 cm-1,每个样品做三次平行实验。采用ONMIC软件对数据图像进行处理,并对样品的红外图谱进行基线校正、对酰胺I带区域进行傅里叶自去卷积计算,分开重叠在一起的不同峰,在二阶导数谱图基础上进行高斯拟合,根据分开峰的位置确定子峰的归属,通过计算子峰的峰面积,求出拟合后的样品二级结构含量(用百分数表示)。
1.2.6 内源性荧光光谱分析 采用1.2.2的方法制备5 g/L免疫球蛋白溶液,采用F-4600荧光分光光度计在280 nm下的激发波长下,测定溶液的荧光强度。荧光分光光度计分析条件为:激发波长为280 nm,扫描记录区间为300~400 nm,激发和发射狭缝宽度设置为10 nm,数据采集速度为60 nm/min,光电倍增管电压为400 V。
1.3 数据处理
采用Design-Expert.V8.0.6软件进行响应面试验设计,采用SPSS18.0软件进行数据分析,采用Origin 9.5软件对数据进行绘图,采用SPSS(P<0.05)软件中ANOVA方法对数据进行差异显著性检验分析,所有试验均平行测定3次。
2 结果与分析
2.1 IgG的标准曲线
按照1.2.2方法进行检测,用ELISA试剂盒于450 nm波长处测定不同质量浓度IgG标准品的吸光度值,以IgG标准品的质量浓度为横坐标,吸光度值为纵坐标。所获得的标准曲线方程为:y=0.151x+0.0483(R2=0.9992),说明测定的浓度范围内标准曲线的相关性良好,后续IgG含量测定均使用此方程进行计算。
2.2 IgG粗提物红外光谱分析
蛋白质或多肽在1700~1200 cm-1红外光谱区有明显的特征吸收带,其中酰胺I带和II带为强吸收带,酰胺III带为弱吸收带,这些吸收带能反映蛋白质的二级结构变化[17]。酰胺I带的谱峰归属是目前研究相对较为成熟的[18]:1610~1640 cm-1为β-折叠;1640~1650 cm-1为无规卷曲;1650~1658 cm-1为α-螺旋;1660~1695 cm-1为β-转角。采用1.2.1的方法将牛初乳中IgG进行提取得到其粗提物,将IgG标准品和IgG粗提物在4000~400 cm-1波数范围内进行扫描。图1显示了IgG标准品和IgG粗提物的红外图谱,与IgG标准品相比,牛初乳中的IgG经过提取后,粗提物中均保留了特征峰,说明提取过程对IgG的结构性质方面的影响不大,基本保持了IgG原有的结构。
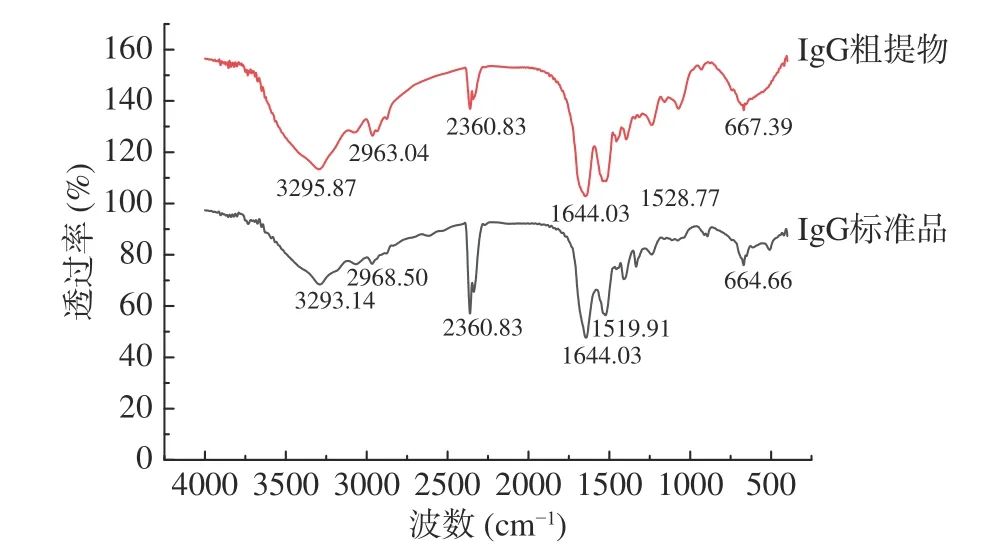
图 1 IgG标准品与粗提物的红外光谱对比Fig.1 FT-IR spectra comparison of IgG standard sample and crude extract
2.3 单因素实验结果
2.3.1 不同添加量甘氨酸对IgG活性保留率的影响
不同添加量甘氨酸对IgG活性保留率的影响结果如图2所示,据文献研究报道,甘氨酸对于牛初乳IgG的热保护效果较好[19]。不添加任何热保护剂时,在75 ℃条件下处理5 min,IgG活性保留率仅为20.34%。由图2可以看出,当甘氨酸添加量从0.1%提高到0.3%时,IgG活性保留率32.64%提高到36.56%。当甘氨酸的添加量达0.5%时,IgG活性保留率与添加量为0.3%时无显著差异,当添加量达到0.7%时,IgG活性保留率显著下降(P<0.05),这可能是由于IgG分子的结合部位全部被占用后,继续添加甘氨酸反而抑制了对IgG的热保护作用[20],因此,选取适当的甘氨酸添加量尤为重要,适当添加甘氨酸可以提高牛初乳IgG的活性保留率,添加量过多则会带来负面效果,终选定甘氨酸添加量0.5%为响应面设计中心点。
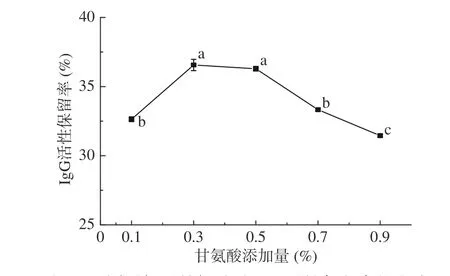
图 2 不同添加量甘氨酸对IgG活性保留率的影响Fig.2 Effect of different additions of glycine on the retention rate of IgG
2.3.2 不同添加量菊粉对IgG活性保留率的影响不同添加量菊粉对IgG活性保留率的影响结果如图3所示,由图3可知,随着菊粉添加量的增加,样品中IgG活性保留率呈现先上升后下降的变化趋势,当菊粉量超过10%以后,只能使IgG活性保留率轻微上升,可能的原因是当菊粉添加量达到一定的浓度后,IgG能够与羟基结合的部位基本上被全部占用,无法增强IgG分子中疏水相互作用[20-21],当菊粉添加量超过15%(m/V)以后,IgG活性保留率开始显著下降(P<0.05)。由单因素方差分析可知,不同添加量的菊粉对IgG活性保留率的影响存在显著差异(P<0.05),最终选定菊粉添加量15%为响应面设计中心点。
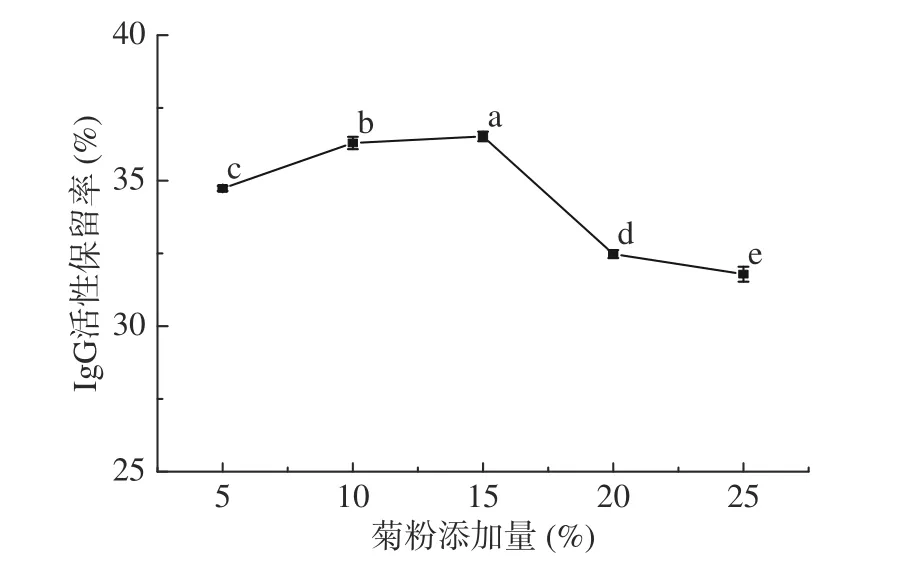
图 3 不同添加量菊粉对IgG活性保留率的影响Fig.3 Effect of different addition amount of inulin on the retention rate of IgG
2.3.3 不同添加量麦芽糖醇对IgG活性保留率的影响 不同添加量麦芽糖醇对IgG活性保留率的影响结果如图4所示,由图4可知,随着麦芽糖醇添加量的增加,样品中IgG活性保留率呈现先上升后平缓的变化趋势,这与罗磊等[21]研究结果一致,当麦芽糖醇添加量达到10%以后,添加更多的麦芽糖醇只能使IgG活性保留率些许上升,最后趋于平缓,且15%、20%、25%添加量的活性保留率并无显著性差异(P>0.05),推测其原因与菊粉相似,因为麦芽糖醇和菊粉同为多羟基化合物。由单因素方差分析可知,不同添加量的麦芽糖醇对IgG活性保留率的影响存在显著性差异(P<0.05),但10%、15%、20%和25%的麦芽糖醇添加量的活性保留率均无显著差别,考虑到食品中糖醇类物质不能添加过多[22],因此最终选定麦芽糖醇添加量10%为响应面设计中心点。
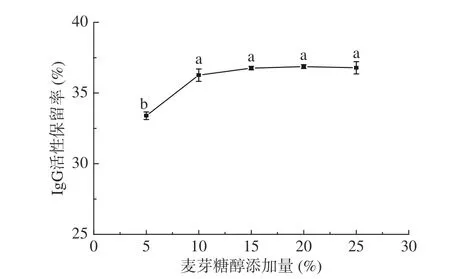
图 4 不同添加量麦芽糖醇对IgG活性保留率的影响Fig.4 Effect of different addition amounts of maltitol on the retention rate of IgG

图 5 甘氨酸添加量和菊粉添加量的交互作用对IgG活性保留率的响应面图和等高线图Fig.5 Response surface plot and contour plot of the interaction between glycine supplemental level and inulin supplemental level on IgG retention
2.4 响应面试验优化结果
2.4.1 响应面试验设计及结果 在单因素实验的基础上,根据中心组合Box-Behnken设计原理进行响应面优化试验,随机进行17组试验,试验方案及结果如表2所示。
2.4.2 模型建立及拟合分析 采用Design Expert 8.0.6软件对表2的试验结果进行多元非线性回归拟合,得到IgG保留率(Y)对甘氨酸添加量(A)、菊粉添加量(B)、麦芽糖醇添加量(C)的二次回归方程:Y=36.34-0.37A-0.24B+1.15C+1.65AB-0.88AC+0.90BC-4.30A2-1.57B2-1.49C2。
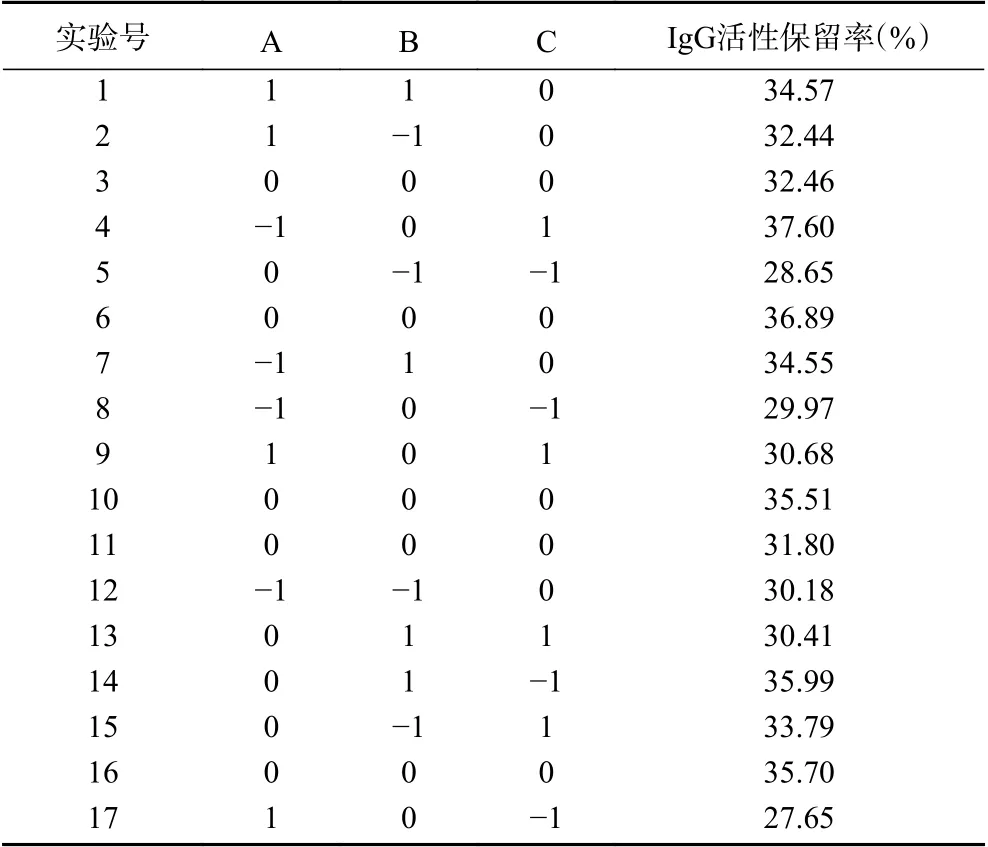
表2 响应面试验结果Table 2 Results of response surface experiment
为检验该二次回归方程的有效性,对IgG保留率的数学模型进行模型系数显著性检验和方差分析,结果见表3,该回归模型极显著(P<0.01),失拟项不显著(P>0.05),这两种结果均表明多元回归模型拟合方程在回归区域内拟合较好,理论误差值较小,可用该回归模型对牛初乳IgG热保护剂的最优配方进行预测。模型多元决定系数R2=94.51%,校正决定系数R2adj=87.46%,说明响应值(IgG活性保留率)的变化有94.51%来自于所选的变量(甘氨酸、菊粉和麦芽糖醇的添加量)。各因素的F值可以反映各因素对试验指标的重要性,F值越大,表明对响应值IgG活性保留率的影响越大。由表3可知,各因素对IgG活性保留率的影响顺序为:C(麦芽糖醇添加量)>A(甘氨酸添加量)>B(菊粉添加量)。从表3中还可以看出,二次项A2对结果有极高显著的影响(P<0.001),一次项C、交互项AC、二次项B2和二次项C2对结果的影响为显著(P<0.05),这表明各因素对响应值(IgG活性保留率)不是简单的线性关系。
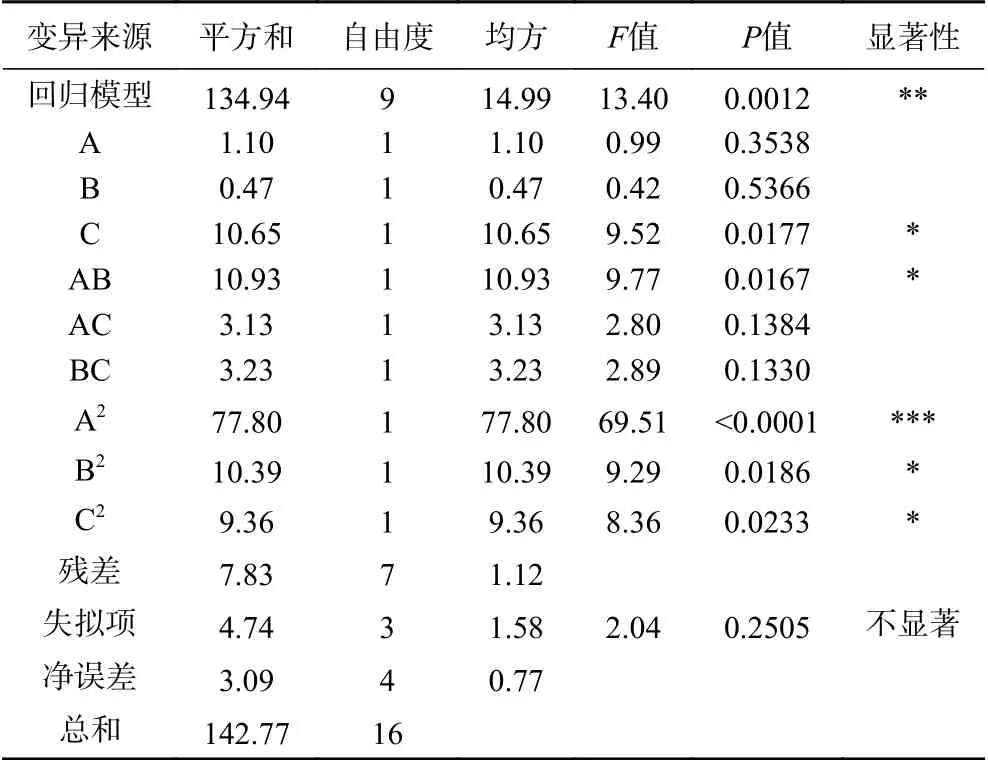
表3 回归模型方差分析Table 3 Analysis of variance of regression model
2.4.3 两因子间交互作用分析 通过Design Expert 8.0.6软件对回归方程进行分析,得到两个交互项之间的响应面图及等高线图,如图5~图7所示。响应面图曲面的坡度和等高线的形状可以较为直观地反映出各因素的交互作用影响的大小[23]。曲面坡度越陡峭,表明两个变量交互作用越显著,反之则不显著;等高线的形状为椭圆形表示交互作用对响应值的影响显著,而圆形则表示交互作用对响应值的影响不显著。由图5、图6、图7可知,菊粉和甘氨酸添加量的响应面曲面坡度较为陡峭,等高线图越接近椭圆,说明这两个变量的交互作用对响应值具有显著性影响,菊粉和麦芽糖醇添加量交互作用的响应面曲面坡度较为平缓,等高线图越平缓近似圆形,说明彼此之间的交互作用越弱。

图 6 甘氨酸添加量和麦芽糖醇添加量的相互作用对IgG活性保留率的响应面图和等高线图Fig.6 Response surface plot and contour plot of the interaction between glycine and maltitol supplemental levels on IgG retention
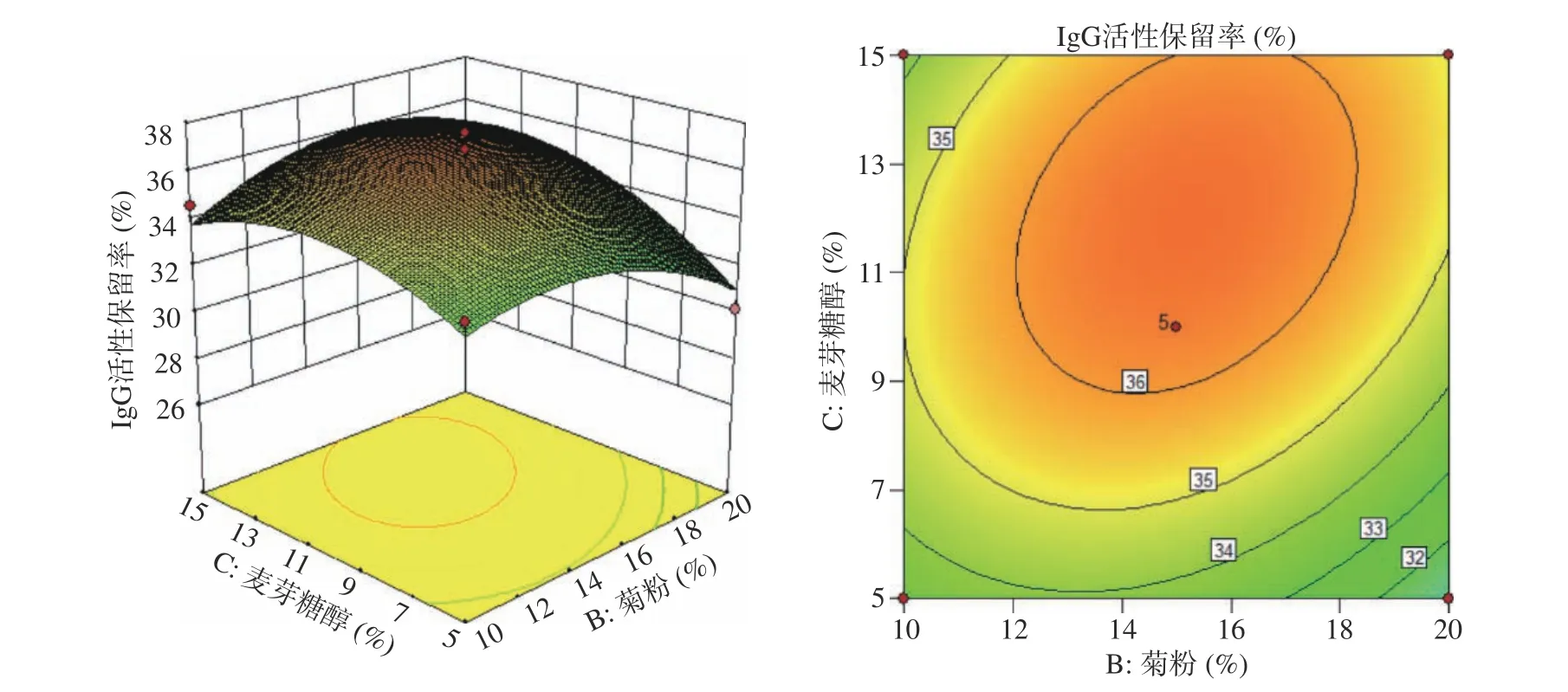
图 7 菊粉添加量和麦芽糖醇添加量的相互作用对IgG活性保留率的响应面图和等高线图Fig.7 Response surface plot and contour plot of the interaction between inulin and maltitol supplemental levels on IgG retention
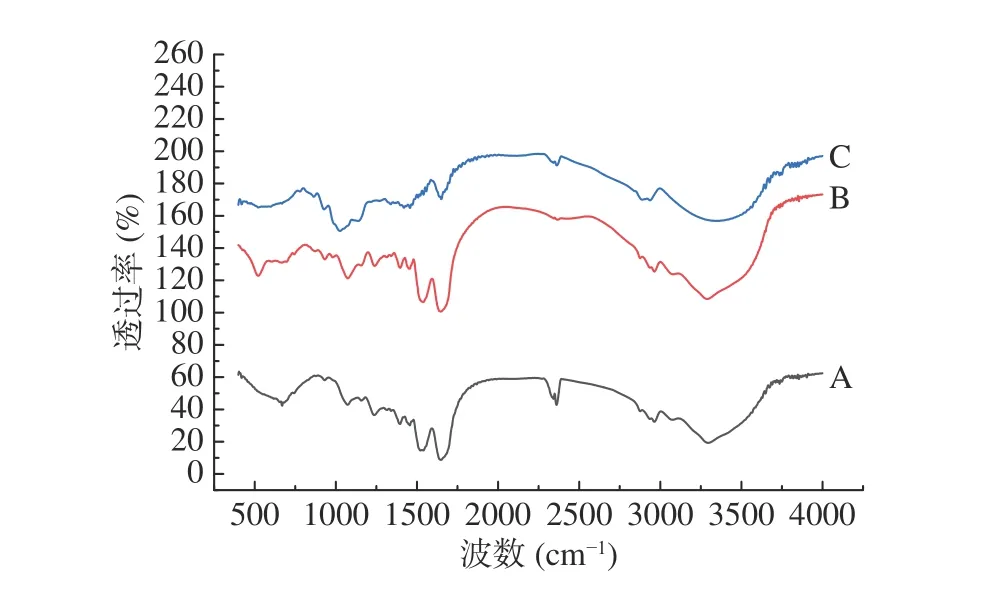
图 8 不同处理方式下IgG的FT-IR谱图Fig.8 FT-IR spectra of IgG under different ways
通过Design Expert 8.0.6软件对方程求极大值,得到牛初乳IgG复合热保护剂最优配方:甘氨酸添加量0.48%,麦芽糖醇添加量12.50%,菊粉添加量14.98%,此时IgG活性保留率36.59%。考虑到试验过程实际操作的可行性,将最佳配方调整为甘氨酸添加量0.50%,麦芽糖醇添加量12.50%,菊粉添加量15.00%,按此条件下,进行3次重复验证试验,结果取平均值,得到牛初乳IgG保留率38.11%±0.84%,验证值与预测值的误差在允许范围5%内,说明该模型合理可靠。
2.5 傅里叶变换红外光谱分析
傅里叶变红外换光谱可快速有效地测定蛋白质的二级结构。蛋白质的傅里叶红外图谱一般有3组特征吸收带,分别是酰胺I带、酰胺II带和酰胺III带,对应的波数分别为1700~1600 cm-1、1550~1530 cm-1、1330~1260 cm-1[24]。酰胺I带对蛋白质二级结构较为敏感,因此,红外图谱的酰胺I带(1700~1600 cm-1)是研究蛋白质的二级结构最有价值的区域,其红外吸收峰主要是由C=O的伸缩震动引起的,且吸收最强。利用傅里叶变换红外光谱仪对不同方式处理的IgG样品进行全波段扫描,结果如图8所示。由图8可知,IgG红外光谱图中于3300 cm-1左右呈现强而宽的吸收峰,表明IgG分子多聚体中可能存在许多分子内或分子间氢键,不同条件下处理的IgG样品红外图谱形状趋势相似,对比未经热处理的IgG样品的红外图谱,加热处理后的蛋白样品红外光图谱的特征峰强度明显减弱,表明热处理可以造成IgG样品二级结构的转化和改变。
热处理会破坏分子内的氢键作用,影响蛋白质的二级结构单元比例,使蛋白质结构部分分解折叠,导致无序结构增加,表现为β-转角和无规则卷曲含量增加[25]。由表4可以看出,三种样品的二级结构均以β构象为主,但是未热处理样品(A)占比相对较高。经过75 ℃,5 min条件下热处理后ɑ-螺旋显著降低(P<0.05),可能是因为热处理后IgG的二级结构稳定性降低,其热变性导致ɑ-螺旋中的氢键逐渐断裂,进而发生解旋现象,导致ɑ-螺旋比例降低;无规则卷曲显著增加(P<0.05),表明IgG样品的结构从有序向无序转变;β构象是蛋白聚集体的特征构象,热处理可引起样品热变性并促进分子间的聚集,进而导致热聚集体增加,表现为β-折叠含量增加,热处理后IgG的β-折叠含量增加表明热聚集体增加,但显著(P<0.05)低于未热处理样品,初步推测这可能与添加复合热保护剂的IgG在热处理后形成的内环境有关。添加复合热保护剂后的热处理IgG样品(C)与空白对照组(B)相比,β-折叠含量显著下降(P<0.05),无规则卷曲含量显著下降(P<0.05),表明热聚集体减少[26],二级结构较为有序,β-转角含量显著上升(P<0.05),可能由于热处理过程中行成热聚集体,IgG分子结构部分解折叠诱导无序结构的增加,添加的复合热保护剂与IgG分子发生一定的反应,使分子间的β-折叠结构易转变成β-转角结构,进而导致其含量增加。综上,该复合热保护剂对维持牛初乳IgG结构稳定性的氢键具有一定的保护作用。
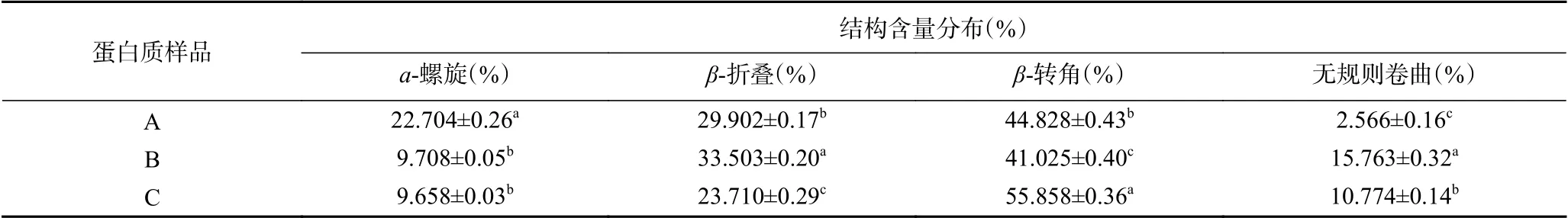
表4 IgG的二级结构含量分布Table 4 Secondary structural contents of IgG samples
2.6 内源性荧光光谱分析
蛋白质分子中的氨基酸残基侧链含有一定量的发色团,如色氨酸、酪氨酸和苯丙氨酸[27],其中色氨酸残基是蛋白质中最主要的内源荧光来源,色氨酸残基侧链(吲哚基团)的内源性荧光信号对其微环境的极性非常敏感,因此可利用内源性荧光作为监测蛋白的三级结构构象和微环境的极性变化十分有效[28]。热处理会使蛋白质的三级结构构象发生改变,而蛋白质三级结构构象变化可通过色氨酸等氨基酸残基的暴露程度来反映[29],图9为不同方式热处理的IgG样品在300~400 nm的内源性荧光图谱。由图9可知,不同处理方式对其荧光光谱的形状影响不明显,即IgG构象变化不明显,而荧光强度有所改变。未添加复合热保护剂热处理后的样品比未热处理样品相比,热处理后IgG的三级结构展开严重,其天然排列方式被破坏,色氨酸残基的暴露程度增大,导致其荧光强度增大。与未添加复合热保护剂的热处理样品相比,在加热条件下添加复合热保护剂的IgG样品的荧光强度明显降低,张和平等[30]发现牛初乳IgG在超高压条件下添加蔗糖时对其具有保护作用,使IgG样品荧光强度降低,本文结果与其一致。该结果表明添加复合热保护剂对IgG的三级结构具有保护作用,可能是因为复合热保护剂添加到IgG中,减少了色氨酸等疏水性氨基酸残基的暴露,降低了表面疏水性,使IgG分子堆积更加紧密,维持其天然状态[31]。

图 9 不同方式处理下IgG内源性荧光光谱图Fig.9 Fluorescence intensity of IgG tryptophan under different protective ways
3 结论
本研究通过单因素及响应面法对牛初乳IgG复合热保护剂进行配方优化,得到一种最优的IgG复合热保护剂:甘氨酸添加量0.48%、菊粉添加量14.98%、麦芽糖醇添加量12.50%,该复合热保护剂对IgG结构具有一定的稳定作用,可以效地减少热处理时牛初乳中IgG的活性损失,热处理(75℃,5 min)后IgG活性保留率可达36.59%,较空白对照组的IgG样品提高了16.25%。结果表明:添加复合热保护剂后热处理的IgG样品与空白对照组相比,β-折叠含量显著下降(P<0.05),无规则卷曲含量显著下降(P<0.05),二级构象呈现较为有序的状态;荧光强度降低,减少了色氨酸等疏水性氨基酸残基的暴露,降低了表面疏水性,使IgG分子堆积更加紧密。该复合热保护剂在牛初乳产品的进一步开发具有较好的实际应用价值,为牛初乳功能性食品的研发提供了一定的参考依据。本文未考察在酸碱条件下牛初乳IgG保护剂的最佳配方,目前国内外学者对牛初乳IgG活性保留率的影响因素有较多研究,但对其活性保持的机理及其结构变化的研究报道鲜少,并缺乏系统性研究,以后应尝试从分子层面研究保护剂对牛初乳IgG的作用机制。
