贯叶连翘-舍曲林联用对抑郁模型大鼠的药效学和药动学相互作用研究
2022-06-10李如月戴国梁杨欣怡陈闪闪刘美琛王一清李斐然居文政
李如月 戴国梁 杨欣怡 陈闪闪 曹 阳 刘美琛 王一清 李斐然 居文政
(南京中医药大学附属医院,江苏南京 210029)
抑郁症是一种心理或情感障碍疾病,主要表现为心情低落、兴趣减低、思维迟缓、认知功能受损,具有高发病率、高致残率和高自杀率的特点。世界卫生组织预测,到2030年抑郁症将成为全球疾病负担第一位的病种[1]。抑郁症病因病机复杂、类型多样、伴发症状多,临床治疗常采用综合疗法,其中中药在改善症状、减轻不良反应、保护神经细胞等方面具有较好的效果[2]。研究显示,中西药联用在治疗抑郁症方面优于单用西药,起效时间快、临床疗效较好且安全性高[3-4]。
贯叶连翘的主要成分为金丝桃素和贯叶金丝桃素,现代药理学研究表明贯叶连翘具有抗抑郁、抗病毒、抗菌、抗炎镇痛等作用[5]。贯叶连翘在欧洲用于治疗抑郁症已有百余年历史且疗效确切[6],其可能通过抑制5-羟色胺(5-HT)、多巴胺(DA)和去甲肾上腺素(NE)的再摄取,产生抗抑郁作用[7-8]。舍曲林是选择性5-HT再摄取抑制剂(SSRI)的代表药物之一,临床用于抑郁症的治疗,疗效确切,但起效较慢。课题组对贯叶连翘与舍曲林联用改善皮质酮诱导大鼠抑郁样行为的效果及机制进行了研究,同时通过药代动力学研究,揭示舍曲林在正常大鼠体内、舍曲林联合贯叶连翘和单独给药在抑郁模型大鼠体内药代动力学的差异,以期能为临床合理用药提供依据,现报道如下。
1 实验材料
1.1 实验动物 健康雄性SD大鼠,体质量(220±10)g,购自南通大学动物实验室,许可证号:SCXK(苏)2019-0001,实验前适应性喂养1周,保持12 h昼夜节律,室温(22±2)℃,自由摄食饮水。本研究经南京中医药大学附属医院实验动物伦理委员会审批通过(批件号:2022DW-08-02)。
1.2 实验仪器 Waters Quattro Micro液质联用仪(美国Waters公司);Masslynx 4.0色谱工作站;CPA225D型 电子天平(德国Sartorius);Legend Micro17R型冷冻离心机(美国Thermo公司);Drict-Q5超纯水机(美国Millipore公司);WH-2微型漩涡混合仪(上海沪西分析仪器厂);Labconco离心浓缩仪(美国Labconco公司);KQ3200型超声波清洗器(昆山市超声仪器有限公司);全波长酶标仪Rayto RT-6100(美国Thermo公司)。
1.3 药物与试剂 贯叶连翘提取物片(德国拜耳制药,规格:900 mg/片,生产批号:6041810);盐酸舍曲林片(辉瑞制药有限公司,规格:50 mg/片,生产批号:DH7541);皮质酮(CORT,梯希爱上海化成工业发展有限公司);舍曲林标准品(批号:100702-201602,规格:50 mg)和替米沙坦标准品(批号:100629-201803,规格:100 mg/支)均购自中国食品药品检定研究院,纯度经HPLC法检测均大于99.0%;大鼠5-HT、NE、DA和脑源性神经营养因子(BDNF)酶联免疫吸附法(ELISA)检测试剂盒均购自上海茁彩生物科技有限公司;甲醇、乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。
2 实验方法
2.1 造模、分组与给药 将雄性SD大鼠按照随机数字表法随机分为空白组与造模组,造模组大鼠采用皮下注射20 mg/kg皮质酮(以0.1%二甲基亚砜和0.1%吐温80生理盐水为溶媒)的方法建立抑郁症模型,空白组皮下注射相同剂量的溶媒,每日1次于上午9∶00—11∶00之间注射,连续21 d。随后所有大鼠进行糖水偏好试验,造模组大鼠糖水消耗率明显低于空白组,说明造模成功。将造模组和空白组大鼠分别随机分为8组,每组6只。其中药效学实验5组,分别为空白组、模型组、舍曲林组(20 mg/kg)、贯叶连翘组(90 mg/kg)、贯叶连翘和舍曲林联用组(给药剂量同单用组);药动学实验3组,分别为空白舍曲林组(20 mg/kg)、模型舍曲林组(20 mg/kg)、模型贯叶连翘和舍曲林联用组(贯叶连翘90 mg/kg、舍曲林20 mg/kg)。
药效学实验各组于造模完成后第2日开始,连续灌胃给予药物或等量溶剂14 d,每日于同一时间灌胃1次。药动学实验,于造模完成后第2日开始模型贯叶连翘和舍曲林联用组连续灌胃给药贯叶连翘提取物14 d,其余2组灌胃等量溶剂,在灌胃开始后第15日3组大鼠灌胃给予舍曲林1次。
2.2 药效学实验
2.2.1 糖水偏好试验 分别于造模完成后与给药结束后对各组大鼠进行糖水偏好试验。试验前让大鼠提前适应2 %蔗糖水1 d,随后禁水18 h,每只大鼠给予1瓶500 mL 2%蔗糖水溶液和1瓶纯净水,测试4 h,其中2 h后2瓶交换位置,测试结束后计算糖水消耗率。糖水消耗率(%)=糖水摄入量/(糖水摄入量+纯净水摄入量)×100%,其中糖水或纯净水摄入量均按克(g)计。
2.2.2 体质量检测 分别于造模完成后与给药结束后按照动物编号对各组大鼠进行称重,记录体质量。
2.2.3 强迫游泳试验 给药结束后对各组大鼠进行强迫游泳试验。试验前进行游泳适应,将大鼠置于(24±2)℃水桶中,保持大鼠悬浮,四肢不能接触桶底,试验过程中保持安静。次日在相同条件下强迫游泳5 min,记录后4 min的大鼠不动时间,即大鼠仅有头部露出水面,呈漂浮状态,四肢可有微动状态的时间。
2.2.4 动物取材及样本处理 行为学实验结束后,各组大鼠采用10%水合氯醛麻醉,腹主动脉取血,1530×g离心10 min后取血清,-80 ℃冰箱保存待测。随后大鼠颈椎脱臼法处死,冰上快速分离海马组织,液氮速冻后存储于-80 ℃冰箱备用。
2.2.5 ELISA检测大鼠海马及血清中5-HT、DA、NE及BDNF水平 取大鼠海马组织和血清,按试剂盒说明书中的方法检测各组大鼠海马组织和血清中5-HT、DA、NE和BDNF水平。
2.3 药动学实验
2.3.1 色谱条件 Agilent ZORBAX SB-C18色谱柱,流动相:乙腈/0.1%甲酸(41∶59);流速为0.2 mL/min;柱温为30 ℃;进样量5 μL。
2.3.2 质谱条件 电喷雾(ESI)离子源,喷雾电压为3500 V,温度320 ℃。阳离子方式扫描,扫描方式为多反应监测(MRM)。m/z:305.9 →158.6(舍曲林);m/z:515.1→276.0(替米沙坦)。
2.3.3 动物取材及样本处理 各组大鼠于舍曲林给药 后0、0.25、0.35、1.25、3、4、5、6、8、9、10、11、12、16、24 h眼眶取血约0.25 mL,肝素钠抗凝,1530×g离心10 min,取上层血浆保存于-80 ℃冰箱备测。
2.3.4 血浆样品处理 血浆样品于室温下解冻,精密吸取100 μL至1.5 mL离心管,加入浓度为500 ng/mL内标替米沙坦10 μL,涡旋10 s,加入800 μL乙酸乙酯,振荡3 min,13 800×g离心10 min,取750 μL上清液至另一个离心管,置于离心浓缩仪挥干后用100 μL流动相溶解,取10 μL于具内衬管的进样瓶中运用液相色谱-串联质谱(LC-MS/MS)法测定血浆中舍曲林含量。
2.3.5 药动学参数计算 根据LC-MS/MS所得数据,采用DAS 2.0软件计算药动学参数:半衰期(t1/2)、达峰时间(Tmax)、血药峰浓度(Cmax)、药时曲线下面积[AUC(0-t)和AUC(0-∞)]。
2.4 统计学方法 使用SPSS 19.0软件通过单因素方差分析(One-Way ANOVA)对各组数据进行比较,计量数据用()表示,P<0.05表示差异有统计学意义。药动学参数采用DAS 2.0软件计算,结果用()表示,P<0.05表示差异有统计学意义。
3 实验结果
3.1 药效学实验
3.1.1 各组大鼠行为学指标比较 除空白组外,其余各组大鼠造模完成后糖水消耗率、体质量比较,差异均无统计学意义(P>0.05),说明基线平衡。干预结束后,模型组大鼠糖水消耗率、体质量显著低于空白组(P<0.01,P<0.05),游泳不动时间显著高于空白组(P<0.05);与模型组比较,各给药组上述行为学指标均有显著改善(P<0.05,P<0.01)。详见表1。
表1 各组大鼠干预结束后行为学指标比较()
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.1.2 各组大鼠海马组织和血清5-HT、NE、DA和BDNF水平比较 与空白组比较,模型组大鼠海马和血清5-HT、DA、NE和BDNF水平显著降低(P<0.01)。贯叶连翘组大鼠海马组织5-HT、DA、BDNF水平和血清NE水平,舍曲林组海马组织DA水平,贯叶连翘和舍曲林联用组海马组织5-HT、DA、NE、BDNF水平和血清5-HT、NE水平均显著高于模型组(P<0.05);贯叶连翘和舍曲林联用组海马组织5-HT水平显著高于贯叶连翘组、舍曲林组(P<0.05,P<0.01),海马组织NE、BDNF和血清5-HT、NE水平显著高于舍曲林组(P<0.05,P<0.01)。详见表2。
表2 各组大鼠海马组织和血清5-HT、DA、NE和BDNF水平比较()

表2 各组大鼠海马组织和血清5-HT、DA、NE和BDNF水平比较()
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与贯叶连翘组比较,△P<0.05,△△P<0.01;与舍曲林组比较,☆P<0.05,☆☆P<0.01。
3.2 药动学实验 3组大鼠灌胃给予舍曲林后药动学参数结果见表3,血药浓度-时间曲线见图1。与空白舍曲林组比较,模型舍曲林组大鼠血浆中舍曲林Cmax、AUC(0-t)和AUC(0-∞)显著增加(P<0.01,P<0.05);与模型舍曲林组比较,模型贯叶连翘和舍曲林联用组舍曲林Tmax显著降低(P<0.05),Cmax、AUC(0-t)和AUC(0-∞)显著增加(P<0.01)。另外,由分析结果可知,舍曲林在大鼠体内的药动学符合一室开放模型。
表3 各组大鼠血浆舍曲林药动学参数比较()

表3 各组大鼠血浆舍曲林药动学参数比较()
注:与空白舍曲林组比较,▲P<0.05,▲▲P<0.01;与模型舍曲林组比较,★P<0.05,★★P<0.01。
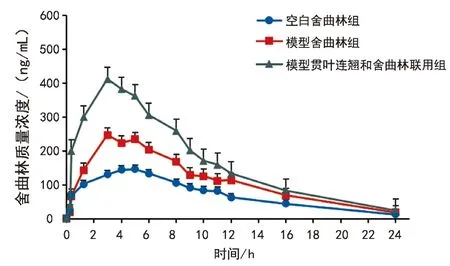
图1 各组大鼠体内舍曲林平均血药浓度-时间曲线(n=6)
4 讨论
对啮齿类动物重复注射皮质酮已经被公认是一个可靠的制作慢性应激性抑郁障碍动物模型的方法[9]。皮质酮重复皮下注射给药可以诱导小鼠抑郁样行为,下调海马区5-HT水平[10],还可以降低海马组织内的BDNF表达[11]。本实验结果亦证明皮质酮皮下注射制作抑郁症大鼠模型成功。
5-HT受体是单胺类神经递质受体的一部分,单胺类神经递质受体的降低是抑郁症发病的重要原因[1]。研究表明,5-HT、NE和DA等神经递质对情绪、心理压力的反应性、自我控制、动机、驱动力和认知表现产生重大影响[12]。研究发现,5-HT、NE和DA在抑郁症患者血清中的表达明显低于正常人,且含量越低临床症状越严重[13]。随着对抑郁症发病机制更为深入的研究,脑内海马区BDNF的表达异常也逐渐受到重视[14]。BDNF是哺乳动物脑内分布最广、含量最高的神经营养因子,主要集中在中枢神经系统,尤其是大脑皮质和海马区域[15]。本研究结果表明,与模型组比较,在大鼠海马组织中,舍曲林组只有DA水平显著回调,贯叶连翘组5-HT、DA和BDNF水平有显著回调,贯叶连翘和舍曲林联用组5-HT、DA、NE和BDNF水平都有显著回调;在血清中,舍曲林组大鼠上述4个指标均无显著变化,贯叶连翘组只有NE水平显著回调,贯叶连翘和舍曲林联用组5-HT和NE水平有显著回调。舍曲林组5-HT水平虽然较模型组比较差异无统计学意义,但是也有回调趋势,可能与舍曲林起效时间长有关。各给药组之间比较,贯叶连翘和舍曲林联用组大鼠海马组织5-HT水平显著高于2个单独给药组,血清5-HT水平显著高于舍曲林组,可能由于两种药物作用机制相似,都能抑制5-HT的再摄取,从而在联合治疗时5-HT水平改善更为显著。综合以上结果,虽然部分指标组间比较无统计学差异,但是整体看来4项指标经药物干预均有回调趋势,其中贯叶连翘和舍曲林联用组改善最为明显。
药动学结果显示,模型舍曲林组的Cmax、AUC(0-t)和AUC(0-∞)分别是空白舍曲林组的1.48、1.50、1.50倍,模型贯叶连翘和舍曲林联用组的Cmax,AUC(0-t)和AUC(0-∞)分别是模型舍曲林组的1.62、1.53、1.53倍,Tmax仅为其的0.67倍,说明联合使用了贯叶连翘后,缩短了舍曲林的起效时间,提高了吸收率,生物利用度更高。舍曲林在体外与P糖蛋白(P-gp)具有很高的亲和力[16],而P-gp表达的缺失可能导致抑郁症[17],因此抑郁状态下P-gp下调可能导致舍曲林在血浆中暴露量增加。另据文献报道,贯叶连翘提取物的一种有效成分贯叶金丝桃素能够抑制P-gp的外排[18],这也可能导致舍曲林在血浆中的暴露量增加。有文献报道,贯叶连翘虽可以诱导CYP2C19活性[19],但是抑郁状态下的大鼠单胺类神经递质紊乱、炎症因子增加等病理状态,也可能导致体内的一些代谢酶活性的变化[20],从而导致体内血药浓度的变化。因此,我们推测,在大鼠抑郁状态下,与单用舍曲林相比贯叶连翘与舍曲林联合应用后舍曲林在血浆中暴露量发生了显著性变化,可能是一种或者多种因素共同作用的结果,其具体作用机制可应用Cocktail探针和Western Blot方法分别证实,这是我们下一步的研究方向。值得注意的是,抑郁症状态下也可能导致血药浓度发生变化,提示临床上对抑郁症患者的用药剂量要及时调整。
抑郁症发病机制复杂、影响因素较多,西药多数只针对单一机制治疗,存在着治疗效果差、起效时间长、不能涵盖所有抑郁类型等不足。中西药联合应用具有多机制、多靶点共同作用的优势,已成为临床治疗抑郁症的有效手段。不同的药物联合应用,其抗抑郁作用可能增加,但是由于药物相互作用,也可能降低疗效甚至产生毒副作用。本研究结果表明,贯叶连翘和舍曲林联合应用对改善皮质酮诱导的大鼠抑郁样行为有较好的作用,且起效时间短,对症状和血清学指标的改善效果优于单用舍曲林或贯叶连翘,结合药动学实验结果,推测其可能的原因是由于二者联合用药后舍曲林在血浆中暴露量增加,也可能由于二者联合用药协同增效。本实验的给药剂量为临床等效剂量,实际临床中如何控制好量效关系,使之最优化也至关重要,这也是我们下一步的研究方向。
