10周有氧运动和有氧结合抗阻运动对肥胖大学生微循环功能的影响及机制研究
2022-06-10肖哲朱欢胡江平杨梅彭永周慧敏
肖哲,朱欢*,胡江平,杨梅,彭永,周慧敏
微循环功能障碍可致糖脂代谢紊乱、胰岛素抵抗增强、外周血管阻力增加,进而导致肥胖的发生,且易诱发动脉粥样硬化、2型糖尿病、高血压、非酒精性脂肪肝等慢性代谢性疾病[1-3]。随着肥胖程度的加剧,微循环障碍将进一步加重。研究表明,肥胖患者体内微血管稀疏和内皮细胞舒张能力明显下降[4],且微血管功能障碍程度与肥胖程度呈正相关[5]。因此,改善肥胖大学生微循环功能有着重要的意义。研究表明,有氧运动[6-7]、抗阻运动[8]等不同运动方式均具有较好的减脂与减重效果,并能改善肥胖人群微血管内皮细胞功能,但多数研究对于运动强度的制定采用统一的标准,缺乏个体差异性,导致精度不够。最大脂肪氧化强度(FATmax)是指单位时间内脂肪氧化利用最大化时所对应的运动强度,该运动强度能有效促进脂肪分解,达到较好的减脂效果,同时FATmax是基于个体化的脂肪氧化速率而定,为运动强度的精准化、个体化制定提供了依据[9]。目前,基于FATmax设计的运动方案已在肥胖人群中广泛应用,但FATmax强度运动能否改善肥胖人群微循环功能尚不明确。此外,对于FATmax强度运动影响肥胖人群微循环功能的生物学机制也有待于明确。微血管反应性指不同刺激下(如血流阻断、局部组织加热)微血管血流灌注的变化能力,该指标在临床已被广泛应用于微循环功能的评价[10-11]。经皮氧分压(TcPO2)是毛细血管通过皮肤弥散出来的氧气含量,可用于皮肤血流灌注量和微循环功能的评价[10]。肌氧饱和度(SmO2)是反映肌肉需氧-供氧平衡及肌肉代谢的重要指标,与TcPO2有着密切关系[11]。基于此,本研究以FATmax为运动强度标准制定有氧运动和有氧结合抗阻运动方案,探讨10周有氧运动和有氧结合抗阻运动对肥胖大学生微血管反应性、TcPO2、SmO2的影响,并探讨运动改善微循环功能的可能机制,为改善肥胖大学生微循环功能提供运动处方选择依据。
1 对象与方法
1.1 研究对象 2021年3月,以湖北民族大学在校大学生为招募对象,经过广告招募、初步体检及心电图检查等,共计66例符合标准的肥胖大学生入选。纳入标准:(1)男性体脂率>20%、女性体脂率>30%或者体质指数(BMI)>24.0 kg/m2;(2)习惯久坐,除每天必要的体力活动,近6个月(2020年10月至2021年3月)未进行任何系统性的体育锻炼;(3)无严重的心血管疾病及并发症;(4)无手术史,尤其是下肢手术史;(5)心理健康,无抑郁症、自卑等心理问题;(6)2021年4—6月,每周至少有4次空闲时间,每次不低于1.5 h。排除标准:(1)具有高血压、皮肤病、肺功能障碍等;(2)身体不能承受一定的运动负荷。在性别比例一致的情况下,随机将66例受试者分成对照组、有氧运动组及有氧结合抗阻运动组(简称联合运动组),每组22例。所有的受试者在参加试验前认真阅读本试验的“受试者知情同意书”,并签署书面同意意见。本研究获得湖北民族大学生物医学伦理委员会的审批(审批号为2021034)。
1.2 运动干预方案 对照组受试者试验期间不进行系统性的体力活动或体育锻炼,有氧运动组进行为期10周的有氧运动(跑步),联合运动组进行为期10周的有氧运动结合抗阻运动。试验过程中,为了提供准确的FATmax,有氧运动组和联合运动组均在第5周运动干预结束后重新测试受试者的FATmax(试验前和第5周运动组肥胖大学生FATmax见表1),测试方案、计算方法同试验前。另外,课题组成立专门的饮食控制与干预小组,根据学校食堂的食品种类为受试者制定相似比例的饮食计划(饮食的种类、重量等根据受试者体质量基数进行个体化制定,并对食物重量进行称重),并由小组成员监督完成,确保三组受试者试验期间饮食基本一致。
表1 试验前及第5周运动组肥胖大学生FATmax(±s)Table 1 Fatmax intensity in obese college students in exercise group and combined aerobic and resistance exercise group before and 5 weeks after the intervention
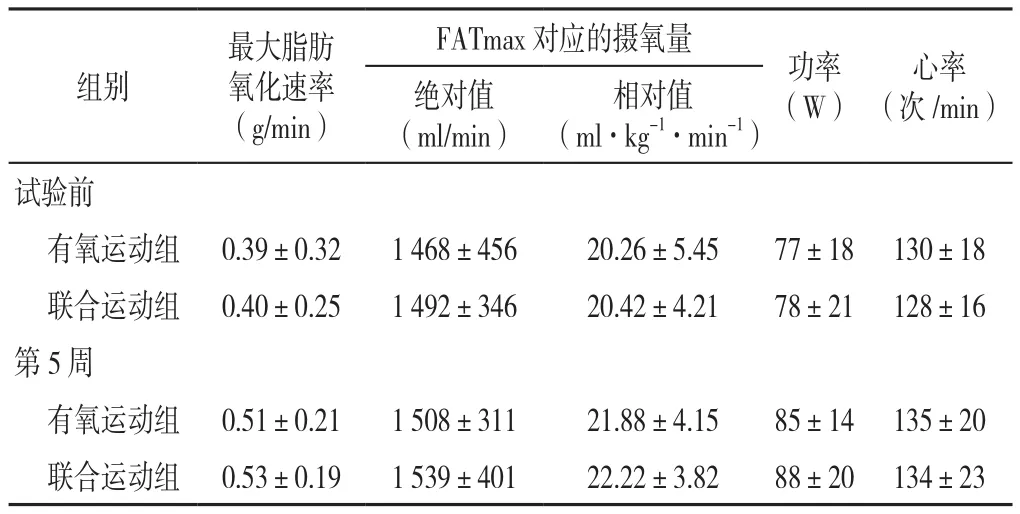
表1 试验前及第5周运动组肥胖大学生FATmax(±s)Table 1 Fatmax intensity in obese college students in exercise group and combined aerobic and resistance exercise group before and 5 weeks after the intervention
注:FATmax=最大脂肪氧化强度;联合运动组采用的干预方案为有氧结合抗阻运动
相对值(ml·kg-1·min-1)试验前有氧运动组 0.39±0.32 1 468±456 20.26±5.45 77±18 130±18联合运动组 0.40±0.25 1 492±346 20.42±4.21 78±21 128±16第5周有氧运动组 0.51±0.21 1 508±311 21.88±4.15 85±14 135±20联合运动组 0.53±0.19 1 539±401 22.22±3.82 88±20 134±23绝对值(ml/min)组别最大脂肪氧化速率(g/min)FATmax对应的摄氧量 功率(W)心率(次/min)
1.2.1 有氧运动组 有氧运动组受试者2021-03-19至2021-06-01每周周一、周三、周五和周日17:00~18:30或 19:00~20:30(可根据自己的空闲时间选择其中1个时间段)进行有氧运动(跑步),4次/周,60 min/次,共持续10周。运动强度为个体化FATmax。FATmax测试由PFT Ergo运动心肺功能仪(意大利 COSME公司,PFTErgo)及配套的功率自行车完成,具体的测试方法、流程及计算方法同本团队前期发表的论文[12-13]。
1.2.2 联合运动组 联合运动组2021-03-19至2021-06-01每周周一、周三、周五和周日17:00~18:30或19:00~20:30(可根据自己的空闲时间选择其中1个时间段)进行有氧运动(跑步)结合抗阻运动,其中有氧运动40 min,抗阻运动20 min,有氧和抗阻运动的运动强度均维持在FATmax,测试方法同有氧运动组。运动过程中,两种运动方式穿插进行,即10 min有氧运动+5 min抗阻运动为1个运动小周期,每次运动4个小周期,小周期内的抗阻运动依次为负重深蹲、波比跳、壶铃摆、俯卧撑,每种运动持续30~45 s,然后休息30~45 s进行下一种动作。运动全程使用团队心率表(芬兰polar公司,polarTeam2)远程对受试者运动强度进行监控,并及时对抗阻运动的强度进行调整。如果受试者动作频率过快导致运动强度高于FATmax,提示受试者应放慢频率,使心率维持在FATmax左右;反之则增大运动频率,保证抗阻运动的强度不超过目标心率10次/min[9,14]。
1.3 测试指标及测试仪器 在试验开始的前1天及干预结束后的第2天(晨起空腹状态下)分别测量三组受试者的体质量、体脂率、微循环功能、血液指标。(1)使用体脂测试仪(北京鑫东华腾体育器械有限公司,健民/GMCS-TZL3)测量受试者体质量、BMI及体脂率。(2)采用微血管反应性、TcPO2、SmO23个指标综合评价微循环功能,其中微血管反应性、TcPO2测试仪器为双通道激光多普勒血流检测仪(瑞典帕瑞医学,PF6010),SmO2测试仪器为近红外光无线肌氧测试系统(美国Moxy公司,Moxy),测试部位均为右前臂肘窝与桡骨远侧突起连线中点的皮肤。另外,微血管反应性以加热(44℃)刺激后微血管血流灌注量(MBP)来表示。(3)一氧化氮(NO)、内源性一氧化氮合酶(eNOS)、内皮素-1(ET-1)、内皮细胞生长因子(VEGF)、胰岛素抵抗指数(HOMA-IR)由南京建成生物工程研究所测试完成(血清样本)。
1.4 统计学方法 采用SPSS 25.0软件对数据进行统计分析。计数资料以频数表示。采用S-W检测方法对数据的正态分布情况进行检验,结果显示均符合正态分布,以(±s)表示,三组基线资料比较采用单因素方差分析;运用析因分析和简单效应分析对三组受试者试验前后的各项指标进行统计学分析,探讨组别与时间的交互作用及单独效应。以P<0.05为差异有统计学意义。
2 结果
2.1 三组肥胖在校大学生基线资料比较 试验前,三组肥胖在校大学生年龄、身高、体质量、体脂率、BMI比较,差异无统计学意义(P>0.05),见表2。

表2 三组肥胖在校大学生基线资料比较Table 2 Baseline data of three groups of obese college students
2.2 试验前后三组肥胖在校大学生体质量、BMI、体脂率比较 三组体质量、BMI和体脂率治疗与时间的交互作用具有统计学意义(P<0.05)。简单效应分析结果显示,组别对体质量、BMI、体脂率有单独效应,其中试验后有氧运动组和联合运动组体质量、BMI、体脂率均低于对照组,差异有统计学意义(P<0.05);时间对体质量、BMI和体脂率具有单独效应,其中试验后有氧运动组、联合运动组体质量、BMI、体脂率均低于试验前,差异有统计学意义(P<0.05),见表3。
表3 试验前后三组肥胖在校大学生体质量、BMI、体脂率比较(±s)Table 3 Comparison of body weight,BMI and body fat percentage among three groups of obese college students before and after the intervention

表3 试验前后三组肥胖在校大学生体质量、BMI、体脂率比较(±s)Table 3 Comparison of body weight,BMI and body fat percentage among three groups of obese college students before and after the intervention
注:a表示与组内试验前比较,P<0.05;b表示与同时间点对照组比较,P<0.05
组别 例数 体质量(kg) BMI(kg/m2) 体脂率(%)试验前 试验后 试验前 试验后 试验前 试验后对照组 22 73.67±8.92 74.41±8.40 27.70±2.04 28.01±1.72 33.08±3.72 33.73±4.72有氧运动组 22 72.47±7.73 68.52±7.53ab 26.94±2.14 25.52±2.03ab 32.47±4.30 29.91±3.60ab联合运动组 22 73.03±9.13 67.92±11.76ab 27.32±2.29 25.44±2.30ab 32.98±4.70 29.63±3.92ab F 值 F组间=5.764,F交互=4.763,F时间=5.104 F组间=4.280,F交互=4.320,F时间=5.940 F组间=4.771,F交互=5.764,F时间=4.075 P 值 P组间=0.013,P交互=0.030,P时间=0.026 P组间=0.042,P交互=0.041,P时间=0.017 P组间=0.031,P交互=0.013,P时间=0.046
2.3 试验前后三组肥胖在校大学生微循环功能指标的变化 三组肥胖大学生MBP加热值、TcPO2和SmO2治疗与时间的交互作用具有统计学意义(P<0.05)。简单效应分析结果显示,组别对MBP加热值和TcPO2具有单独效应,其中有氧运动组和联合运动组MBP加热值和TcPO2均高于对照组,联合运动组MBP加热值高于有氧运动组,差异均有统计学意义(P<0.05);时间对MBP加热值、TcPO2和SmO2具有单独效应,其中试验后有氧运动组和联合运动组MBP加热值、TcPO2和SmO2均高于试验前,差异有统计学意义(P<0.05),见表4。
表4 试验前后三组肥胖大学生微循环功能指标比较(±s)Table 4 Comparison of microcirculation indicators of three groups of obese college students before and after the intervention

表4 试验前后三组肥胖大学生微循环功能指标比较(±s)Table 4 Comparison of microcirculation indicators of three groups of obese college students before and after the intervention
注:a表示与组内试验前比较,P<0.05;b表示与同时间点对照组比较,P<0.05;c表示与同时间点有氧运动组比较,P<0.05;1 mm Hg=0.133 kPa;MBP=微血管血流灌注量,TcPO2=经皮氧分压,SmO2=肌氧饱和度
组别 例数 MBP基础值(PU) MBP加热值(PU) TcPO2(mm Hg) SmO2(%)试验前 试验后 试验前 试验后 试验前 试验后 试验前 试验后对照组 22 8.45±4.01 8.43±2.36 90.15±19.60 86.95±18.12 59.87±7.34 58.81±7.26 61.60±5.67 60.09±6.25有氧运动组 22 7.78±2.00 7.93±2.56 89.94±20.11 105.25±19.38ab 59.02±6.98 65.92±7.28ab 61.56±6.99 64.93±5.41a联合运动组 22 7.83±2.58 8.32±2.46 89.10±20.32 123.32±26.11abc 59.13±7.13 67.49±7.50ab 59.82±6.23 65.11±4.95a F值 F组间=0.444,F交互=0.081,F时间=0.155 P组间=0.207,P交互=0.044,P时间=0.036 F组间=1.598,F交互=3.229,F时间=4.496 P值 P组间=0.642,P交互=0.922,P时间=0.694 F组间=6.888,F交互=7.704,F时间=16.931 F组间=3.117,F交互=4.598,F时间=11.935 P组间=0.002,P交互=0.001,P时间<0.001 P组间=0.048,P交互=0.012,P时间=0.001
2.4 试验前后三组肥胖在校大学生NO、eNOS、ET-1、VEGF和HOMA-IR的变化 三组肥胖在校大学生NO、eNOS、VEGF、HOMA-IR治疗与时间的交互作用具有统计学意义(P<0.05)。简单效应分析结果显示,组别对NO和HOMA-IR具有单独效应,其中有氧运动组和联合运动组NO均高于对照组,有氧运动组和联合运动组HOMA-IR低于对照组,差异有统计学意义(P<0.05);时间对NO、eNOS、ET-1、VEGF及HOMA-IR具有单独效应,其中试验后有氧运动组和联合运动组NO、eNOS和VEGF均高于试验前(P<0.05),ET-1和HOMA-IR均低于试验前,且联合运动组HOMA-IR低于有氧运动组,差异有统计学意义(P<0.05),见表5。
表5 试验前后三组肥胖大学生NO、eNOS、ET-1、VEGF、HOMA-IR比较(±s)Table 5 Comparison of NO,eNOS,ET-1 and HOMA-IR in three groups of obese college students before and after the intervention

表5 试验前后三组肥胖大学生NO、eNOS、ET-1、VEGF、HOMA-IR比较(±s)Table 5 Comparison of NO,eNOS,ET-1 and HOMA-IR in three groups of obese college students before and after the intervention
注:a表示组内试验前后比较,P<0.05;b表示与对照组比较,P<0.05;c表示与有氧运动组比较,P<0.05;NO=一氧化氮,eNOS=内源性一氧化氮合酶,ET-1=内皮素-1,VEGF=内皮细胞生长因子,HOMA-IR=胰岛素抵抗指数
组别 例数 NO(μmol/L) eNOS(U/mL) ET-1(ng/L) VEGF(ng/L) HOMA-IR试验前 试验后 试验前 试验后 试验前 试验后 试验前 试验后 试验前 试验后对照组 22 39.49±4.88 37.91±5.10 7.98±0.84 7.73±0.90 49.80±6.84 50.91±7.09 160.65±14.58 157.41±15.34 2.76±0.25 2.80±0.47有氧运动组 22 39.85±4.18 44.78±4.38ab 7.54±1.14 8.45±1.40a 51.38±6.34 46.84±5.92a 159.01±14.15 177.37±16.45a 2.68±0.41 2.45±0.34ab联合运动组 22 39.03±5.89 45.20±6.14ab 7.59±0.89 9.08±1.01a 51.16±7.07 44.68±6.53a 160.95±15.09 173.99±16.40a 2.73±0.21 2.27±0.26abc F值 F组间=3.743,F交互=3.929,F时间=6.833 P组间=0.016,P交互=0.047,P时间=0.008 F组间=4.430,F交互=3.196,F时间=7.420 P值 P组间=0.029,P交互=0.024,P时间=0.011 F组间=1.308,F交互=4.255,F时间=8.353 F组间=0.805,F交互=2.113,F时间=4.451 F组间=2.640,F交互=3.222,F时间=6.723 P组间=0.227,P交互=0.018,P时间=0.005 P组间=0.451,P交互=0.129,P时间=0.039 P组间=0.079,P交互=0.046,P时间=0.012
3 讨论
3.1 不同运动形式对肥胖大学生微循环功能的影响微循环障碍是肥胖人群典型的病理生理特征,表现为外周血管阻力增加、血管内皮依赖性舒张功能下降、毛细血管募集能力降低等,并随着肥胖程度的增加而加剧[15-16]。肥胖患者体内存在氧化应激反应,导致过度产生活性氧,加速NO的降解及生物效应降低,促进炎性反应、内皮功能障碍、血管非正常性重建及胰岛素抵抗的发生[17]。肥胖还可导致毛细血管管径增大、血流速度降低,且血流流态由线状转变为线粒状或粒状,造成血流灌注障碍[18]。微循环障碍是导致心血管疾病、缺血性心脏病等疾病发生的重要原因,且微循环功能障碍先于大血管功能障碍发生,因此微循环功能障碍是血管性疾病的早期不良事件[19-20]。大血管内皮功能障碍促进动脉粥样硬化发生,而肥胖诱导的微血管内皮功能障碍引起器官血流灌注障碍,导致慢性肾病、间歇性跛行、运动不耐受等发生,并加速认知功能的下降。此外,在运动过程中肥胖患者微血管舒张功能也明显下降,使骨骼肌等器官血流灌注不足,导致机体低氧发生,出现运动过程中供氧障碍,诱发疲劳产生,降低运动能力[21-22]。综上,微循环功能障碍不仅是肥胖人群典型的病理生理特征,而且可进一步导致各种慢性病的发生,并降低肥胖人群的运动耐受性,因此改善肥胖人群微循环功能对减少慢性病的发生及提高运动耐受能力有着重要的作用。
运动干预是提高肥胖人群微循环功能的有效方式,同时运动还能增强机体代谢水平,达到减脂、减重的效果。研究表明,8周强度为70% VO2max的健步走可以明显提高肥胖女性微血管血流量,并有提高SmO2的趋势[6];8周有氧运动能明显增加超重患者动脉闭塞后反应性充血后的血流曲线面积,且与血浆脂联素水平呈正相关[7];笔者团队前期研究也表明,12周有氧运动能明显提高习惯性久坐大学生微血管反应性[23]。抗阻运动可以提高肥胖人群微循环功能。研究表明,12周抗阻运动可改善肥胖青少年的体脂、腰围、腰臀比、HOMA-IR,提高其皮肤内皮依赖性血管舒张功能和反应性充血指数[24];有氧联合抗阻运动可以改善肥胖人群血管内皮细胞功能,且效果较单一的运动方式更佳[25]。虽然相关研究表明,有氧运动及有氧联合抗阻运动均能改善肥胖人群微血管功能,但基于FATmax进行运动处方设计的研究较少,基于FATmax进行抗阻运动方案设计的研究更少。本研究结果显示,10周基于FATmax的有氧运动和有氧结合抗阻运动均能降低肥胖大学生的体质量、体脂率、BMI,提高微血管反应性、TcPO2与SmO2水平,且联合运动组微血管反应性高于有氧运动组,提示联合干预对微血管反应性的干预效应更佳,这与周术锋等[23]、唐东辉等[25]、赵军等[26]的研究结论相似(但这些研究均不是基于FATmax设计的运动方案)。本研究基于FATmax强度理论,对肥胖大学生制定了个体化的FATmax强度,保证了运动强度的精准性和个体化,但未来需要更多的研究证据支撑FATmax强度运动对肥胖人群微血管功能的有益干预效应。
微循环功能的改善对肥胖大学生有非常重要的意义,其不仅能减少高血压、糖尿病等慢性病的发生,且能提高学生的运动耐受能力。心肺耐力作为评价大学生体质健康情况的最基本的身体指标,是决定整体健康水平的基础条件。研究发现,心肺耐力较低的人群心血管疾病发生风险、手术风险、2型糖尿病发生风险、抑郁发生风险较心肺耐力水平高的人群高,通过锻炼提高心肺耐力水平后人群的全因死亡率和心血管疾病死亡风险可降低一半[27]。笔者团队前期研究表明,微血管反应性、TcPO2的改善是有氧运动提高最大摄氧量(VO2max)相对值的重要外周生理学机制之一[28]。另外,SmO2与有氧耐力之间也有着密切的关系。SmO2是反映肌肉需氧-供氧平衡及肌肉代谢的重要指标。TcPO2越高,毛细血管与肌细胞间的压力差越大,氧气进入细胞的速率加快、弥散的距离加大,SmO2就越大。研究表明,SmO2可以用来评定肌肉耐力及全身耐力水平,反映机体有氧代谢能力[29-30]。而且SmO2与运动性疲劳的发生有着密切的关系,提高SmO2有助于延缓疲劳的发生,提高运动耐受性[31-32]。因此,提高肥胖大学生微血管反应性、TcPO2、SmO2不仅有助于增进整体健康水平,降低慢性病的发生风险,且能提高运动耐受性和运动能力,为日常体力活动和体育锻炼奠定身体基础。
3.2 运动干预改善肥胖大学生微循环功能的可能机制
NO是血管舒张因子,由eNOS催化精氨酸产生。NO除具有扩张血管作用外,还能阻止动脉粥样硬化的发生,如其可通过血小板黏附和聚集、白细胞黏附和迁移、肌肉细胞增殖等方式保护血管。肥胖人群微血管内皮功能障碍的发生与NO产生减少有关。由于肥胖人群体内氧化应激增强,导致NO降解及生物效应降低,使血管舒张功能下降[33-34];肥胖患者体内脂肪组织分泌瘦素、抵抗素和脂联素等脂肪因子,导致血管稳态紊乱,刺激肿瘤坏死因子α和白介素-6的分泌,诱导内皮细胞产生更多的活性氧来促进内皮功能障碍[35];肥胖人群微血管中精氨酸酶1和精氨酸酶2的表达增强,而精氨酸酶1和精氨酸酶2能加速精氨酸水解,导致肥胖患者体内NO减少[3]。此外,肥胖患者的胰岛素抵抗导致NO的血管舒张效应减弱及ET-1的血管收缩效应增强。胰岛素能刺激血管产生NO,增加骨骼肌血流灌注量(25%~40%是由内源性NO介导的血流量增加),提高骨骼肌摄取葡萄糖的能力[36]。正常生理条件下,内皮细胞中的胰岛素可以激活磷脂酰肌醇3-激酶(Pi3-激酶),使eNOS激活,促使NO生成和血管舒张,但胰岛素也可以激活细胞外调节蛋白激酶(ERK1/2)通路,导致ET-1生成增加并引起血管收缩。而胰岛素抵抗状态可导致多个器官微血管密度明显降低。胰岛素能特异性通过胰岛素受体和激活PI3K/Akt通路调控VEGF基因表达,而胰岛素抵抗能选择性抑制该通路使VEGF表达能力下降和毛细血管密度降低[37]。因此,改善肥胖患者胰岛素抵抗及NO、ET-1、VEGF等血管内皮细胞因子水平有助于提高肥胖人群微循环功能。
本研究结果显示,10周有氧运动、有氧结合抗阻运动干预后,肥胖大学生NO、ET-1水平均得到改善,表明两种运动方式均能改善内皮细胞因子的分泌,提高微循环血管功能,这与DONGHUI等[38]、BOA等[39]研究结果一致。DONGHUI等[38]研究指出,运动与饮食控制相结合可有效改善肥胖青少年的糖脂代谢,提高血清NO/ET-1水平,提高微血管内皮功能。BOA等[39]的动物实验表明,运动和/或膳食调整可减少高脂肪喂养动物的内脏脂肪,增加eNOS表达,减少微循环功能障碍。笔者团队的前期研究也表明,每周>3次的有氧运动能改善NO/ET-1水平,提高习惯性久坐大学生的微循环功能[23]。唐东辉等[25]研究表明,有氧运动结合抗阻运动可降低肥胖青少年血清ET-1的表达,增加NO水平,改善微血管内皮细胞障碍。本研究结果显示,干预后有氧运动组和联合运动组VEGF水平均明显升高,表明有氧运动和有氧结合抗阻运动均能促进毛细血管的增生,提高肥胖人群的微血管密度,改善微血管稀疏的发生。
运动干预对NO、ET-1、VEGF内皮细胞因子的影响可能与血管剪切应力和胰岛素抵抗的变化有关。运动过程中,血管中血流速度加快,血流量增加,血流对血管壁的流体剪切应力增大。在剪切应力的作用下,内皮细胞通过信号传导调节NO、ET-1等因子的释放,发挥舒血管效应。如前所述,胰岛素能调节NO、ET-1、VEGF等内皮细胞因子表达,发挥舒张血管效应,而运动能改善胰岛素抵抗,提高胰岛素的敏感性和生物学作用,调节NO、ET-1、VEGF等因子的分泌。本研究结果显示,干预后有氧运动组和联合运动组HOMA-IR均下降,且联合运动组HOMA-IR低于有氧运动组,表明基于FATmax的有氧结合抗阻运动对胰岛素敏感性的干预效应优于单纯的有氧运动,这与罗曦娟等[40]、魏建翔等[41]的研究结果一致。但本研究结果显示,有氧运动组和联合运动组试验后NO、ET-1、VEGF水平比较,差异无统计学意义。笔者认为这与两个运动组试验后HOMA-IR与NO、ET-1、VEGF变化的不一致性与运动过程中的血流剪切应力的变化有关。有氧运动过程中,血管中的血流量呈规律性的增加;抗阻运动中血流的变化属于间断性,肌肉快速收缩过程中血流量下降,舒张时血流回升。因此抗阻运动中血流对血管壁的流体剪切应力小于有氧运动,所以该过程中有氧运动组NO、ET-1、VEGF的改善幅度大于有氧抗阻运动组。综上,联合运动组胰岛素对NO、ET-1、VEGF的调节效应大于有氧运动组,有氧运动组剪切应力对NO、ET-1、VEGF的调节效应大于联合运动组,最后导致两个运动组试验后NO、ET-1、VEGF水平无差异,但该结论有待于进一步研究证实。但本研究结果显示,联合运动组试验后微血管舒张反应能力高于有氧运动组,说明除NO、ET-1、VEGF等内皮细胞因子外,还存在其他影响微血管舒张反应的生物学机制或内皮细胞舒缩因子,如氧化应激反应、血管紧张素系统、中枢神经系统功能等,这些都有待于进一步的研究明确。
综上,10周基于FATmax的有氧运动和有氧结合抗阻运动均能降低肥胖大学生体质量、体脂率、BMI及HOMA-IR,且有氧结合抗阻运动在微血管反应性、胰岛素抵抗方面干预效果更佳。另外,运动可能通过改善NO、ET-1、VEGF等因子水平提高肥胖大学生微循环功能,但其准确的生物学机制仍需进一步研究明确。
作者贡献:肖哲是本研究试验的执行者,负责试验实施、数据整理分析及论文撰写;朱欢、胡江平负责试验设计,并提出修改意见;杨梅、彭永、周慧敏参与试验的运动干预。
本文无利益冲突。
