孕妇肠道菌群对新生儿出生体质量的影响研究
2022-06-10肖雪王宇琦赖晓岚钟绍涛赵翠柳刘丹李琳谭荣韶杨红玲
肖雪,王宇琦,赖晓岚,钟绍涛,赵翠柳,刘丹,李琳,谭荣韶*,杨红玲
新生儿出生体质量不仅对其生长发育和健康状况评估具有重要意义,而且是儿童后期生长发育预测和成年期疾病预测的重要指标[1]。新生儿出生体质量过高或者过低都会严重影响新生儿的健康,甚至影响其母亲的健康[2]。新生儿出生体质量受多种因素影响,如母亲文化程度、新生儿性别、孕次、流产史、孕期患病、孕期被动吸烟等[3]。已有研究表明,肠道菌群组成与体质量有密切关系[4]。肠道菌群结构受宿主基因型、饮食、分娩方式、抗生素使用和益生菌等因素的影响,其中饮食结构是最直接且最容易控制的因素[5]。有研究揭示,饮食、宿主能量代谢和肥胖表型之间存在明显相关性[6]。胚胎期的环境和营养状况、遗传因素等都与新生儿出生体质量有密切联系[7]。另一方面,管理孕期体质量是孕期保健工作的重要内容之一,孕期体质量异常对妊娠结局及母婴健康都有重要影响[8-9]。以往研究多围绕孕妇肠道菌群与孕妇BMI、不良妊娠结局和新生儿肠道菌群的关系开展[10-11],较少有研究关注孕妇肠道菌群与新生儿体质量的关系。因此,本研究拟探讨孕期母体肠道微生物群及代谢状态与子代出生体质量的关系,从而为通过改善孕期肠道微生态结构来降低子代健康风险提供参考。
1 对象与方法
1.1 研究对象 以2017年1—9月在广州市妇女儿童医疗中心出生的516例新生儿及其孕母为研究对象。纳入标准:(1)孕妇无精神疾病史,能配合完成问卷调查和相关实验室检查;(2)自愿参与本研究并签署知情同意书。排除标准:(1)孕妇在过去6个月内使用过全身抗生素、皮质酮、细胞因子、氨甲喋呤或其他免疫毒性药物、激素拮抗剂和大剂量益生菌药物;(2)孕妇患严重心血管疾病、炎症性肠病、肠易激综合征、腹腔疾病等;(3)孕妇为人类免疫缺陷病毒感染者;(4)孕妇5年内进行过肠道手术;(5)孕妇患有由艰难梭菌或不明原因引起的慢性腹泻;(6)孕妇患有慢性便秘;(7)孕妇患有妊娠期糖尿病或妊娠期高血压;(8)孕妇在近4周内进行过常规抗生素治疗或益生菌补充。本研究经广州市妇女儿童医疗中心伦理委员会审批(伦理批件编号:2018030306)。
1.2 研究方法
1.2.1 资料收集及分组方法 在孕母至医院产检时,通过调查问卷收集其一般资料(如年龄、身高、体质量),并留取其血液、尿液及粪便样本。通过查阅医院病历系统,采集新生儿的出生医学信息。根据新生儿出生体质量,将其分为低出生体质量儿组(LW组,出生体质量<2 500 g,n=24)、正常体质量儿组(NW组,出生体质量为2 500~3 999 g,n=479)、巨大儿组(OW组,出生体质量≥ 4 000 g,n=13)[12]。
1.2.2 肠道菌群检测
1.2.2.1 粪便样本采集和DNA提取 使用带稳定液的粪便采集管收集孕妇的晨起空腹粪便,采集花生米大小的新鲜便样,编号后置于-80 ℃保存。采用Qiagen公司Stool DNA提取试剂盒提取粪便DNA,DNA提取完成后行琼脂糖凝胶电泳检测DNA纯度和浓度,合格DNA用无菌水稀释至1 ng/μl。
1.2.2.2 生物学的聚合酶链反应(PCR)扩增和PCR产物回收纯化 以稀释后的DNA为扩增模板,使用 通 用 515F(5'-GTGYCAGCCGGTAA-3') 和 806R(5'-GGACTACNVGGWTCTAAT-3') 引 物 扩 增16S rRNA基因的V4区域,反应程序设置为:95 ℃预变性5 min;30个循环(包括94 ℃,30 s;60 ℃,30 s;72 ℃,40 s);72 ℃,4 min,使用 New England Biolabs公司的Phusion High-Fidelity PCR Master Mix with GC Buffer进行扩增,所得PCR产物使用2%的琼脂糖凝胶进行电泳检测质量;选择主带大小为300~350 bp的序列,割胶回收目标条带。产物纯化使用Thermo Scientific公司Gene JET胶回收试剂盒。
1.2.2.3 高通量测序分析肠道菌群 使用建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用HiSeq进行上机测序。测序完成后原始数据拼接、过滤,基于有效数据进行分类操作单元(operational taxonomic units,OTUs)聚类和物种分类分析,根据OTUs聚类结果,对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。
1.3 统计学方法 采用SPSS 22.0统计软件进行数据分析,采用Adobe Illustrator CS5和R语言软件绘图。对计量资料进行正态性检验和方差齐性检验,满足正态分布和方差齐性的资料以(±s)表示,三组间比较采用单因素方差分析。选择香农指数和辛普森指数来反映三组孕妇肠道菌群的Alpha多样性。通过分析不同样品的OUTs 组成可以反映样品间的差异和距离,主坐标分析(principal coordinates analysis,PCoA)运用方差分解,将多组数据的差异反映在二维坐标图上,以观察不同样品、不同组别间微生物群落Beta多样性的分类学差异。采用LEfSe分析,分别对三组孕妇肠道菌群属水平上的相对丰度进行两两比较,识别组间具有明显差异的菌群。通过线性模型MaAsLin进行多元分析,以捕获各实验室检测指标与微生物属之间的相关性。通过Boruta随机森林分类器模型分别基于实验室检测指标和肠道菌群OTUs构建新生儿出生体质量分类预测模型,并绘制受试者工作特征(ROC)曲线,预测孕妇肠道菌群对新生儿体质量的影响。以P<0.05为差异有统计学意义。
2 结果
2.1 三组孕妇的基本情况及实验室检测指标比较 三组孕妇的年龄、身高、孕前体质量、孕前BMI、孕期体质量增长及各项实验室指标比较,差异均有统计学意义(P<0.05),见表 1~2。
表1 三组孕妇的基本情况比较(±s)Table 1 General characteristic of three groups of pregnant women

表1 三组孕妇的基本情况比较(±s)Table 1 General characteristic of three groups of pregnant women
注:LW组为低出生体质量儿组(出生体质量<2 500 g),NW组为正常体质量儿组(出生体质量为2 500~3 999 g),OW组为巨大儿组(出生体质量≥4 000 g)
孕期体质量增长(kg)LW 组 24 30.5±0.8 156.9±1.1 50.6±1.0 20.5±0.5 12.7±0.7 NW 组 479 30.1±0.2 159.7±0.2 52.0±0.3 20.4±0.1 13.2±0.2 OW 组 13 31.5±1.5 161.2±1.4 57.2±1.4 21.9±0.6 17.3±1.2 F值 37.54 49.23 63.83 58.95 77.63 P值 0.04 0.03 0.03 0.03 0.02组别 例数 年龄(岁)身高(cm)孕前体质量(kg)孕前BMI(kg/m2)
表2 三组孕妇实验室检测指标比较(±s)Table 2 Results of clinical laboratory indices of three groups of pregnant women
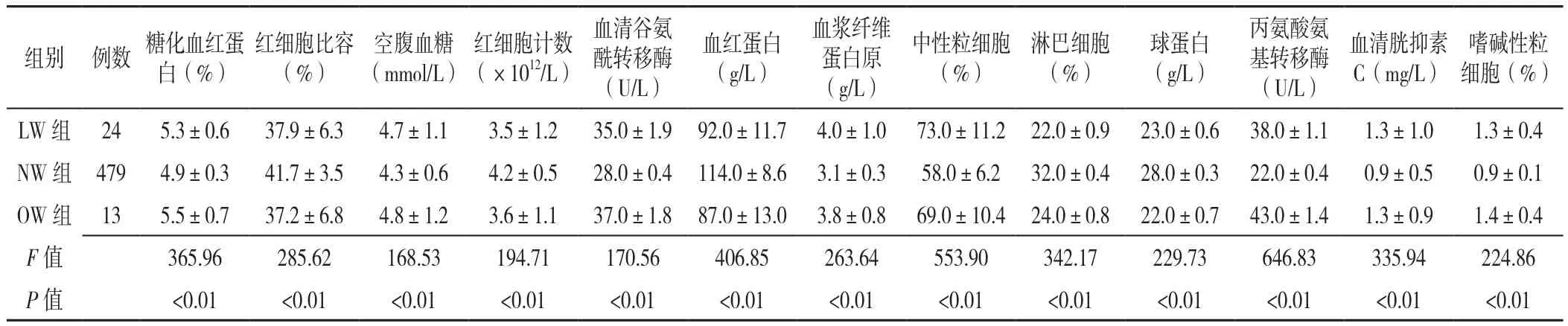
表2 三组孕妇实验室检测指标比较(±s)Table 2 Results of clinical laboratory indices of three groups of pregnant women
嗜碱性粒细胞(%)LW 组 24 5.3±0.6 37.9±6.3 4.7±1.1 3.5±1.2 35.0±1.9 92.0±11.7 4.0±1.0 73.0±11.2 22.0±0.9 23.0±0.6 38.0±1.1 1.3±1.0 1.3±0.4 NW组 479 4.9±0.3 41.7±3.5 4.3±0.6 4.2±0.5 28.0±0.4 114.0±8.6 3.1±0.3 58.0±6.2 32.0±0.4 28.0±0.3 22.0±0.4 0.9±0.5 0.9±0.1 OW 组 13 5.5±0.7 37.2±6.8 4.8±1.2 3.6±1.1 37.0±1.8 87.0±13.0 3.8±0.8 69.0±10.4 24.0±0.8 22.0±0.7 43.0±1.4 1.3±0.9 1.4±0.4 F值 365.96 285.62 168.53 194.71 170.56 406.85 263.64 553.90 342.17 229.73 646.83 335.94 224.86 P 值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01组别 例数 糖化血红蛋白(%)红细胞比容(%)空腹血糖(mmol/L)红细胞计数(×1012/L)血清谷氨酰转移酶(U/L)血红蛋白(g/L)血浆纤维蛋白原(g/L)中性粒细胞(%)淋巴细胞(%)球蛋白(g/L)丙氨酸氨基转移酶(U/L)血清胱抑素C(mg/L)
2.2 三组孕妇肠道菌群组成比较
2.2.1 门水平分析 516例孕妇的肠道菌群共检测出厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Protecobacteria)、广古菌门(Euryarchaeota)、疣微菌门(Verrucomicrobia)6个主要的门,其中Firmicutes在三组中占绝对优势。三组孕妇在主要门水平上的菌群相对丰度比较,差异无统计学意义(P>0.05),见表3。
表3 三组孕妇肠道菌群在门水平上的菌群相对丰度比较(±s,%)Table 3 The average relative abundance of intestinal floras at the phylum level of mothers of three groups of babies divided by birth weight

表3 三组孕妇肠道菌群在门水平上的菌群相对丰度比较(±s,%)Table 3 The average relative abundance of intestinal floras at the phylum level of mothers of three groups of babies divided by birth weight
注:Firmicutes=厚壁菌门,Bacteroidetes=拟杆菌门,Actinobacteria=放线菌门,Protecobacteria=变形菌门,Euryarchaeota=广古菌门,Verrucomicrobia=疣微菌门
组别 例数 Firmicutes Bacteroidetes Actinobacteria Protecobacteria Euryarchaeota Verrucomicrobia 其他LW 组 24 85.52±9.20 5.63±0.70 5.92±0.70 1.29±0.20 0.11±0.01 1.43±0.20 0.10±0.01 NW 组 479 78.19±8.10 13.16±1.30 5.25±0.60 2.13±0.20 0.41±0.04 0.75±0.20 0.11±0.01 OW 组 13 78.42±8.90 13.67±1.70 1.93±0.30 1.68±0.30 0.35±0.06 3.86±0.50 0.09±0.01 F值 12.90 14.60 9.30 10.50 8.40 13.30 5.20 P值 0.23 0.18 0.41 0.37 0.45 0.20 0.73
2.2.2 Alpha多样性分析 LW组、NW组及OW组的香农指数分别为(3.45±0.41)、(3.55±0.36)、(3.62±0.43),辛普森指数分别为(0.93±0.12)、(0.95±0.08)、(0.93±0.13)。三组香农指数、辛普森指数比较,差异无统计学意义(P>0.05),见图1~2。
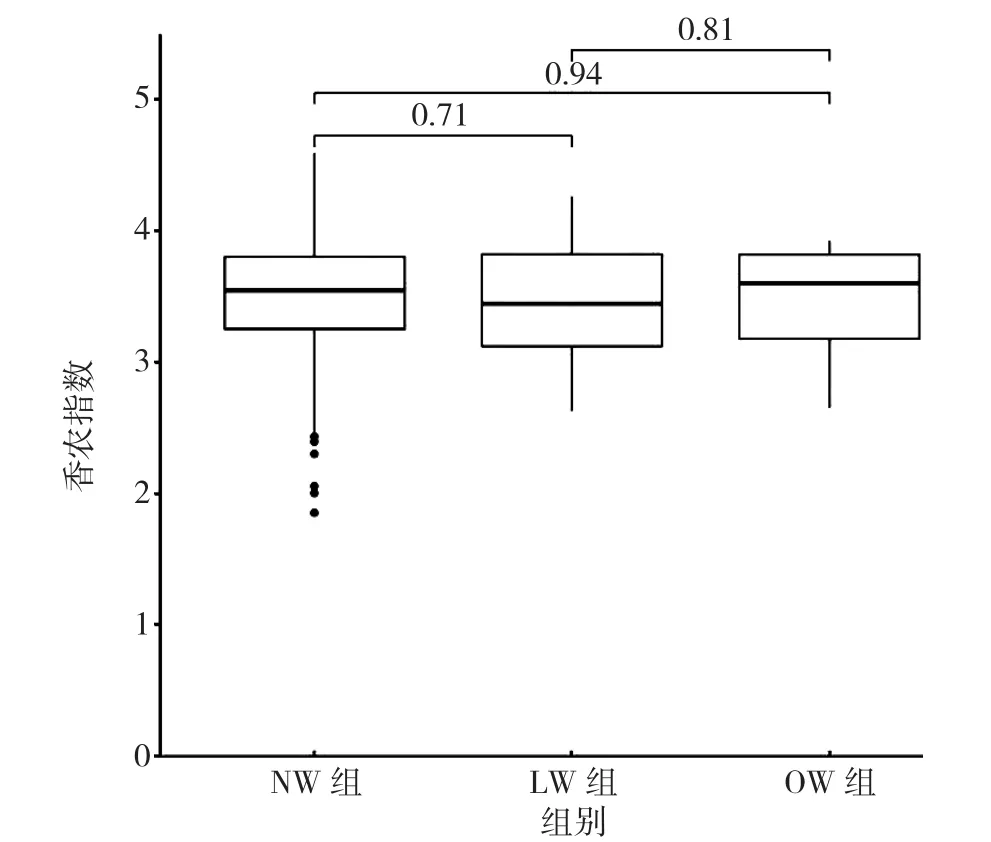
图1 三组孕妇肠道菌群Alpha多样性香农指数比较Figure 1 Shannon Diversity Index measuring the alpha diversity indices of intestinal flora of mothers of three groups of babies divided by birth weight

图2 三组孕妇肠道菌群Alpha多样性辛普森指数比较Figure 2 Simpson's Diversity Index measuring the alpha diversity indices of intestinal flora of mothers of three groups of babies divided by birth weight
2.2.3 Beta多样性分析 基于bray-cutis距离的二维PCoA值显示,主成分1和主成分2的解释度分别为5.33%和4.82%,三组间在菌群组成上比较,差异无统计学意义(P=0.22),见图3。

图3 三组孕妇肠道菌群的Beta多样性Figure 3 Beta diversity analysis of intestinal flora of mothers of three groups of babies divided by birth weight
2.2.4 属水平分析 三组孕妇肠道菌群中平均丰度较高的9个优势菌属分别为:普拉梭菌(Faecalibacterium)、罗氏菌(Roseburia)、布劳特氏菌(Blautia)、拟杆菌(Bacteroides)、巨单胞菌(Megamonas)、毛螺菌(Lachnospiraceae+)、瘤胃球菌(Ruminococcus)、普雷沃氏菌(Paraprevotella)、链球菌(Streptococcus)。其中,Faecalibacterium在三组中占优势,Bacteroides在LW组中为第二优势菌属(占8.26%),而NW组和OW组的第二优势菌属为Roseburia(分别占8.71%和9.42%)。三组孕妇肠道菌群在属水平上的相对丰度比较,差异无统计学意义(P>0.05),见表4。
表4 三组孕妇肠道菌群在属水平上的相对丰度比较(±s,%)Table 4 The average relative abundance of intestinal flora at the genus level of mothers of three groups of babies divided by birth weight
注:Faecalibacterium=普拉梭菌,Roseburia=罗氏菌,Blautia=布劳特氏菌,Bacteroides=拟杆菌,Megamonas=巨单胞菌,Lachnospiraceae+=毛螺菌,Ruminococcus=瘤胃球菌,Paraprevotella=普雷沃氏菌,Streptococcus=链球菌
组别 例数 Faecalibacterium Roseburia Blautia Bacteroides Megamonas Lachnospiraceae+ Ruminococcus Paraprevotella Streptococcus 其他LW 组 24 17.82±1.90 6.52±0.80 6.81±0.80 8.26±0.90 5.36±0.60 5.22±0.60 5.07±0.60 7.25±0.70 1.89±0.20 35.8±3.90 NW 组 479 17.39±1.60 8.71±0.80 7.96±0.80 5.79±0.60 4.35±0.50 6.52±0.60 5.81±0.60 5.22±0.50 2.75±0.30 35.5±3.60 OW 组 13 19.56±2.10 9.42±1.10 5.06±0.70 4.64±0.70 8.41±1.00 5.09±0.70 5.05±0.70 3.18±0.60 3.93±0.50 35.6±4.10 F值 6.80 7.50 8.30 12.10 10.90 5.50 4.60 10.90 8.90 4.10 P值 0.66 0.53 0.45 0.22 0.34 0.74 0.80 0.36 0.43 0.82
LEfSe分析结果显示:(1)与LW组相比,优势菌属Streptococcus和非优势菌属罗斯氏菌(Rothia)在NW组明显富集(P<0.05),而非优势菌属芽孢杆菌(Bacillaceae)、萝卜属菌(Raphanus)、甲烷球形菌(Methanosphaera)、巴氏杆菌(Barnesiellaceae)、Paraprevotella的相对丰度降低(P<0.05);(2)与OW组相比,优势菌属Megamonas和非优势菌属粪球菌(Coprococcus)、cc_115、韦荣氏菌(Veillonellaceae)、梭菌(Closrtidiaceae)、另枝杆菌(Alistipes)在NW组明显降低(P<0.05),而优势菌属Blautia和非优势菌属伊格尔兹氏菌(Eggerthella)明显富集(P<0.05);(3)LW组与OW组比较,非优势菌属Closrtidiaceae、Alistipes在OW组明显富集(P<0.05),非优势菌属Barnesiellaceae在LW组明显富集(P<0.05),见图4。
2.3 孕妇肠道菌群与实验室检测指标的相关性分析结果显示,实验室检测指标与微生物属之间存在308个有统计学意义的相互关联(q≤0.20,P<0.05)。其中尿胆原与36个菌属的相对丰度密切相关,见图5。

图5 孕妇实验室检测指标与肠道菌群物种的相关性网络Figure 5 Correlation network between maternal laboratory test indices and intestinal flora species
2.4 基于实验室检测指标和肠道菌群OTUs建立预测出生体质量的模型 (1)基于实验室检测指标的分类器模型构建ROC曲线,区分NW组与LW组的AUC为0.62,区分NW组与OW组的AUC为0.65,见图6~7。(2)基于肠道菌群OTUs分类器模型构建ROC曲线,区分NW组与LW组的AUC为0.77,区分NW组与OW组的AUC为0.78,见图8~9。

图6 基于实验室检测指标建立的区分NW组与LW组孕妇随机森林分类模型的ROC曲线Figure 6 ROC curve of random forest classification model based on maternal blood test indices for distinguishing between babies born with normal and low weight

图7 基于实验室检测指标建立的区分NW组孕妇与OW组孕妇随机森林分类模型的ROC曲线Figure 7 ROC curve of random forest classification model based on maternal blood test indices for distinguishing between a baby with normal birth weight and a macrosomia

图8 基于肠道菌群OTUs建立的区分NW组孕妇与LW组孕妇随机森林分类模型的ROC曲线Figure 8 ROC curve of random forest classification model based on maternal intestinal flora OTUs for distinguishing between babies born with normal and low weight

图9 基于肠道菌群OTUs建立的区分NW组孕妇与OW组孕妇随机森林分类模型的ROC曲线Figure 9 ROC curve of random forest classification model based on maternal intestinal flora OTUs for distinguishing between a baby with normal birth weight and a macrosomia
3 讨论
外源性和内源性因素都可能影响母体肠道微生物的构建,如母体易受膳食、肥胖、妊娠期并发症、环境暴露、抗生素使用等病理因素的影响,进而影响正常妊娠过程,诱导各种妊娠并发症的发生、发展,直接或间接影响妊娠结局,影响新生儿体质量的同时,也可能改变新生儿的表观基因并且遗传给子代,当子代成年后更易诱发肥胖、心血管疾病、糖尿病及其他代谢性疾病[13]。近年来,肠道菌群失衡已被证实与糖尿病[14]、高血压[15]、过敏性哮喘[16]、神经系统疾病[17]等多种疾病相关。研究发现,肠道菌群对宿主的代谢、免疫反应、生理活动等具有广泛影响[18-19]。由于妊娠期女性的解剖结构及生理、免疫功能发生变化,其肠道菌群也会受妊娠期特殊代谢过程的影响而发生改变[20-21]。本研究发现,516例孕妇的肠道菌群主要由Firmicutes、Bacteroidetes、Actinobacteria、Protecobacteria、Euryarchaeota、Verrucomicrobia 6个细菌门所组成,其中Firmicutes物种丰富度最高;而在属水平上,优势菌属包括Faecalibacterium、Roseburia、Blautia、Bacteroides、Megamonas、Lachnospiraceae+、Ruminococcus、Paraprevotella、Streptococcus 9种,其中Faecalibacterium在三组中均占优势,这与近两年同类研究结果基本一致[22-23]。正常围产期母体的肠道微生物基本保持“动态平衡”,但是因为孕期营养代谢需求量增加,激素分泌水平改变,调控血糖稳态、胰岛素敏感性,胃肠道发生系列重构,肠道菌群组成也发生适应性改变[24]。另一方面,胎儿的增长导致孕妇体内激素水平不断变化,从而引起体内微生物寄居环境变化,如各种微量元素、温度、湿度和pH等,因此孕妇肠道菌群也会发生改变。
在本研究中,与NW组和LW组相比,OW组孕妇肠道菌群中富集梭菌纲和梭菌目。前期研究证明Clostridiaceae具有产生短链脂肪酸的功能[25]。短链脂肪酸是由膳食纤维、蛋白质和多肽发酵产生的一种少于6个碳的羧酸,其逃避了肠上部宿主酶的消化,并被盲肠和结肠的微生物群代谢,其中乙酸、丙酸和丁酸是重要的代谢产物。乙酸进入外周循环供周围组织使用。丙酸是一类葡萄糖异生剂,具有抑制胆固醇合成的作用,因此很可能会降低血液血脂水平及心血管疾病的发生风险,同时短链脂肪酸被认为具有抗感染特性[26]。这表明,分娩巨大儿的孕母体内肠道菌群可能是被产生短链脂肪酸相关的细菌的代偿机制所抑制。
目前在临床上对孕期胎儿体质量干预的措施有限,难以奏效;即出生前已预知是巨大胎儿或体质量偏低的胎儿,在出生时仍然是巨大儿或低出生体质量儿;无论巨大儿或低出生体质量儿,都会影响其出生后的生长发育及疾病的发生。为此,本研究还探讨了孕妇肠道菌群对新生儿体质量的影响:基于母体肠道菌群建立区分正常出生体质量孕妇与低出生体质量和巨大儿孕妇的随机森林分类模型,其ROC曲线下面积分别为0.77和0.78,表明基于肠道菌群OTUs构建的分类器模型对正常出生体质量孕妇与低出生体质量孕妇和巨大儿孕妇的区分能力比基于实验室检测指标的区分能力更强,菌群的独立预测作用高于临床实验室检测指标。研究新生儿体质量的不同与孕妇的肠道菌群分布的变化来构建预测模型,找出对新生儿体质量预测有重要影响的微生物指标,可用于临床上对于巨大儿和低体质量儿出生的提前预测。根据孕妇孕期的肠道菌群变化提早干预孕妇的营养摄入,运用各种干预手段调控孕妇的肠道菌群的组成和分布,以此降低不良妊娠结局发生风险,这对于提高孕期母婴健康和改善分娩后母婴的远期健康都具有非常高的价值,也是现代医学实现“未病先防”和个性化医疗的新方向和途径。
作者贡献:肖雪进行文章的构思与设计,撰写论文并进行论文修订,对文章整体负责;赖晓岚、钟绍涛进行研究的实施与可行性分析;赵翠柳、刘丹、李琳进行数据收集;王宇琦、杨红玲负责数据整理、统计学处理、结果的分析与解释;谭荣韶对文章进行监督管理。
本文无利益冲突。
