氧化燃烧法收集生物14C的回收率影响因素研究
2022-06-10何庆驹左伟董传江李矗宋纪高陈思宇
何庆驹 左伟 董传江 李矗 宋纪高 陈思宇


关键词:氚碳测量;回收率;氧化燃烧法
14C是广泛存在于环境中的主要放射性核素之一,半衰期为5730a,最大β射线能量为156keV,其来源主要分为天然生成和人工合成[1]。天然生成的14C主要由宇宙射线中的中子在大气层中通过14N(n,p)14C反应生成。人工合成的14C主要来自反应堆核电站的运行和核试验。核电厂运行过程可能通过两种途径对公众造成辐射,即液态途径和气态途径。其中,14C是液态贡献较大的核素之一,氚和14C是气态贡献较大的核素。氚和14C对人体内辐射具有较大的剂量贡献[2],因此,对核电外围的氚、14C水平进行长期监测,对评价辐射环境状况具有重大意义。但是到目前为止,我国对生物中14C测量的相关规定及相关文献的研究较为匮乏[3]。
经过调研可知,测定生物14C的方法有加速器质谱法、量热法、液闪计数法等,不同的测量方法对应的制样方法各有不同,也各有优缺点。加速器质谱法虽然精度较高,但测量成本和制样要求较髙,在日常的辐射环境监测中,一般不采用这种测量方法;量热法虽然制样成本较低,但是测量精度不高且技术不成熟[1];液闪计数法是应用最广泛的方法,主要是通过氧化燃烧的方式来获取14C,再通过各种方法收集二氧化碳气体制取含碳沉淀或溶液,与闪烁液充分混合方能测量。在最新颁布的国标GB/T37865—2019《生物样品中14C的分析方法氧弹燃烧法》中,采用了氧弹燃烧的方式充分燃烧样品以获取生物样品中的14C。氧弹燃烧法虽然燃烧较为充分,但对闪烁液也有特殊要求,且燃烧时样品会瞬间爆燃,氧弹内部存在极高的温度和压力,比较危险。此外,支持氧弹燃烧法的设备较少,目前,世界上仅有美国PARR公司能提供符合标准的氧弹(容积大于1.5L)。总体来说,氧弹燃烧法的应用并不普及。目前,具备广泛开展条件的制样方法还是传统的以生物氧化炉燃烧氧化制样的液闪计数法。
在利用氧化燃烧法测量生物中14C的过程中,无论是通过氧弹还是生物氧化炉,都会受到回收率的影响。如果回收率太低,需要烧制大量生物样才能获取足够的含碳沉淀或溶液,严重拖慢进度,同时还会造成探测下限增加,不利于实际监测。本研究主要探讨了生物氧化炉制样时影响回收率的因素并进行对比。
1基本測量原理
无论哪种测量方法,均可划分为制样和测量两部分。其中,测量部分的测量值完全依赖于液体闪烁体计数器本身的特性,因此,测量结果主要影响样品制样过程。
1.1生物氧化炉制样步骤与方法
1.1.1取样与预处理
按照标准HJ/T61—2001《辐射环境监测技术规范》相关规定进行生物样品的采集。从指定的地点采集生物样品后,将样品放入塑料袋并送回实验室。除去杂质、洗涤后称量样品鲜重,然后放置在干燥容器中,置于冷冻干机或烘干机中干燥后再称量干重,计算样品的含水率。之后将干样存储在玻璃广口瓶中。
为避免交叉污染,不可直接用手接触样品。称重时,需注意脱水后的生物干样为多孔状物质,容易吸水,需要在干燥完毕后尽快称量。
1.1.2样品燃烧和CO2吸收
精确称取一定量(5.00g及以上,以确保CO2足够多)的生物干样置于生物氧化炉的样品舟中,再将样品舟置于氧化炉的氧化燃烧区正中央,以确保烧制时温度均匀。放置催化剂于催化区中,安装好封闭法兰,按照图1准备好后端吸收装置,但后端吸收装置暂时不与石英管出气口连接。
设置好氧化燃烧区和催化区的加热温度控制程序。先在氧化燃烧区通入纯氮气,流速约40mL/min,赶走燃烧区内的空气,目的是确保石英管内部的二氧化碳被排除。待氮气通入一段时间(不少于5min)后,打开氧气阀门,通入氧气,形成一定比例的混合气体。此后,将后端吸收装置与石英管出气口接通,并开启氧化炉加热开关。
按照设定的加热温控程序,氧化燃烧区的温度将以1~5℃/min的速度上升到300℃左右,保持60min,等样品完全焦化后,再继续以1~5℃/min的速度升温至厂家推荐的氧化燃烧温度,保持2h以上,使样品与氧气充分反应、完全氧化,直至样品舟中几乎无残渣。
1.2生物样中14C比活度的计算
生物样中14C的比活度通过式(1)计算得到:
由式(1)、式(2)可知,回收率的大小对最后的测量结果和探测下限影响较大,如何提高回收率是整个14C测量过程中的重难点。纵观国内外相关参考文献,对回收率影响因素的研究极少,均直接参照生物氧化炉的生产厂家推荐参数进行样品制备。
2实验方法
从制样过程开始分析可知,影响回收率的因素有氧气比例、催化剂的种类、烧样温度等。市面上的催化剂一般包括钯合金或者纯铜丝,但无论是采用钯合金还是纯铜丝,催化效率在各自的最佳催化温度区间内都超过95.00%,因此,催化剂的种类对回收率影响不大。氧气比例和烧样温度对回收率的影响较大,下面主要探究二者在定量情况下对回收率的影响。
根据山东省地方标准《环境生物氚、碳-14的测定》《氧化燃烧法测量生物介质中有机3H和14C的活度》等,葡萄糖样品可代表淀粉类生物样计算淀粉类样品的通用回收率。
2.1氧气比例的影响
一般氧气比例越高,样品的氧化速度越快,比如在国标GB/T37865—2019《生物样品中14C的分析方法氧弹燃烧法》中,通过在氧弹中充满纯氧气再点火的方式,使样品在一瞬间爆燃,在高温和高压下,迅速将有机碳转化为CO2,进而提高回收率。但是由于样品爆燃时会产生气体和极高的温度(约1500℃),氧弹需使用不锈钢桶作为容器。但是,生物氧化炉的石英管无法承受如此大的内压和温度,因此,需要尽可能地避免样品爆燃,以免引发事故。F976FBC5-D976-4DB3-9C3D-13B2EE44AE70
由于不同生物样的最佳氧化燃烧温度不同[5],本实验采用了葡萄糖进行制样。因此,在氧气比例研究实验过程中,在氧化燃烧过程中采用了厂家建议的450℃进行制样;为了避免因气體流速不同致使洗气瓶中气泡大小不同而影响CO2的回收,固定气体总流速为40mL/min。首先,若使用10.00g纯葡萄糖制样,理论上应生成CaCO330.30g。其次,每次烧制10.00g纯葡萄糖时,需控制氧气和氮气流速,改变混合气体中的氧气比例进行制样。制样完毕后,称量实际得到的CaCO3质量,通过公式(3)计算回收率。
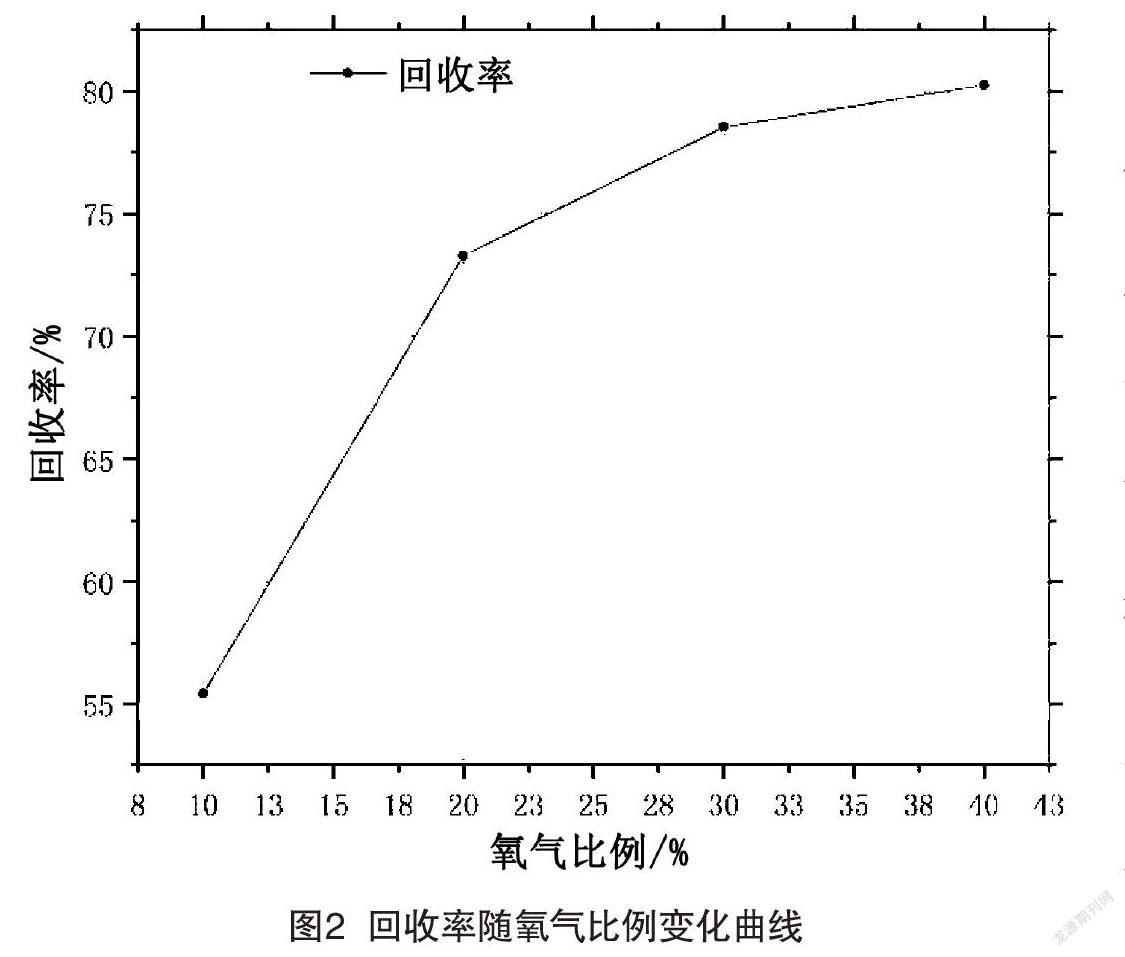
值得注意的是,在实验过程中,当氧气所占比例超过50.00%以后,样品极易发生爆燃,因此,氧气质量分数最大值未超过50.00%。最终实验测量了10.00%、20.00%、30.00%、40.00%4个氧气质量分数下的回收率。
最终的实验结果如图2所示。当氧气质量分数为10.00%时,由于样品不能充分氧化,在氧化燃烧2h后,样品舟内还有大量残留灰渣,计算得到的回收率仅为55.43%。当氧气质量分数上升时,回收率开始大幅提高;当氧气质量分数超过30.00%时,回收率上升幅度不大。
2.2温度的影响
理论上,制样温度越高,样品被氧化的速度越快,生成CO2气体的速度越快。但在实际操作中,为了避免短时间产生太多气体造成吸收瓶中碱液吸收回流或者吸收不及时,不同生物样的最佳氧化燃烧温度不同。本实验仅对葡萄糖样品在厂家建议的20%氧气质量分数的条件下测试了350、400、450、500、550℃等5个温度下的回收率。
在制样过程中,首先,计算得到使用10.00g纯葡萄糖制样时理论上应生成CaCO330.30g。其次,在烧制10.00g纯葡萄糖时,调节氧化燃烧区域的温控曲线,在上述温度下制样。制样完毕后称量吸收碱液的质量变化,即可得到实际吸收的CO2质量,二者之比即为回收率。
最终实验结果如图3所示。在温度低于350℃时,由于样品无法迅速氧化,会产生大量的炭化焦油附着在石英管上,计算得到的回收率仅为35.67%。当制样温度上升时,回收率开始大幅提高,逼近80.00%。但当温度在550℃(远超厂家建议的450℃)时,样品发生了爆燃,回收率反而略有下降。
3结论
通过对不同制样条件下的回收率进行测量,可以得到如下结论:
(1)在一定温度下,氧气比例越高,样品转化率越高,但在比例超过30.00%后,样品转化率变化不大,原因是样品与氧气的接触面有限,大量氧气并未与样品反应,就在气压的作用下流出石英管。此外,当氧气质量分数超过40.00%时,极易发生爆燃现象。综合考虑以上情况,氧气比例推荐设为30.00%。
(2)在一定氧气质量分数下,温度越高,样品转化率越高,但当超过厂家建议的制样温度100℃时,转化率反而下降,原因是样品此时极易发生爆燃,且短时间内产生CO2的速率过快,会导致吸收装置来不及吸收CO2。综合考虑以上因素,推荐制样温度为500℃。
(3)由于时间有限,实验的主要关注点仅为厂家推荐的一种影响因素,后期可以在不同温度以及不同氧气比例条件下进行测量。由于不同生物样的最佳氧化燃烧温度不同,建议先将每个生物样分类,然后对每一类进行最佳制样温度的测定,方便以后的监测任务。F976FBC5-D976-4DB3-9C3D-13B2EE44AE70
