血小板/淋巴细胞比值和中性粒细胞/淋巴细胞比值与胆道癌患者PD-1抑制剂治疗的预后分析
2022-06-09范润佳林万程苟苗苗千年松
范润佳,林万程,苟苗苗,闫 欢,千年松
1 解放军医学院,北京 100853;2 解放军总医院第八医学中心 呼吸学部肿瘤内科,北京 100094;3 北京大学第九临床医学院,北京 100000;4 解放军总医院第五医学中心 V 肿瘤内科,北京 100071;5 解放军总医院海南医院 肿瘤内科,海南三亚 572000
胆道癌(bile tract carcinoma,BTC)是一种罕见的恶性肿瘤。在过去30 年中,BTC 的发病率一直在上升,从1/100 000 增加至6/100 000[1-2]。约70%的BTC 患者在确诊时已失去根治性手术机会[3-4]。术后患者的1 年复发率可达67%[5]。因此,大多数BTC 患者须接受全身治疗。目前全身治疗的总体生存获益有限,5 年生存率不超过15%,其预后往往很差[6]。BTC 需要更有效的药物治疗。近年来随着靶向治疗和PD-1 抑制剂治疗的兴起,治疗方案也在不断变化[7]。目前多项临床试验表明,在BTC 患者中PD-1 抑制剂与化疗或靶向治疗的联合使用获得了令人鼓舞的效果[7-8]。考虑到高昂的治疗费用及免疫治疗无效超进展可能,有效且精准的标志物成为筛选获益患者的最佳选择。不同于基因突变预测靶向治疗疗效,免疫治疗预测因素复杂程度更高:肿瘤细胞的PD-L1表达、组织中TMB 以及肠癌中微卫星稳定状态是目前预测指标中应用最广的[9-11],但这三者均属于有创检测,且受到时间动态变化、不同阈值及不同检测方法的限制。因此,探索易在常规临床环境中评估的预后指标,更有利于实现精准治疗。一些研究表明,血清炎性标志物可用于PD-1 抑制剂治疗的疗效预测,如绝对中性粒细胞计数、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-tolymphocyte ratio,PLR)、单核细胞与淋巴细胞比值等[12-15]。NLR 和PLR 是几种应用PD-1 抑制剂治疗的实体瘤的预后标志物,较高的NLR 和PLR往往与较差的总生存(overall survival,OS)及无进展生存(progress free survive,PFS)相关[16-19]。但目前尚缺乏探讨基线NLR 和PLR 与接受PD-1 抑制剂治疗的BTC 患者预后的研究。因此,我们的研究拟分析基线NLR 和PLR 及二者联合指标对接受PD-1 抑制剂治疗的BTC 患者预后的影响。本研究根据NLR、PLR 的最佳截断值将所有患者分为高水平组和低水平组,联合指标CNP(combination of NLR and PLR)是由患者基线NLR 和PLR 的水平定义,两项指标均高的患者归为High CNP 组,一项不高/两项均不高的患者归为Median CNP 组/Low CNP 组。
资料与方法
1 资料 回顾性分析2017 年1 月- 2021 年4 月解放军总医院第一医学中心就诊BTC 患者(共84 例)的临床资料。纳入标准:1)病理明确诊断为肝内胆管癌、肝外胆管癌或胆囊癌;2)接受了至少两个周期的PD-1 抑制剂治疗;3)治疗期间至少完成1 次基于RECIST1.1 标准的影像学疗效评估;4)首次使用PD-1 抑制剂前的1 周内血常规及血生化结果完整。排除标准:1)无可评估病变;2)合并感染、自身免疫性疾病或特发性血小板计数减少性紫癜;3)患者体力状态评分(ECOG PS)>2,中性粒细胞计数<1.5×109/L,血小板计数<100×109/L;4)合并其他肿瘤及心力衰竭、肝肾功能障碍等严重内科疾病。
2 治疗方案 PD-1 抑制剂治疗剂量及周期取决于特定药物,2 周方案:纳武利尤单抗为240 mg/次;3 周方案:帕博利珠单抗为3 mg/kg;信迪利单抗200 mg/周期;特瑞普利单抗240 mg/周期。
3 ROC 分析及分组 以患者到达总体PFS 中位数时是否发生疾病进展为状态变量,以治疗前NLR 及PLR 为检验变量,绘制ROC 曲线(图1),得到最佳Cut-off 值,以根据此Cut-off 值进行NLR 及PLR 指标不同水平的分组,结果基于NLR 预测6 个月疾病进展的AUC 为0.726(Se=59.5%,Sp=90.5%),基于PLR 预测6 个月疾病进展的AUC 为0.702(Se=69.0%,Sp=71.4%)。NLR最佳Cut-off 值为2.295,PLR 为147.954。84 例患者按以下标准分组。A,单纯根据NLR 值,将患者分为以下2 组:1)High PLR(>147.954,n=43);2)Low PLR(≤147.954,n=41);B,单纯根据PLR值,将患者分为以下2 组:3) High NLR(>2.295,n=55);4)Low NLR(≤2.295,n=29);C,再按NLR和PLR 及二者联合指标CNP,将患者分为以下3 组:5)High CNP(PLR>147.954 且NLR>2.295,即“两者皆大”,n=36);6)Median CNP(PLR>147.954 或NLR>2.295 即“两者有一大”,n=26);7) Low CNP(PLR≤147.954 且NLR≤2.295,即“两者皆小”,n=22)。

图1 基线NLR(A)和PLR(B)预测6 个月内疾病进展的ROC 曲线Fig.1 ROC curves of the pretreatment NLR (A) and PLR (B)predicting progression of patients with BTC in 6 months
4 观察指标 1)临床特征和肿瘤特征:包括性别、年龄、吸烟情况、ECOG 体力状态评分、原发肿瘤位置、病理分型、转移器官、治疗方案、不良反应及基线全血细胞计数等。分析多线治疗及合并用药对PLR 及NLR 的分布影响。2)不同组别的疾病控制率(disease control rate,DCR):定义为所有治疗患者中达到完全缓解(complete response,CR),部分缓解(partial response,PR)或疾病稳定(stable disease,SD)的患者比例。3) 不同组别的PFS:定义为PD-1 抑制剂开始使用日期与疾病进展日期之间的时间。功能状态评分(performance status,PS)的恶化被归类为疾病进展。4)PD-1 治疗预后的影响因素分析。
5 统计学方法 采用SAS9.2 及MEDCALC11.9.6软件处理数据。连续变量以Md(IQR)或±s表示,分类变量报告频率和百分数。PFS 差异比较采用生存分析及log-rank 检验。采用Cox 模型进行单因素及多因素分析,筛选影响预后的自变量及计算其危险比。客观缓解率(objective response rate,ORR)及DCR 等定性资料采用χ2检验或Fisher 精确检验。P<0.05 为差异有统计学意义。
结果
1 患者临床特征 本研究共纳入BTC患者84 例,中位年龄59.5 岁,男性48 例,女性36 例。肝内BTC 29 例,肝外BTC 55 例,52 例治疗前已发生肝内转移,23 例肺转移,24 例骨转移,37 例为多发转移。51 例在一线治疗中应用了PD-1 抑制剂,见表1。治疗线及合并用药对PLR、NLR 分布进行了比较,差异无统计学意义(P>0.05)。见表2。

表1 BTC 患者基线临床特征Tab.1 Clinical characteristics of the BTC patients
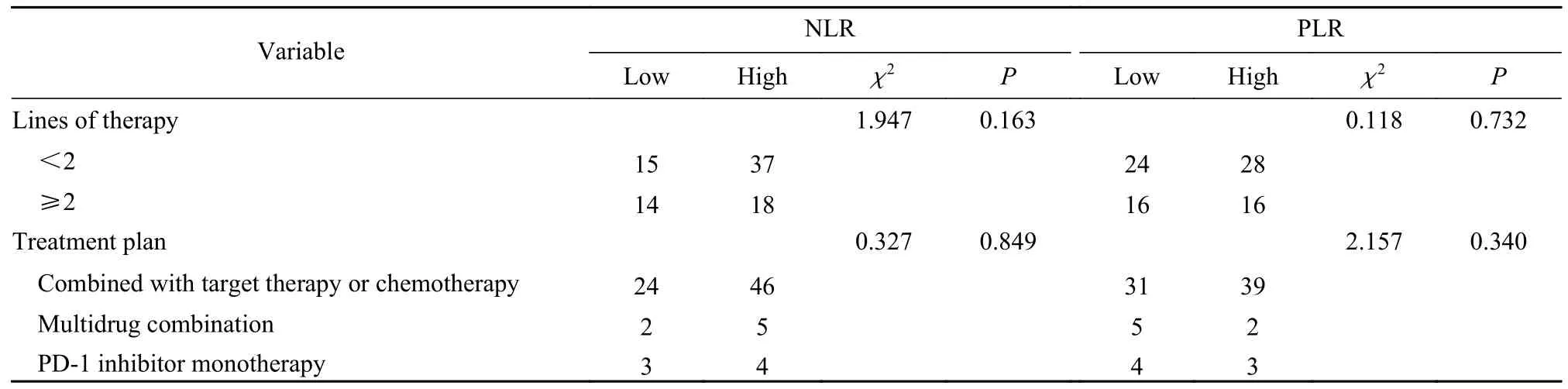
表2 胆道癌患者基线特征与NLR 或PLR 的关联(n)Tab.2 Association of baseline characteristics of the BTC patients with NLR or PLR (n)
2 PD-1 抑制剂治疗后的疾病控制率 84 例中,2 例CR,11 例PR,32 例SD,总 体ORR 为15.5%,DCR 为53.5%。17 例发生免疫相关不良反应,其中胃肠道毒性7 例,肝功能异常4 例,发热3 例,甲状腺功能减退3 例。疗效评估低PLR 组的DCR 大于高PLR 组(65.8%vs42.8%,P=0.028)。低NLR 组的DCR 大于高NLR 组(68.9%vs45.4%,P=0.040),Low CNP 组的DCR 显著优于High/Median 组(69.2%vs43.5%,P=0.025)。其ORR 达到27.2%,虽高于其他组,但差异无统计学意义(P=0.075)。见表3。

表3 PLR 组NLR 组及CNP 组的BTC 患者疾病反应率Tab.3 Response rate of the BTC patients according to PLR,NLR and CNP
3 PFS 结果分析 Low NLR组较High NLR 组的PFS 更长(10 个月vs5 个月,P<0.001)。Low PLR组较High PLR组中位PFS更长(9 个 月vs4 个月,P<0.001)。比较CNP 三组,Low CNP 组至High CNP 组PFS 依次下降,其中Low CNP 组中位PFS 显著长于Median CNP 组(10 个月vs6 个月,HR=0.416,95%CI:0.245~0.707),P<0.001。High CNP 组与Median CNP 组中位PFS 差异无统计学意义(4 个月vs6 个月,HR=1.063,95%CI:0.560~2.016)。见图2。

图2 不同PLR(A)、NLR(B)及CNP(C)分组的无进展生存曲线Fig.2 Progression-free survival curves stratified by PLR (A),NLR (B),and a combination of PLR and NLR (C) in BTC patients
4 影 响PFS的单因素及多因素Cox分析年龄、NLR 及PLR 是PFS 的独立危险因素。尽管年龄与PFS 显著负相关(HR=1.035,95%CI:1.009 ~1.061,P<0.001),但 PFS 与 NLR(HR=1.517,95%CI:1.037 ~2.217,P<0.001)和PLR(HR=1.802,95%CI:1.091~2.975,P<0.001)的相关性更强。在多变量分析中,NLR 和年龄依然是PFS 的独立影响因素。见表4。
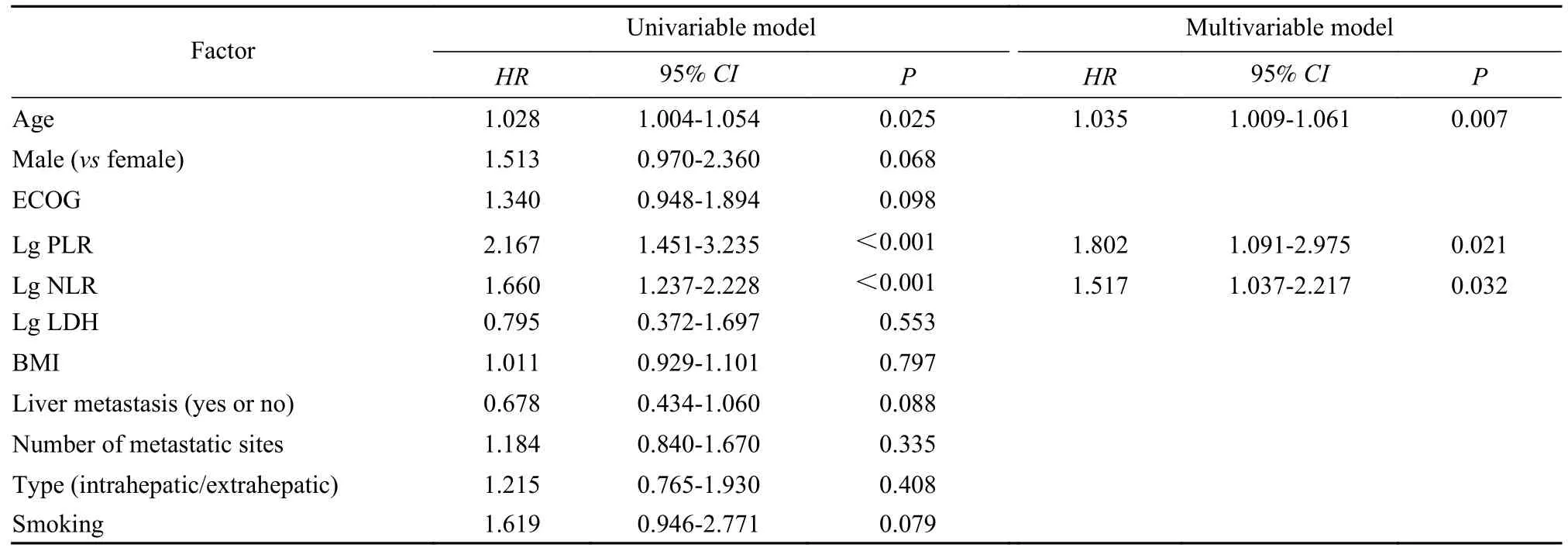
表4 影响BTC 患者无进展生存期的单因素和多因素分析Tab.4 Univariable and multivariable analyses of factors associated with PFS for the BTC patients
讨论
PD-1 抑制剂已彻底改变了多种实体瘤中少数患者的治疗格局。在BTC 散发病例中也观察到了一定疗效,但总体效果仍存在争议。选择有效标志物对筛选BTC 免疫治疗的最佳获益人群十分必要。PD-L1 的表达、肿瘤微环境中CD8+T 细胞和高肿瘤突变负荷是目前应用最广的PD-1 抑制剂疗效预测指标[20-22]。但它们仍然没有在临床实践中广泛应用,部分原因是成本高或缺乏标准化,因此有必要充分利用常规临床指标来预测预后。
中性粒细胞、淋巴细胞和血小板是外周血的3 个主要亚群。淋巴细胞在肿瘤免疫中具有核心作用,其激活和肿瘤内浸润是抗肿瘤免疫反应所必需的,增加肿瘤区域的淋巴细胞浸润对实体瘤的治疗反应更好,淋巴细胞减少反映细胞介导的免疫反应受损[23]。同时,免疫反应是淋巴细胞与其他调节细胞之间相互作用的结果。首先,肿瘤内中性粒细胞(intratumoral neutrophils,TANs)在肿瘤进展中起着双刃剑的作用。先前的研究表明,尽管CD11b+/Ly6G+TANs 对肿瘤细胞具有细胞毒性,但TANs 也可以通过影响肿瘤微环境参与肿瘤进展和转移[24-25]。如Kargl 等[26]研究结果表明较高的TANs 直接影响肿瘤细胞,减少TME 中的CD8+T 细胞可抑制抗肿瘤免疫反应。其次,Guan等[27]研究表明循环的中性粒细胞可通过释放中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)促进肿瘤细胞的增殖转移。因此,升高的NLR,无论是中性粒细胞增加还是淋巴细胞减少,都可能导致患者对PD-1 抑制剂的反应不佳。这可能部分解释了为什么NLR 升高与更差的疾病控制率相关。本研究结果同样显示应用PD-1 治疗的BTC 患者,高基线NLR 组有更大概率发生疾病进展与不良预后。
血小板是炎症反应的一部分,反应性血小板增多症在实体瘤中很常见[28],这是在高细胞因子血症的背景下肿瘤与宿主相互作用诱导的结果,其中IL-6 起着重要作用[29]。同样,IL-6 不仅能诱导巨核细胞分化为血小板,还能诱导中性粒细胞增殖。Caudrillier 等[30]研究表明血小板可能与中性粒细胞相互作用促进NETs 的释放,这可能是PLR 可以一定程度反映机体的免疫炎症状态的原因。Diem 等[16]的研究根据PLR 的三分位数(PLR<193、PLR 193~328 和PLR>328)将患者细分为三组,表明PLR 值较高的患者OS 和ORR较差。同时Russo 等[17]证明基线 PLR ≥200 且接受纳武利尤单抗治疗的非小细胞肺癌患者与更差的ORR、DCR、PFS、OS 相关。本研究中,高于147.954 的基线PLR 与更差的PFS(P<0.05)和更低疾病控制(P=0.028)相关。DCR 和PFS 趋势与之前研究类似,但ORR 差异无统计学意义。
尽管目前已有部分关于NLR 和PLR 影响实体瘤预后的研究,但尚缺乏联合指标CNP 与免疫治疗预后的相关性研究,本研究分析表明CNP 对BTC 患者预后的敏感度更高。Low CNP 组患者的中位生存期和疾病反应率明显高于其他组,这与Graziano 等[31]关于NLR 联合PLR 预测乳腺癌新辅助化疗预后的研究结果相似。同时,先前一项关于非小细胞肺癌的预后因素研究提示PLR 是NLR 的一个补充预后因素,推测NLR 升高部分抵消了PLR 对生存预测的影响,当NLR 降低时,PLR 升高的患者较PLR 未升高的患者生存率更低[32]。本研究结果与其有相似的趋势,Low CNP组与Median CNP 组相比,患者表现出明显的生存获益,而Median CNP 与High CNP 组差异无统计学意义。表明NLR 和PLR 均低于截断值的BTC患者有更大概率从免疫治疗中获益。
Kasanen 等[33]一项研究表明免疫系统的年龄相关变化可能会影响转移性黑色素瘤患者对抗PD-1 治疗的反应,高龄与低比例的幼稚CD8 + T细胞存在显著相关性。同样在本项研究中年龄与BTC 免疫治疗患者的PFS 显著相关,随着年龄增大,患者表现出更短PFS。
本研究存在一定的局限性:1)当前研究为单中心、小样本的回顾性研究,证据级别不高并且可能存在偏倚。因此,这些初步结果有必要进行前瞻性研究进一步验证。2)缺乏未接受PD-1 抑制剂治疗患者的对照组。3)OS 同样是研究的重要观察指标,但由于研究过程中患者失访以及疾病进展后更换治疗措施,导致OS 的数据删失比重过大,未将其纳入结局指标。
总之,我们的研究表明治疗前NLR 和PLR是BTC 患者PD-1 抑制剂治疗预后的独立预测因子,联合指标CNP 可以将PD-1 治疗预后更好的患者筛选出来。这些炎症指标可以帮助临床医生在治疗开始前识别更有可能从抗PD-1 治疗中受益的BTC 患者。此外,作为常规性质的评估,这些标志物可以更容易地应用到临床实践中。
