血小板衍生生长因子-BB对骨髓间充质干细胞多向分化及自噬相关蛋白表达的影响
2022-06-09蔡宇艺何江峰扈梓悦葛剑平
李 琳,蔡宇艺,何江峰,扈梓悦,葛剑平
(同济大学口腔医学院·同济大学附属口腔医院牙体牙髓病教研室,上海牙组织修复与再生工程技术研究中心,上海 200072)
牙髓再生是治疗牙髓感染或损伤的新方法,通过趋化内源性细胞归巢来替代外源性细胞移植,可以避免体外细胞培养和体内细胞移植等复杂的程序,是牙髓再生研究的热点之一。
血小板衍生生长因子(platelet derived growth factor,PDGF)是一种多种细胞可以产生的多肽生长因子,研究证明PDGF能促进小鼠牙髓样组织的异位再生[1],具有促进细胞增殖以及募集周围干细胞,促进血管生成和成骨的潜力,是趋化作用最强的骨生长因子[2-3],在促进人牙髓干细胞介导的牙本质-牙髓组织再生方面具有强大的功能[4]。因此PDGF-BB可能在牙髓再生中趋化间充质干细胞迁移和促进细胞增殖。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)作为一种多向分化的干细胞,已被证实可感受外界信号刺激,趋化至受损部位,进一步发生细胞分化而发挥组织修复再生作用。自噬是是真核细胞面对应激时自我修复过程,在进化过程中高度保守,通过基于溶酶体的胞内降解发挥维持细胞和生物体稳态平衡的作用[5]。自噬水平以自噬小体的形成为特征,而自噬蛋白ATG5(autophagy related gene-5,ATG5)和LC3(microtubule-associated protein light chain 3,LC3)直接参与调控自噬小体从形成到降解的整个过程。其中ATG5是自噬核心蛋白,参与自噬前体双层膜结构的形成;LC3是在高等真核细胞中发现的第一种自噬体膜蛋白,为监测自噬活动的标志性分子[6]。过往研究表明,自噬在牙髓炎、根尖周感染、牙组织的发育、修复中发挥细胞保护作用[7]。在犬牙异位牙髓血运重建过程中,自噬在基质细胞衍生因子-1α(SDF-1α)介导的牙髓干细胞迁移和牙髓再生中参与[8]。
本研究基于细胞归巢原理,通过PDGF-BB联合Collagen Type Ⅰ支架进行异位牙髓再生,探讨PDGF-BB对牙髓再生过程中的自噬相关蛋白表达影响。
1 材料与方法
1.1 主要试剂与仪器
实验所用大鼠购自斯莱克实验动物有限公司(中国)。PDGF-BB购自美国R&D Systems公司;KIT-9710免疫组化试剂盒、AEC-0037免疫组化显色剂购自福州迈新生物技术开发有限公司;proteintech ATG5 Antibody、proteintech LC3 Antibody购自美国Proteintech公司;标记山羊抗兔IgG购自中杉金桥生物技术公司;碱性磷酸酶检测试剂盒上海碧云天生物技术有限公司。组织处理仪STP120购自Thermofisher,石蜡包埋机(LEICAEG1150H)、石蜡切片机(LEICARM2235)、烤片机(LEICAHI1120)购自德国leica公司;酶联免疫检测仪购自美国Thermo公司。
1.2 PDGF-BB对BMSCs增殖、迁移、多向诱导分化的影响
1.2.1 大鼠BMSCs分离与培养 取3周龄雄性大鼠3只,10%水合氯醛麻醉致死,75%乙醇内浸泡消毒10 min;使用眼科剪、眼科镊小心分离大鼠皮肤,从髂骨和跟腱部位将长骨分离,夹取长腿骨到超净台内含1%双抗的PBS中,分离骨组织周围肌肉。分别剪断股骨和胫骨两端显露骨髓腔,1 mL注射器吸取培养液冲骨髓腔,反复数次直至骨发白。细胞悬液反复吹吸将骨髓冲散,转移到15 mL离心管内,1 000 r/min,离心半径15 cm,离心6 min,弃上清液后重悬,细胞计数,以1×107个/mL的密度接种于10 cm培养皿中,37 ℃、5%CO2及饱和湿度条件下培养。4天后吸走原培养液,预热PBS冲洗1遍更换新鲜培养液,之后每隔3天换液,待细胞生长至80%以上融合度后进行细胞传代。
1.2.2 大鼠BMSCs流式鉴定 待细胞生长至80%融合度后用0.25%胰酶消化贴壁细胞,PBS洗涤两次,1 000 r/min离心5 min。用40 μm过滤器过渡,获单细胞悬液。PBS重悬细胞,调整细胞密度至3×106个/mL。参说明书,分别将CD29、CD45、CD3、CD90和CD11b加入20 μL的抗体稀释液中(稀释浓度1∶500),4 ℃孵育1 h。100 μL细胞悬液加至对应流式标记管中,加入直接标记的抗体。室温避光孵育1 h后,于每管加入适量PBS,1 000 r/min,离心半径15 cm,离心5 min,弃上清液。用PBS液100 μL重悬细胞,流式上机检测(1 h内)。
1.2.3 CCK-8法 用含体积分数10%胎牛血清的DMEM高糖培养基分别配制含不同浓度PDGF-BB的培养液,浓度设定为0、10、50、100 ng/mL,每浓度设5个复孔,对照组不加生长因子。取P3代细胞,以2×103个/孔接种至96孔板,边缘孔用无菌PBS充填。37 ℃、5%CO2下培养24 h,细胞单层铺满孔底后弃培养液,分别加入不同浓度PDGF-BB的培养液200 μL/孔,每3天更换培养液。分别于接种后连续8天同一固定时间检测,每孔加入10 μLCCK-8溶液,未接种BMSCs的孔加入等量培养液和CCK-8溶液作空白对照。培养箱内孵育1 h后,450 nm酶联免疫检测仪测定各孔吸光度值(A450),记录,取平均值。以时间为横轴,吸光度值为纵轴,绘制增殖曲线。
1.2.4 Transwell法 取P3代BMSCs,胰酶消化,用不含血清DMEM高糖培养基制备细胞悬液,调整细胞密度至1.5×105个/孔。向Transwell小室的下层(24孔板)分别加入浓度为0、10、50、100 ng/mL的PDGF-BB培养基500 μL,每组设3个复孔,细胞按照1.5×105个/孔密度接种于小室上层,将上层小室轻放入下室,直至上室细胞完全浸没在下室培养液中,轻轻晃动培养板排除气泡,将培养小室置于培养箱内培养,37 ℃、5%CO2下培养24 h后,用无菌小镊子取出培养小室,轻洗净上层培养液,小棉签轻擦上层,PBS轻洗2遍,放入甲醛固定液,固定20 min,PBS洗2遍。固定后的培养小室移入0.1%的结晶紫染色液中染色20 min,双蒸水洗涤3次。倒置显微镜下观察,拍照,计数。
1.2.5 实时荧光定量PCR检测 P3代的BMSCS以1×104个/mL接种细胞,常规培养至80%融合,PDGF-BB培养液(浓度分别为0、10、50、100 ng/mL)常规条件诱导培养,每2天换液,诱导周期为14 d。采用TRIzol试剂提取总RNA,合成cDNA,用SYBR Green PCR Mix进行PCR反应条件:95 ℃预变性30 s,然后95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s、60 ℃ 15 s进行40个循环。以GAPDH作为内参照,2-ΔΔCt计算目的基因相对表达量。引物由生工(上海)贸易有限公司合成。qRT-PCR引物序列信息见表1。

表1 引物序列表Tab.1 Primer sequences for RT-PCR
1.3 细胞免疫荧光染色
细胞爬片高压消毒,P3代BMSCs以1×104个/孔的密度接种至6孔板,用含体积分数10%胎牛血清的DMEM高糖培养基培养在37 ℃、5%CO2条件下培养24 h后,用含PDGF-BB的培养液(0、10、50、100 ng/mL)处理细胞,30 min后4%多聚甲醛固定,室温静置30 min后行细胞免疫荧光染色。吸取PBS,加入2%BSA封闭液,室温封闭1 h,吸取封闭液,向每个细胞爬片上加入相应一抗工作液(用1%FBS配制)4 ℃孵育过夜,用PBS洗去一抗,加入相应AlexaFluor-488标记的山羊抗兔IGg,37 ℃避光孵育1 h,镜检拍照。
1.4 牙髓组织异位再生的模型建立
经过同济大学附属口腔医院伦理委员会审核(审批号:〔2019〕-DW-030),参考并改良文献方法,将新鲜拔除的切牙或前磨牙浸泡于0.9%NaCl溶液中,小心刮除剩余牙周膜及牙周组织后,将离体牙浸泡在75%乙醇溶液中。离体牙置入5.25%NaOCl溶液浸泡1周[1]。进行根管预备,通过舌冠进入牙髓腔,去除牙髓组织,用手锉和旋转器械清洁和塑造根管[9],但没有用牙胶封闭根管。使用5.25%次氯酸钠溶液、17%EDTA溶液与3%过氧化氢溶液交替冲洗根管,尽量去除根管内残留的牙髓组织及牙本质碎屑,高温高压灭菌。
以一组为例,根据每组所需的胶原凝胶的量进行计算:每颗离体牙制备80 μL凝胶×4颗离体牙(每组),共4组。将BD Collagen Type Ⅰ、10×磷酸盐缓冲液(10×PBS)、双蒸水、1NNaOH溶液置于冰上备用。在通风橱中按下列顺序制备凝胶:依次向Eppendorf管中加入40 μL10×PBS、1.75 μLNaOH溶液、282.15 μL双蒸水于Eppendorf管中,最后加入根据公式计算所需76.1 μL BD Collagen Type Ⅰ的体积。将凝胶混合物置于冰上备用(仅限2~3 h内使用或直接使用,室温下凝胶形成时间为30 min)。实验组PDGF-BB溶液体积用双蒸水体积进行替代计算。
基于免疫荧光染色实验结果,选用50 ng/mL浓度的PDGF-BB用于观察其对内源性细胞的趋化、牙髓再生效果及自噬相关基因ATG5和LC3的表达。将PDGF-BB溶于浓度为1.8 mg/mL Collagen Type Ⅰ凝胶状内,注射入经根管治疗后的人离体牙中。每颗离体牙注射100~150 μL Collagen Type Ⅰ凝胶。无PDGF-BB组作为对照组。将注入含有或不含PDGF-BB凝胶的离体牙置于37 ℃的恒温箱内,30 min后即可形成凝胶。
以雄性7周龄SD大鼠为动物模型,行大鼠腹部离体牙异位移植术,在预实验基础上,根据表2分组方案,随机将实验动物分为4组。

表2 体内实验分组方案Tab.2 In vivo experimental grouping scheme
所有手术过程均由同一术者操作完成。随机选择植入材料进行取7周龄雄性SD大鼠,经腹腔静脉注射5%水合氯醛(1.2 mL/100 g)麻醉,固定消毒,腹部制备直径为1 cm的袋状切口,钝性分离,将含有细胞因子的胶原凝胶注入离体牙,上述离体牙植入大鼠腹部皮下袋,对位缝合;术后连续3 d肌内注射头孢唑林钠抗炎,常规饲养2、4个月。
1.5 免疫组化染色方法
分别于移植术后2、4个月,局麻下将离体牙从大鼠腹部皮下小心分离,过量注射水合氯醛(500 mL/100 g)处死动物,得到含再生牙髓样组织的牙齿。临床收集3名患者因无保留价值而拔除的第三磨牙,牙齿无龋损且无牙髓炎。牙齿离体后立即用0.9% NaCl溶液冲净,用细金刚砂车针在冷却水下沿牙齿长轴磨出纵向沟槽,沿沟槽劈开各牙取出牙髓组织。将得到的再生牙髓组织及天然人牙髓组织置入4%多聚甲醛中固定48~72 h,经10%EDTA溶液脱钙6个月,标本经乙醇脱水,石蜡包埋,连续切片。根据试剂盒说明进行免疫组织化学染色:常规方法脱蜡至水;将切片放置于3%H2O2室温孵育10 min以灭活内源性过氧化物酶;将切片加入柠檬酸缓冲液中,微波炉热修复法行抗原修复,常温冷却,重复3次;5%BSA封闭液室温孵育30 min;加入一抗,置于湿盒中4 ℃过夜;将切片取出,PBS浸洗5 min,3次;加入二抗,常温孵育30 min,PBS浸洗5 min,3次;加入AEC显色,苏木精复染。中性树胶封片,镜检拍照。
1.6 统计学处理
2 结 果
2.1 BMSCs分离与鉴定
采用胰蛋白酶消化法传代得到的P3细胞。P3代大鼠BMSCs形态呈均一的长梭形,排列成旋涡状或成纤维细胞样形态(图1A)。流式细胞检测显示,CD29、CD90、CD3、CD11b、CD45在BMSCs细胞中低表达(图1B~图1D)。

图1 大鼠BMSCs分离及鉴定Fig.1 Isolation and identification of rat BMSCs(×200,Bar=50 μm)A:P3代BMSCs形态(×200,Bar=50 μm);B、C、D:BMSCs细胞表面标志物CD29、CD90、CD3、CDD45、CD11b流式细胞鉴定
2.2 PDGF-BB对BMSCs增殖的影响
CCK-8结果显示,正常条件下生长的BMSCs(0 ng/mL组)在接种后的第1~2天,为细胞增殖的潜伏期,第3~7天细胞进入快速增殖期,呈对数增殖,之后BMSCs增殖变缓慢,进入平台期。而加入细胞因子作用后,BMSCs的增殖受到不同程度的影响,表现为随着PDGF-BB浓度的增高,BMSCs增殖速度加快,不同浓度PDGF-BB对BMSCs细胞增殖的影响差异有统计学意义(P<0.05),见图2。

图2 BMSCs增殖曲线Fig.2 Proliferation curve of BMSCsn=5,*P<0.05
2.3 PDGF-BB对BMSCs迁移的影响
图3为BMSCs迁移细胞的结晶紫染色图。Transwell实验结果显示,当BMSCs培养基中加入不同浓度PDGF-BB培养24 h后,10 ng/mL组、50 ng/mL组及100 ng/mL的BMSCs细胞迁移数量明显高于对照组(0 ng/mL组),并且随着PDGF-BB浓度的增大,迁移的细胞数逐渐增多,呈现剂量依赖性,差异有统计学意义(P<0.05)。

图3 BMSCs迁移结晶紫染色(×200,Bar=50 μm)Fig.3 BMSCs migration crystal violet staining(×200,Bar=50 μm)
随机选取5个视野,对结晶紫染色阳性BMSCs细胞计数并进行统计学分析。随着PDGF-BB浓度增高,迁移的细胞数逐渐增多明显高于对照组,不同浓度PDGF-BB对BMSCs迁移的影响有明显差异(图4)。

图4 BMSCs迁移细胞数统计柱状图(n=3)Fig.4 Number of migrating BMSCs in different groups(n=3)实验组与对照组比较,*P<0.05
2.4 PDGF-BB对BMSCs成骨分化及成神经分化的影响
BMSCs向成骨细胞诱导分化后,成骨特异性基因Runx2、OPNmRNA的表达量与对照组相比,随PDGF-BB浓度升高递增;当细胞因子浓度达到100 ng/mL时,OPN及Runx2的mRNA表达量明显增高,达最大值(图5)。

图5 诱导分化后Runx2和OPN的表达Fig.5 Expression of Runx2 and OPN after induced differentiation实验组与对照组比较,*P<0.05
BMSCs向神经细胞诱导分化后,成神经标志物MAP2和β-Ⅲ-tubulin的表达量与对照组相比,随PDGF-BB浓度升高递增;当细胞因子浓度达到100 ng/mL时,MAP2和β-Ⅲ-tubulin的表达量明显增高,达最大值(图6)。
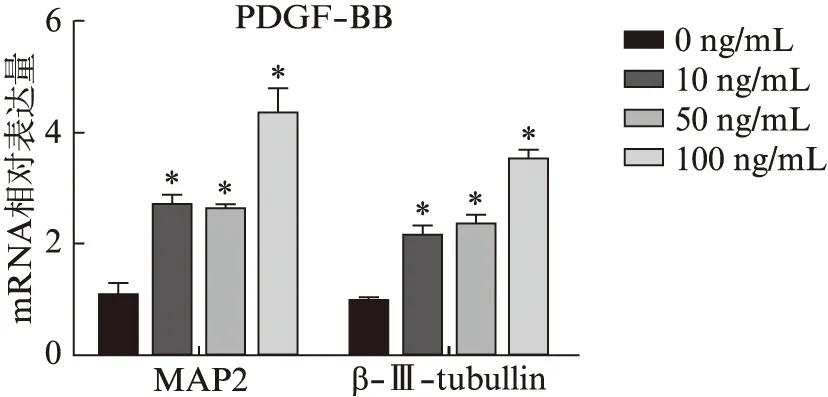
图6 诱导分化后MAP2和β-Ⅲ-tubulin的表达Fig.6 Expression of MAP2 and β-Ⅲ-tubulin after induced differentiation实验组与对照组比较,*P<0.05
2.5 细胞荧光染色检测
通过细胞免疫荧光技术检测PDGF-BB是否可激活自噬相关蛋白表达。用不同浓度PDGF-BB(0、10、50、100 ng/mL)诱导BMSCs 24 h后,免疫荧光显示各浓度组均检测出抗ATG5、LC3阳性细胞(图7)。空白组的基础自噬水平较实验组中明显较低,证明PDGF-BB是否可激活自噬;50 ng/mL PDGF-BB诱导后阳性细胞较多。初步判断在50 ng/mL PDGF-BB诱导下,自噬水平较高,为体内实验选择PDGF-BB诱导浓度提供参考。

图7 不同浓度PDGF-BB对BMSCs的自噬激活(×100,Bar=50 μm)Fig.7 Autophagy activation of BMSCs by different concentrations of PDGF-BB(×100,Bar=50 μm)
2.6 再生牙髓样组织大体观察、自噬相关蛋白表达变化
为探究自噬在牙髓再生中的表达水平是否与PDGF-BB相关,比较再生牙髓样组织和原代人牙髓组织中自噬相关蛋白ATG5、LC3的表达。PDGF-BB组ATG5、LC3的表达明显高于对照组牙髓样组织,且其自噬蛋白的表达接近天然人牙髓组织,4个月PDGF-BB组的LC3表达明显高于2个月PDGF-BB组(图8A),这与Image J软件分析统计结果相同(图8B)。值得注意的是,PDGF-BB组4个月后ATG5的表达高于对照组牙髓样组织,但略低于2个月,同时空白组4个月后ATG5的表达低于2个月。
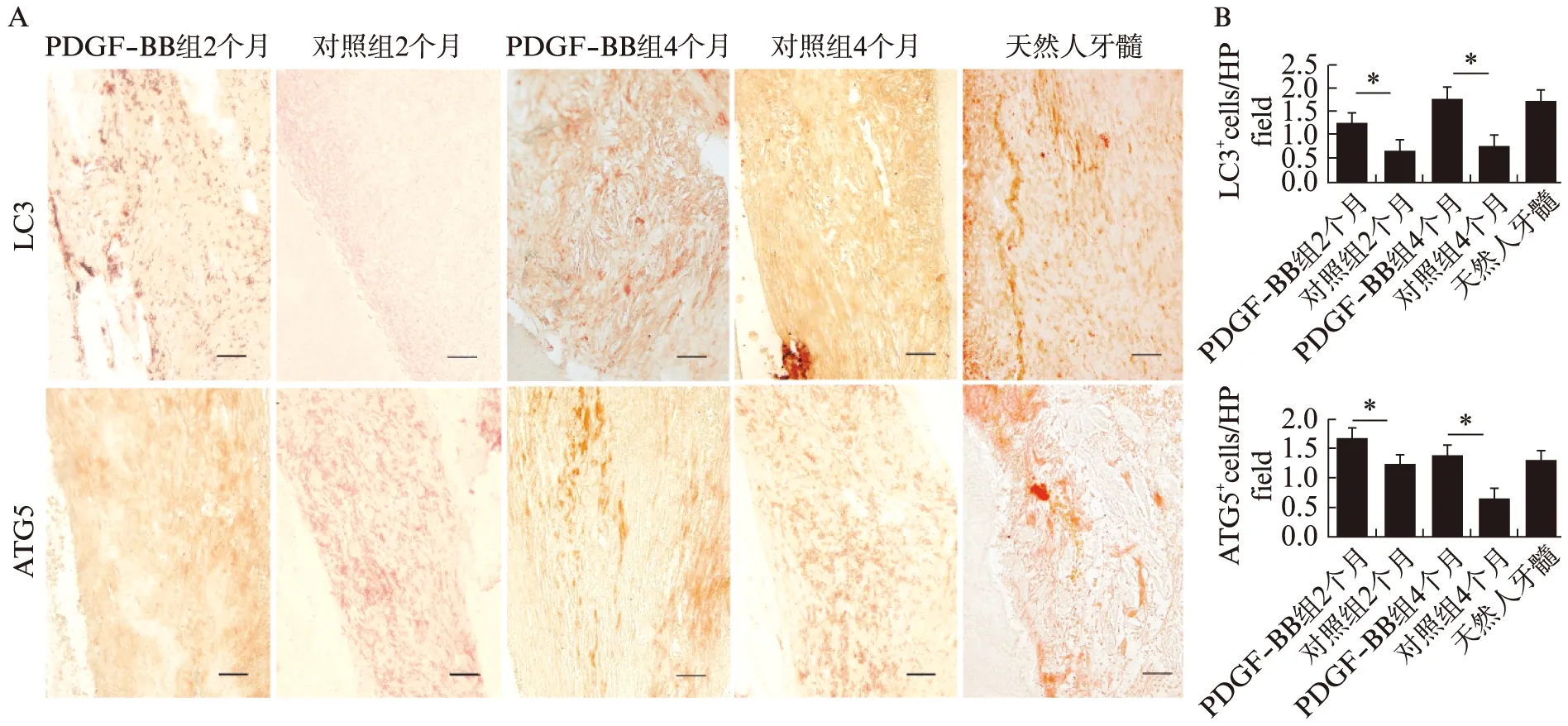
图8 自噬蛋白在牙髓样组织再生过程中的表达情况Fig.8 Expression of autophagy related proteins during pulp like tissue regenerationA:各组牙髓样组织免疫组化染色切片,标尺大小为50 μm(×100);B:Image J对自噬蛋白表达面积进行定量评估,实验组与对照组差异有统计学意义(*P<0.05,n=3)
3 讨 论
BMSCs作为一种具有多向分化潜能的前体细胞,相对其他组织干细胞而言,具有取材丰富,提取简便的优势。PDGF-BB是PDGF家族(PDGFs)中的一员[10]。PDGF-BB主要由血小板、内皮细胞、巨噬细胞产生,平滑肌细胞和滋养层细胞也可以少量产生[11]。PDGF有AA、BB、CC、DD四种异构体及AB异二聚体。PDGF二聚体与靶细胞表面受体(PDGFR-α或PDGFR-β)结合发挥作用。因此PDGF的生物学效应取决于靶细胞表面PDGFR二聚体的表达水平[12]。其中PDGF-BB有较强的促细胞增殖和趋化作用,已有研究证明PDGF-BB可以激活PI3K信号通路参与细胞的增殖、迁移、血管生成等途径[13],PDGF-BB可通过刺激血管内皮细胞和平滑肌细胞有丝分裂、增殖与迁移,从而促进新生血管生成[14-15]。这些研究结果均揭示PDGF-BB对新生血管、肌肉形成有促进作用,本实验结果与其一致,但未研究PDGF-BB在牙髓损伤修复中的作用。本研究证实浓度0~100 ng/mL时,BMSCs的增殖、迁移及多向分化能力随PDGF-BB浓度增高而升高。在细胞荧光染色检测中初步判断在50 ng/mL PDGF-BB诱导下,BMSCs自噬水平较高,因此本研究在体内实验中选择50 ng/mL作为牙髓组织异位再生的诱导浓度。
自噬作为一种重要的细胞程序,在各个生物领域被广泛研究[16]。当细胞受到外界刺激,如药物,射线以及细菌感染等之后,细胞内自噬信号被激活,在胞质内形成双层膜自噬前体,自噬前体不断延伸,形成双层膜自噬体[5]。自噬体与溶酶体融合后形成自噬溶酶体,参与自噬流,吞噬降解细胞内的无作用的物质[17]。研究表明,自噬不仅发挥着细胞自我保护作用,也是一种细胞死亡程序[18]。
干细胞归巢是体内多种组织再生时存在的干细胞迁移和募集的现象[19],基于细胞归巢原理利用宿主体内干细胞进行组织再生,避免干细胞移植可能产生的问题,比细胞移植具备更多优势。本研究鉴于PDGF-BB能趋化宿主BMSCs迁移,通过细胞归巢,建立牙髓组织异位再生模型。本实验进行牙髓异位再生的位置位于大鼠皮下腹部,由于其远离大鼠颌骨根尖区,研究模型中能够迁移进入离体牙根管的间充质干细胞绝大多数为非牙源性细胞。使用的Collagen Type Ⅰ支架材料属于胶原凝胶类支架材料,其半固态半液态的特征利于材料均匀分布于整个根管系统,将大量内源性细胞通过物理性捕获效应固定于其中,再通过PDGF-BB的生物学效应,动员机体内源性间充质干细胞迁移进入根管内,调节这些细胞的增殖、迁移、分化和自噬水平,从而实现牙髓组织的异位再生。本研究获得的再生牙髓样组织在在形态和细胞结构上与天然人牙髓组织相似,自噬活性标志物免疫组织化学染色结果与天然人牙髓组织相近。
本研究基于体外实验筛选出的激活自噬的最佳浓度PDGF-BB联合Collagen Type Ⅰ,搭载BMSCs,建立牙髓组织异位再生模型,探究自噬在牙髓再生过程的表达水平是否与PDGF-BB相关,比较再生牙髓样组织和原代人牙髓组织中自噬相关蛋白ATG5、LC3的表达。鉴于自噬在细胞存活、迁移、分化和新生血管形成中的多方面作用,从基因与蛋白层面尝试初步探讨在通过BMSCs获得牙髓再生的过程中自噬的作用,推测自噬的调节促进干细胞归巢的应激适应和分化,促进牙髓修复再生过程。
ATG5参与自噬前体和自噬小泡的形成,ATG5-ATG12结合体作用于自噬前体形成和自噬泡的前后期[20-21]。LC3通常以两种形式存在;LC3Ⅰ 和LC3Ⅱ,LC3Ⅰ在胞质内弥散分布,LC3Ⅱ聚集于自噬体膜上[22-23],在自噬形成过程中,可溶性的LC3BⅠ转化成自噬囊泡转运相关的形式(LC3Ⅱ)[24],通过免疫荧光的方法检测内源性LC3蛋白的表达,自噬诱导后细胞表现为点状聚集增多,理论上可根据观察到点状聚集密集程度判断细胞自噬的情况,但本研究仅从总体上大致反映自噬的增加或减少,存在局限性。
本研究选用ATG5、LC3来检测异位再生的牙髓样组织中自噬的存在,而通过组织学染色比较以及统计分析显示在饲养生长2、4个月后PDGF-BB组的牙髓样组织中自噬相关蛋白的表达远高于对照组,再生牙髓样组织中自噬蛋白的表达与天然人牙髓组织相近。软件分析统计显示PDGF-BB组4个月后ATG5的表达高于对照组牙髓样组织,但略低于2个月,同时空白组4个月后ATG5的表达低于2个月。提示ATG5的数量在再生修复中某阶段其降解速度大于合成速度。本研究证明PDGF-BB能影响自噬,提示PDGF-BB与BMSCs自噬水平似乎在某一特定时间阶段呈正相关。由于自噬是一个随时间不断变化的动态过程,用静态的方法去研究动态的过程不可避免存在一定的局限和偏倚。本研究需进一步采取自噬抑制剂抑制来进一步说明自噬活性,揭示其在牙髓再生过程中的具体作用机制。
已有研究证实自噬相关指标自噬相关基因ATG和LC3在牙髓炎模型中呈时间依赖性增加[25]。在牙齿发育与修复方面,也有研究发现自噬在牙胚和成牙本质细胞层中有表达,而成牙本质细胞可形成牙本质[26],同时体外细胞实验证明自噬能够促进成牙本质细胞的矿化[27]。这些研究均提示自噬可能参与牙组织的再生与修复。本实验结果与以上研究结果一致,猜测自噬可能是通过对受损细胞器及蛋白质的吞噬产生细胞分化所需的能量,募集周围间充质干细胞,促进牙髓细胞的迁移与分化,从而促进牙髓再生[28]。
综上所述,本研究阐明了PDGF-BB可促进大鼠BMSCs的增殖、迁移、成神经成骨分化并影响自噬相关蛋白表达,体外实验表明50 ng/mL浓度的PDGF-BB为激活自噬的最佳浓度;体内研究证实,PDGF-BB介导的牙髓再生修复过程存在自噬现象。其中,自噬相关蛋白ATG5和LC3表达在时间上存在一定波动变化,提示了自噬过程与牙髓组织的修复再生过程具有一定的关联性。本实验研究仅为观察性研究,自噬活性与BMSCs多向分化之间的关联机制仍需要进一步深入探讨。
