骨髓间充质干细胞来源外泌体保护脓毒症相关急性肾损伤的体外研究
2022-06-09曹永梅尚嘉伟李颖川
金 翠,曹永梅,尚嘉伟,李颖川
(上海交通大学附属第六人民医院重症医学科,上海 200233)
脓毒症(sepsis)是全身感染性危重疾病,易并发急性肾损伤(acute kidney injury,AKI)。一旦脓毒症相关急性肾损伤(sepsis-induced acute kidney injury,SAKI)形成,患者预后差、病死率高。一项研究表明,临床中SAKI病死率高达70%,死亡率明显高于其他原因所致的AKI[1]。脓毒症诱发的脏器损伤并非由感染病原体直接引起,而是体内非特异性炎症反应系统紊乱,炎症因子调控和表达失常,进而引起脏器细胞病理性死亡[2]。
SAKI的形成与血液中内毒素和炎症介质增多直接损伤肾脏组织,或触发凝血和纤溶系统反应,使肾小球内形成血栓,阻塞肾脏微血管有关[3-4]。此外,发生脓毒症时,肾脏血管收缩反应增强使肾血流和肾小球滤过率下降[5]。同时,炎症刺激、缺血等因素使肾脏细胞代谢障碍,细胞死亡增加。樊恒等[6]研究结果表明,SAKI发生时,肾小管上皮细胞凋亡上调。
近年来,骨髓间充质干细胞来源外泌体(exoso-mes derived from bone mesenchymal stem cells,BMSCs-Exo)在延缓关节炎、调控软骨细胞再生、心肌细胞修复等方面进行了较为广泛的研究,且其修复作用的机制与抗细胞凋亡相关[7-10]。目前尚无研究探索BMSCs-Exo在SAKI中的作用及机制。本研究应用LPS处理HK-2细胞建立SAKI体外细胞模型,拟探究BMSCs-Exo对SAKI的作用。
1 材料与方法
1.1 细胞培养及处理
大鼠骨髓间充质干细胞BMSCs和人近端肾小管上皮细胞株HK-2(中国科学院细胞库),分别使用含10%胎牛血清(Gibco公司,10270-106)、1%青霉素/链霉素(Gibco公司,15140-122)的α-MEM(Servicebio公司,G4554)培养基和DMEM/F12(Servicebio公司,G4610)培养基,在37 ℃、5%的CO2中培养。2~3 d换液。将HK-2细胞分为3组:对照组(CON组)、脂多糖组(LPS组)和脂多糖+ 外泌体组(LPS+EXO组)。LPS和LPS+EXO组:待HK-2细胞融合至80%左右时,以100 μg/mL的LPS处理细胞24 h。其中LPS+EXO组在LPS处理后加入100 μg/mL外泌体处理24 h。本研究使用的BMSCs为P3~P5。
1.2 外泌体提取和鉴定
1.2.1 BMSCs-Exo提取 BMSCs融合至90%左右,收集条件培养基,按照以下方式依次进行离心:(1) 4 ℃,300×g,离心10 min,取上清液;(2) 4 ℃,3 000×g,离心10 min,取上清液;(3) 4 ℃,10 000×g,离心30 min,再次取上清液;(4) 将收集的上清液在0.22 μm滤器过滤后,收集过滤液;(5) 4 ℃,110 000×g,离心70 min后弃上清液,用磷酸盐缓冲液(phosphate buffered saline,PBS)重悬沉淀,即为外泌体,-80 ℃储存。利用BCA蛋白浓度测定试剂盒(Beyotime公司,P0012)对外泌体中蛋白浓度进行定量。
1.2.2 BMSCs-Exo鉴定 (1) 透射电子显微镜检测:取BMSCs-Exo滴入铜网表面,室温静置2~3 min,滤纸吸干,磷钨酸室温复染5 min,滤纸吸干复染液,置于透射电子显微镜下观察外泌体的大小和形态并照相。(2) 外泌体粒径检测:利用纳米颗粒跟踪分析系统和纳米颗粒跟踪分析软件来跟踪纳米颗粒的运动速率。(3) Western印迹法检测:分析外泌体CD9(Bioss公司,bs-2489R)、CD63(Affinity公司,AF5117)、CD81(Affinity公司,DF2306)和Calnexin(Affinity公司,AF5362)的表达情况。
1.3 HK-2细胞对BMSCs-Exo摄取情况观察
参照DiI(Beyotime公司,C1036)、DAPI(Servicebio公司,G1012)和phalloidin(Servicebio公司,G1028)染色试剂盒说明书,分别标记BMSCs-Exo、HK-2细胞核和细胞微丝骨架,在荧光显微镜下观察HK-2细胞对BMSCs-Exo的摄取情况。首先,将10 μmol/L DiI标记的BMSCs-Exo加入HK-2细胞孵育4 h。然后,加入phalloidin染色试剂,室温染色2 h,用PBS洗涤3次。最后,加入DAPI染色试剂,室温染色5 min,用PBS洗涤3次。染色结束后,在荧光显微镜下观察HK-2细胞对外泌体的摄取情况。
1.4 细胞实验和检测
1.4.1 CCK-8检测LPS处理后的HK-2细胞活力 细胞接种于96孔板,不同浓度(0、1、10、100、500 μg/mL)LPS(Sigma-Aldrich公司,L2880,EscherichiacoliO55:B5),每孔100 μL处理24 h后,每孔加入10 μL CCK-8(Dojindo公司,CK04)溶液,37 ℃孵育1~4 h,使用酶标仪检测450 nm处吸光度值(A450)。
1.4.2 Western印迹法 按照1∶1∶1∶100的比例混合蛋白酶抑制剂、蛋白磷酸酶抑制剂、PMSF和RIPA细胞裂解液(Solarbio公司,BC3710),提取HK-2细胞总蛋白。用BCA蛋白浓度测定试剂盒(Beyotime公司,P0012)测定蛋白浓度,取20 μg总蛋白经SDS-PAGE电泳分离,转移至PVDF膜上。快速封闭液室温封闭10 min,TBST清洗3次后,一抗(1∶1 000)4 ℃孵育过夜。TBST清洗3次后,二抗(1∶1 000)室温孵育2 h。TBST清洗3次后,使用ECL发光液(Epizyme公司,SQ202)进行曝光。
1.4.3 qRT-PCR PBS洗涤细胞3次,用EZ-press RNA Purification Kit(EZBioscience公司,B0004D)试剂盒提取总RNA。利用Color Reverse Trans-cription Kit(EZBioscience公司,A0010GQ)试剂盒将RNA样品反转录成cDNA。利用Light Cycler 480Ⅱ(Roche)实时荧光定量PCR系统,以cDNA为模版进行扩增。引物序列如下。TNF-α-F:5′-TGGCGT-GGAGCTGAGAGATAACC-3′,TNF-α-R:5′-CGA-TGCGGCTGATGGTGCGG-3′;IL-6-F:5′-CACTG-GTCTTTTGGAGTCTGAG-3′,IL-6-R:5′-GGACTT-TTGTACTCATCCGCAC-3′;IL-1β-F:5′-GCCAGT-GAAATGATGGCCTATC-3′,IL-1β-R:5′-AGGAG-CACTTCATCTGTCTAGG-3′;GAPDH-F:5′-ACAA-CTTTGGTATCGTGGAAGG-3′,GAPDH-R:5′-GCC-ATCACGCCACAGTTTC-3′。目标基因表达以GAPDH水平规范化,使用2-ΔΔCt方法计算。
1.4.4 AnnexinⅤ-FITC/PI流式细胞术 利用Annexin Ⅴ-FITC细胞凋亡检测试剂盒(Beyotime公司,C1062S)检测HK-2细胞凋亡率。标准步骤:消化细胞,1 000×g,离心5 min,弃上清液。用PBS轻轻重悬细胞并计数,取5~10万个重悬的细胞,1 000×g,离心5 min,弃上清液。加入195 μL Annexin V-FITC结合液轻轻重悬细胞,5 μL Annexin V-FITC混匀细胞,10 μLPI再次混匀细胞后,室温避光孵育15 min,上流式细胞仪进行细胞凋亡分析。
1.5 统计学处理
2 结 果
2.1 外泌体鉴定和摄取结果
透射电镜观察到提取物为具有单层膜结构的盘状囊泡,符合外泌体的形态学表现(图1A)。纳米颗粒跟踪分析显示提取物粒径大多为30~200 nm,与外泌体粒径范围一致(图1B)。Western印迹法进一步检测外泌体表面生物标志物CD9、CD63和CD81以及细胞内质网特异分子Calnexin的表达情况,结果显示:与对照组相比,BMSCs-Exo组CD9、CD63和CD81均高表达,而Calnexin几乎不表达(图1C),提示外泌体提取成功。从图1D可以看出,HK-2细胞(绿色)成功摄取BMSCs-Exo(红色)。
2.2 LPS诱导HK-2细胞活力下降
不同浓度LPS(0、1、10、100、500 μg/mL)处理细胞,24 h后检测细胞活力,结果显示:当LPS浓度为1、10 μg/mL时,细胞活力分别为对照组的99.90%、98.72%,较对照组差异无统计学意义(P>0.05);当浓度为100和500 μg/mL时,细胞活力分别为对照组的86.64%和60.84%,较对照组显著降低(P<0.05),结果见图2。根据此结果,选择100 μg/mL的LPS处理24 h进行后续实验。
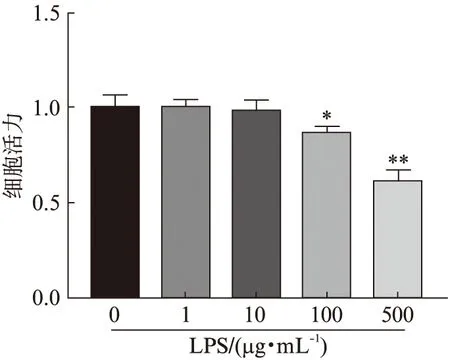
图2 不同浓度脂多糖对HK-2细胞活力影响Fig.2 HK-2 cells viability at different concentrations of LPS与LPS(0 μg/mL)组相比,*P<0.05;**P<0.01
2.3 BMSCs-Exo改善LPS诱导的HK-2细胞活性下降
先用LPS处理细胞24 h,再使用不同浓度外泌体(0、10、50、100、200 μg/mL)处理细胞24 h后检测细胞活力,结果显示:LPS引起细胞活性显著下降(P<0.01),当外泌体浓度为10 μg/mL时,对LPS诱导的细胞活性下降无明显影响,而当外泌体浓度为50、100和200 μg/mL时,外泌体显著改善LPS诱导的细胞活性下降(P<0.01),见图3。根据此结果并结合目前已报道的其他外泌体相关研究,本研究选择100 μg/mL的外泌体处理24 h进行后续实验。
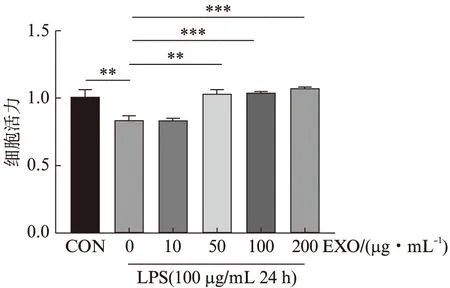
图3 外泌体改善脂多糖诱发的细胞活力下降Fig.3 Exosomes improve LPS-induced decreased HK-2 cells viability与CON组相比,**P<0.01;与EXO(0 μg/mL)组相比,**P<0.01;***P<0.001
2.4 BMSCs-Exo抑制LPS诱导的HK-2细胞炎症反应
qRT-PCR检测各组HK-2细胞中炎性指标TNF-α、IL-6、IL-1β mRNA表达水平,结果如图4所示:与对照组相比,LPS组细胞中TNF-α、IL-6、IL-1β mRNA水平显著增加(P<0.01),外泌体组与LPS组相比,这些炎性因子mRNA水平均显著下降(P<0.05)。进一步验证了在LPS作用下HK-2细胞中的炎性因子mRNA表达增多可能造成细胞受损,而外泌体可能通过减轻细胞炎症从而改善其功能。
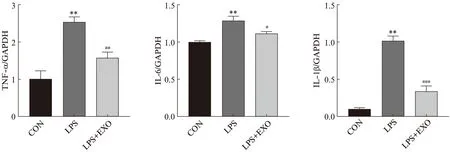
图4 外泌体逆转脂多糖诱发的HK-2细胞炎症反应Fig.4 Exosomes reverse LPS-induced HK-2 cells inflammatory response与CON组相比,**P<0.01;与LPS组相比,#P<0.05;##P<0.01;###P<0.001
2.5 BMSCs-Exo降低LPS诱导的HK-2细胞凋亡水平
分别收集LPS、LPS和外泌体处理的细胞,Annexin V-FITC和PI染色后,流式细胞仪检测凋亡细胞,以未经处理的细胞作为对照。Q1-UR(晚期凋亡)+Q1-LR(早期凋亡)百分比之和为细胞总凋亡率。研究结果如图5所示,LPS处理24 h后,HK-2凋亡细胞比例为10.76%,对照组为3.68%,LPS组凋亡率较对照组显著上升(P<0.01)。LPS+EXO组细胞凋亡率为8.18%,显著低于LPS组(P<0.05)。Western印迹法结果(图6)与流式结果一致,与对照组相比,LPS组凋亡蛋白cleaved-Caspase3和Bax表达显著增多,抗凋亡蛋白bcl2表达显著降低(P<0.05),而这一作用可以被外泌体逆转。说明外泌体对LPS诱导的HK-2细胞凋亡具有保护作用。

图5 外泌体对脂多糖诱发的HK-2细胞凋亡的影响Fig.5 The effect of exosomes on apoptosis of HK-2 cells induced by LPS与CON组相比,**P<0.01;与LPS组相比,#P<0.05
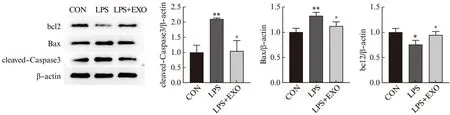
图6 外泌体逆转脂多糖对HK-2细胞凋亡相关蛋白表达的作用Fig.6 Exosomes reverse the effects of LPS on the expression of apoptosis-related proteins in HK-2 cells与CON组相比,*P<0.05;**P<0.01;与LPS组相比,#P<0.05
3 讨 论
脓毒症为重症监护室(intensive care unit,ICU)常见疾病,可诱发多器官功能障碍或衰竭严重影响患者预后,脓毒症相关急性肾损伤是脓毒症预后不佳的主要因素之一。脓毒症引起的急性肾损伤机制尚未完全阐述清楚,目前认为与以下几方面可能相关:肾脏血流动力学改变[11]、细胞因子和自由基对细胞损伤[12]、微粒与血管内皮细胞损伤[13]、肾小管上皮细胞能量代谢障碍[14]及SAKI中基因差异性表达等[15]。脓毒症发生时,血液中内毒素增多,内毒素脂多糖与脂多糖蛋白结合激发细胞炎性反应,炎性因子释放损伤肾小管上皮细胞。
应用LPS处理HK-2细胞来建立SAKI细胞模型被广泛报道,其不仅具有促炎性作用,而且可诱导细胞凋亡,但目前尚缺乏LPS处理浓度的标准,既往研究[16-18]应用的LPS处理浓度差异较大(1~100 μg/mL)。Shi等[16]和Xu等[17]应用LPS(1 μg/mL)处理HK-2细胞24 h,细胞活性下降,细胞炎性表达明显增高。Zhong等[18]应用LPS(1、5、10、25、50、100 μg/mL)处理HK-2细胞24 h,结果表明当LPS浓度为50~100 μg/mL时可使细胞活力明显下降,凋亡增加。不同研究应用的LPS浓度差异较大可能与HK-2细胞的培养条件以及细胞本身的状态相关,因此应用LPS处理HK-2细胞建立SAKI细胞模型时,建议采用需构建浓度梯度来确定最终的探索LPS处理浓度。本研究应用浓度梯度LPS(0、1、10、100、500 μg/mL)处理HK-2细胞,24 h后检测细胞活力,结果显示:当LPS浓度为1、10 μg/mL时,细胞活力分别为对照组的99.90%、98.72%,较对照组差异无统计学意义(P>0.05);而当浓度为100和500 μg/mL时,细胞活力分别为对照组的86.64%和60.84%,较对照组显著降低(P<0.05),此研究结果与Zhong等[18]研究结果一致,最终选择100 μg/mL的LPS建立SAKI细胞模型。
外泌体是细胞间通讯的一种方式,细胞通过分泌外泌体将其大量活性物质传递给靶细胞,从而影响靶细胞的生物功能,实现细胞间信号的传递[19-20]。外泌体的特性主要取决于其细胞来源[21-22],间充质干细胞是一类能够自我更新并具有多向分化潜能的细胞[23],存在于多种组织(如脐带、月经血、骨髓和脂肪组织等)[24]。与直接用间充质干细胞相比,使用细胞来源的外泌体可以降低免疫反应的发生以及异位移植的风险[25]。BMSCs具有强大的再生修复能力并且获取相对更加容易,因此BMSCs-Exo被广泛研究。目前尚无研究阐述BMSCs-Exo在SAKI中的作用,本研究结果显示,当BMSCs-Exo浓度为10 μg/mL时,其对LPS诱导的细胞活性下降无明显影响,而当BMSCs-Exo浓度为50、100和200 μg/mL时,其显著改善LPS诱导的细胞活性下降(P<0.01)。结合既往研究[26-28]报道的外泌体处理浓度和时间,本研究采取的外泌体处理方式为100 μg/mL处理24 h,以确保实验稳定性。本研究通过亲脂性荧光染料DiI标记BMSCs-Exo,同时分别使用DAPI和phalloidin荧光染料标记HK-2细胞核和微丝骨架,结果显示HK-2细胞成功摄取了BMSCs-Exo。
SAKI发生时肾小管细胞在炎性等损伤因素下促进了细胞凋亡。尽管SAKI发生时,肾小管上皮细胞凋亡水平上调被广泛认同,但其具体机制尚未阐述完全。有研究认为脓毒症时肾脏组织细胞凋亡与钙负载相关,SAKI时,细胞内钙离子浓度升高,钙依赖性核酸限制性内切酶活化,导致核基因裂解成180~200 bp的小片段,引起细胞凋亡[29]。本研究结果显示,LPS处理HK-2细胞后,细胞炎症和凋亡水平均升高。在炎症方面具体表现炎性因子(TNF-α、IL-6和IL-1β)mRNA水平显著上调;在凋亡方面表现为细胞凋亡率明显增高,凋亡蛋白cleaved-Caspase3和Bax表达上调,而抗凋亡蛋白bcl2表达下调。而BMSCs-Exo处理后,逆转了LPS对HK-2的作用。LPS可诱导HK-2细胞凋亡水平上调同样被其他研究证实,Zhu等[30]分别通过小鼠盲肠套扎和LPS处理HK-2细胞建立SAKI体内外模型,分析小鼠肾脏组织和HK-2细胞,发现SAKI体内外模型中凋亡水平均出现上调。同样,研究显示,BMSCs-Exo具有抗凋亡作用[31-32]。最近一项关于干细胞来源外泌体对急性肾损伤作用的Meta分析[33],共纳入31项研究,结果认为干细胞来源外泌体通过抑制细胞炎症反应和减轻细胞凋亡来改善急性肾损伤模型肾功能。然而,目前尚无研究探索BMSCs-Exo在SAKI中的作用及机制。
综上所述,本研究证实了BMSCs-Exo对LPS诱导的HK-2损伤具有抗炎和抗凋亡的保护作用,为SAKI的治疗提供一定的方向。但本研究具有如下不足:(1) 未深入研究BMSCs-Exo发挥保护作用的活性成分;(2) 未明确BMSCs-Exo发挥保护作用的信号通路;(3) 未进行体内实验验证。进一步研究可聚焦于明确BMSCs-Exo发挥作用的主要活性物质如miRNA及其作用的信号通路,同时建立体内和体外实验体系,以及进一步探索外泌体作用肾小管上皮细胞的其他机制如自噬等,以期探索应用BMSCs-Exo治疗SAKI的基础理论依据。
