五味子提取物对抑郁症大鼠海马神经元损伤的修复作用及其机制
2022-06-09刘美华王素荣刘平郝正燕
刘美华,王素荣,刘平,郝正燕
(1.菏泽医学专科学校附属医院老年医学科,山东菏泽 274000;2.菏泽医学专科学校附属医院药学科,山东菏泽 274000)
抑郁症是一种精神障碍性疾病,临床表现为情绪消沉、思维迟钝、语言行动减少等,快感缺乏、动力低下是其主要症状。随着生活节奏加快,竞争压力加大,抑郁症患病率迅速升高[1]。目前,临床上常用的抗抑郁症西药类,虽具有一定的改善效果,但同时存在耐药性及伴有多种不良反应等问题[2]。而五味子为补虚固本中药,具有收敛固涩、益气生津、宁心安神的功效,作为保健食品的原料被广泛应用于心悸失眠、津少口渴、体虚多汗等症的治疗[3]。有研究[4-6]表明,五味子及其提取物有镇静、催眠和抗焦虑作用。但有关五味子及其提取物更确切的抗抑郁作用机制仍不甚清楚。janus蛋白酪氨酸激酶(JAK)/信号传导及转录活化因子(STAT)信号通路参与多种细胞因子的信号转导活动,可调节神经元兴奋性突触功能,是引起长期抑郁的关键通路[7]。因此,本研究通过建立慢性不可预测轻度应激(chronic unpredictable mild stress,CUMS)抑郁大鼠模型,观察五味子提取物对抑郁症大鼠的治疗作用,并探讨其可能的作用机制,为五味子药物的开发和抑郁症的临床治疗提供理论依据。现将研究结果报道如下。
1 材料与方法
1.1 实验动物50只清洁级SD雄性大鼠,7~8周龄,体质量(200±10)g,购自上海杰思捷实验动物有限公司,生产许可证号:SCXK(沪)2018-0004。饲养环境:温度(22±2)℃,相对湿度为(65±5)%,光照周期12 h/12 h。购入后适应性饲养7 d。实验前旷场实验、蔗糖偏好实验结果均不存在明显差异。
1.2 药物、试剂与仪器五味子提取物(五味子总素≥25.0%,五味子乙素≥18.0%,五味子甲素≥6.3%,五味子酯甲+五味子醇甲+五味子醇乙≥0.7%),陕西瑞林帕尼尔生物科技有限公司生产,批号:190617。羧甲基纤维素钠(sodium carboxylmethyl cellulose,CMC-Na)(西安鸿朗生物科技有限公司);末端脱氧核苷酸转移酶介导的d UTP缺口末端标记(TUNEL)试剂盒(北京中杉试剂公司);兔抗大鼠JAK1单克隆抗体、磷酸化JAK1(p-JAK1)单克隆抗体、STAT3单克隆抗体、磷酸化STAT3(p-STAT3)单克隆抗体(美国Abcam公司);辣根过氧化物酶标记的山羊抗兔IgG(美国Abcam公司)。Lightcycler480 PCR仪(瑞士罗氏公司);微型电泳仪(美国Bio-Rad公司)。
1.3 造模与分组随机取40只大鼠单笼孤养,参照文献方法[8]并加以改进,建立CUMS抑郁大鼠模型。方法:大鼠接受不同应激刺激,包括4℃冰水游泳5 min、禁食禁水24 h、45℃热应激5 min、夹尾1 min、昼夜颠倒、湿垫料24 h、噪音1 h(1 500 Hz,92 dB)、摇晃(1次/s,15 min)等,每日接受1~2种,同种刺激不能连续2次出现,使大鼠不能预料刺激的发生,连续刺激21 d。若大鼠出现饮水减少、体质量减轻、毛色晦暗、探索行为减少等症状,则提示建模成功[9]。将造模成功的大鼠随机分为模型组,五味子提取物低、中、高剂量组,每组各10只。剩余10只大鼠按单笼2只混养,作为正常组,正常饲养,不给任何刺激。
1.4 给药方法从造模第1天开始,按照动物与人体间的等效剂量换算[10]并参照以往文献研究[11]用量,五味子提取物低、中、高剂量组分别以100、200、400 mg·kg-1·d-1剂量灌胃五味子提取物(溶解于0.5%CMC-Na),正常组和模型组灌胃等体积0.5%CMC-Na,每日1次,连续21 d。
1.5 观察指标与方法
1.5.1 旷场实验 造模结束2 h后,参照文献研究[12]将各组大鼠逐个置于旷场箱内,旷场箱大小为80 cm×80 cm×40 cm,箱底由25块16 cm×16 cm的正方形组成,内壁和箱底均涂为黑色,上方安装摄像头,实验前将大鼠置于旷场箱内适应10 min。实验开始后将大鼠置于旷场箱内,观察其活动情况并录像,每只大鼠记录5 min水平活动和垂直活动情况。水平活动得分以大鼠穿越箱底正方形块数计,跨一格计1分;垂直活动得分以大鼠前爪离地、后爪直立次数计,每次计1分。上只大鼠测试完毕后将粪便清理干净,用酒精清洁箱底后再测试下只大鼠。实验结束后,根据录像回放,记录每组大鼠活动得分。
1.5.2 蔗糖偏好实验 造模结束24 h后,每只大鼠孤笼饲养。根据文献研究[13]方法,实验前72 h训练大鼠适应含糖饮水,给予大鼠饮用质量分数为1%的蔗糖水。第1个24 h每笼放置2瓶质量分数为1%的蔗糖水,第2个24 h每笼放置1瓶质量分数为1%的蔗糖水和1瓶纯净水,2个水瓶外观相同,水瓶位置随机摆放,第3个24 h禁食禁水。之后每只大鼠同时给予1瓶质量分数为1%的蔗糖水和1瓶纯净水,放置前称质量定量,12 h后记录大鼠纯净水和蔗糖水消耗量。1%蔗糖水消耗率(%)=1%蔗糖水消耗量/1%蔗糖水消耗量+纯净水消耗量。
1.5.3 尼氏染色法 糖水消耗实验结束后,取右侧海马组织固定,进行低温冰冻切片,二甲苯脱脂,逆行浓度梯度乙醇脱脂,用蒸馏水冲洗2 min,尼氏染色液染色5 min,蒸馏水冲洗2 min,95%乙醇冲洗,梯度浓度乙醇脱水,二甲苯溶液透明,中性助教封片后,显微镜下观察海马神经元形态变化。
1.5.4 TUNEL染色法 海马组织切片后按照TUNEL试剂盒说明书进行染色:切片脱蜡,水化;蛋白酶K室温处理20 min;PBS漂洗3次后滴加TUNEL反应液,暗盒37℃反应1 h;PBS漂洗3次后滴加转化剂POD,37℃反应30 min;PBS漂洗3次,滴加DAB底物溶液,25℃反应10 min,PBS漂洗3次,常规封片镜检。每只大鼠选择3张海马CA3区切片,每张选择5个视野进行镜检,计算神经元凋亡百分率。神经元凋亡率(%)=凋亡神经元数/神经元总数×100%。
1.5.5 蛋白免疫印迹(Western Blot)法 取左侧海马组织80 mg,加入放射免疫沉淀分析(RIPA)裂解液,研磨后冰上裂解30 min,离心取上清;加热变性10 min,冷却后用二喹啉甲酸(BCA)法测蛋白浓度;配制凝胶,样品加入上样缓冲液混匀,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE),30 min后将蛋白冰上转至硝酸纤维素膜;转膜后TBST溶液漂洗10 min×3次,置于摇床室温封闭2 h;将膜分别放入JAK1(1∶1 000稀释)、p-JAK1(1∶1 000稀释)、STAT3(1∶1 000稀释)、p-STAT3(1∶1 000稀释)等一抗稀释液中摇床4℃孵育过夜;TBST溶液漂洗10 min×3次,将膜放入二抗稀释液(1∶2 000稀释)摇床室温孵育1 h;TBST溶液漂洗10 min×3次,加入电化学发光液(ECL),暗室显影、定影、扫描。目的蛋白相对表达量以目的蛋白条带灰度/内参β-actin条带灰度表示。
1.6 统计方法采用SPSS 25.0统计软件分析数据,计量资料以均数±标准差(±s)表示,多样本比较采用单因素方差分析,进一步两两样本比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠水平运动和垂直运动得分比较与正常组比较,模型组水平运动得分、垂直运动得分均降低(P<0.05);与模型组比较,五味子提取物低、中、高剂量组水平运动得分、垂直运动得分均升高(P<0.05);与五味子提取物低剂量组比较,五味子提取物中、高剂量组水平运动得分、垂直运动得分均升高,五味子提取物高剂量组水平运动得分、垂直运动得分高于中剂量组,差异均有统计学意义(P<0.05)。结果见表1。
2.2 各组大鼠1%蔗糖水消耗率比较正常组、模型组、五味子提取物低剂量组、五味子提取物中剂量组、五味子提取物高剂量组1%蔗糖水消耗率分别为(83.16±8.54)%、(52.67±6.01)%、(61.54±6.51)%、(68.26±7.53)%、(75.49±7.37)%。与正常组比较,模型组1%蔗糖水消耗率降低(P<0.05);与模型组比较,五味子提取物低、中、高剂量组1%蔗糖水消耗率均升高(P<0.05);与五味子提取物低剂量组比较,五味子提取物中、高剂量组1%蔗糖水消耗率均升高(P<0.05),且五味子提取物高剂量组1%蔗糖水消耗率高于中剂量组(P<0.05)。
表1 各组大鼠水平运动和垂直运动得分比较Table 1 Comparison of horizontalmovement and verticalmovement scores between various groups of rats(±s,分)
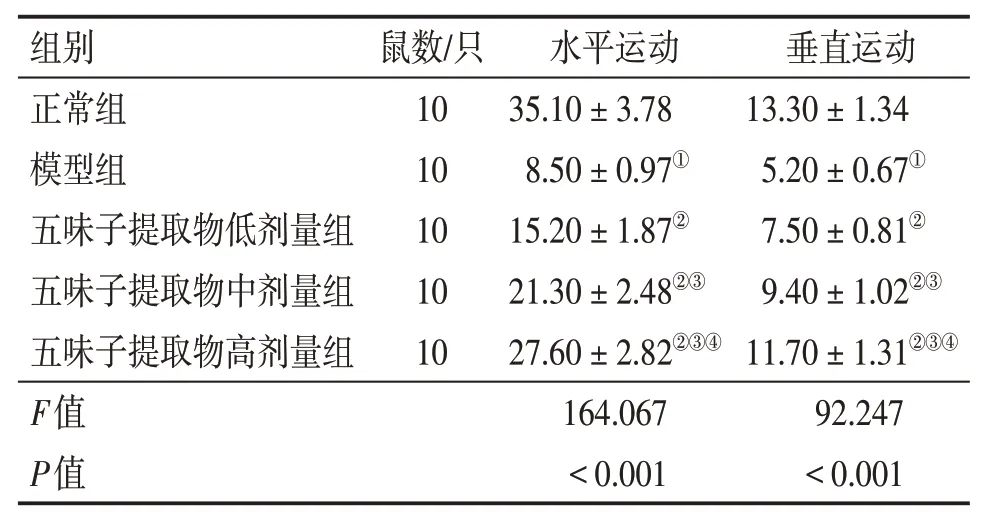
表1 各组大鼠水平运动和垂直运动得分比较Table 1 Comparison of horizontalmovement and verticalmovement scores between various groups of rats(±s,分)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与五味子提取物低剂量组比较;④P<0.05,与五味子提取物中剂量组比较
组别正常组模型组五味子提取物低剂量组五味子提取物中剂量组五味子提取物高剂量组F值P值鼠数/只10 10 10 10 10水平运动35.10±3.78 8.50±0.97①15.20±1.87②21.30±2.48②③27.60±2.82②③④164.067<0.001垂直运动13.30±1.34 5.20±0.67①7.50±0.81②9.40±1.02②③11.70±1.31②③④92.247<0.001
2.3 各组大鼠海马神经元形态变化比较正常组大鼠海马CA3区神经元排列整齐,形态正常,未见明显坏死;模型组海马CA3区神经元萎缩、排列紊乱稀疏,坏死神经元较多;五味子提取物各剂量组海马CA3区神经元形态较规则,坏死神经元较少,均较模型组有不同程度恢复。结果见图1。
2.4 各组大鼠海马神经元凋亡率比较正常组、模型组、五味子提取物低剂量组、五味子提取物中剂量组、五味子提取物高剂量组海马神经元凋亡率分别为(5.15±1.34)%、(43.68±3.47)%、(25.26±3.19)%、(15.21±2.77)%、(10.33±2.13)%。与正常组比较,模型组海马神经元凋亡率均升高(P<0.05);与模型组比较,五味子提取物低、中、高剂量组海马神经元凋亡率均降低(P<0.05);与五味子提取物低剂量组比较,五味子提取物中、高剂量组海马神经元凋亡率均降低(P<0.05),五味子提取物高剂量组海马神经元凋亡率低于中剂量组(P<0.05)。结果见图2。

图1 各组大鼠海马神经元形态变化比较(尼氏染色,×200)Figure 1 Comparison of morphologicalchanges of hippocampalneurons between various groups of rats(by Nissl’s staining,×200)

图2 各组大鼠海马CA3区神经元凋亡情况比较(TUNEL法,×200)Figure 2 Comparison of hippocampal CA3 neuronal apoptosis between various groups of rats(by TUNEL method,×200)
2.5 各组大鼠海马组织JAK1、p-JAK1、STAT3、p-STAT3蛋白表达比较海马组织p-JAK1、p-STAT3蛋白相对表达量组间比较,差异均有统计学意义(P<0.05);与正常组比较,模型组及五味子提取物低、中、高剂量组p-JAK1、p-STAT3蛋白相对表达量均降低(P<0.05);与模型组比较,五味子提取物低、中、高剂量组p-JAK1、p-STAT3蛋白相对表达量均升高(P<0.05);与五味子提取物低剂量组比较,五味子提取物中、高剂量组p-JAK1、p-STAT3蛋白相对表达量均升高,五味子提取物高剂量组p-JAK1、p-STAT3蛋白相对表达量高于五味子提取物中剂量组,差异均有统计学意义(P<0.05)。海马组织JAK1、STAT3蛋白相对表达量组间比较,差异无统计学意义(P>0.05)。结果见表2、图3。
3 讨论
抑郁症是一种心理障碍,表现为持续性的情绪低落,常伴有思维和行为的改变,病程迁延,多数患者有反复发作的倾向。而西药治疗抑郁症往往有一定的局限性,因此,深入研究抑郁症及其发病机制,寻找更可靠有效的治疗药物,提高患者的生活及生存质量,具有重要的实际意义。中药根据辨证施治治疗抑郁症有较好的疗效,且五味子镇静催眠、改善认知作用已被证实[4-6,14-15]。许方敏等[16]研究显示,使用五味子醇甲干预抑郁症小鼠,抑郁行为较正常组显著减轻。Yan等[17]研究发现,五味子对大鼠不可预见性应激刺激引起的抑郁行为和睡眠剥夺引起的焦虑行为有治疗作用。Li等[18]证实,五味子提取物对帕金森小鼠具有潜在的神经保护作用。
CUMS是制备抑郁动物模型的常见方法,本研究采用此法诱导大鼠抑郁症模型,通过模拟抑郁症患者日常生活中遇到的各种应激刺激,复制患者的异常行为,可以较好地评价药物的抗抑郁作用。旷场实验用于评定动物的自发活动与探索行为,水平运动反映大鼠的运动能力,垂直运动反映大鼠对周围新鲜环境的好奇性。蔗糖偏好实验用于评定动物对糖水偏好的敏感度,动物快感缺失则对糖水的偏好敏感度降低。海马神经元损伤与抑郁症发病机制有着密切关系。本研究结果显示,模型组大鼠处于抑郁状态,五味子提取物各剂量组水平运动得分、垂直运动得分、1%蔗糖水消耗率均显著上升,海马神经元形态较模型组有不同程度改善,海马神经元细胞凋亡率显著下降,提示五味子提取物有修复海马神经元损伤并抗抑郁的作用。
表2 各组大鼠海马组织JAK1、p-JAK1、STAT3、p-STAT3蛋白表达比较Table 2 Comparison of protein expression of JAK1,p-JAK1,STAT3 and p-STAT3 in hippocampal tissues between various groups of rats(±s)
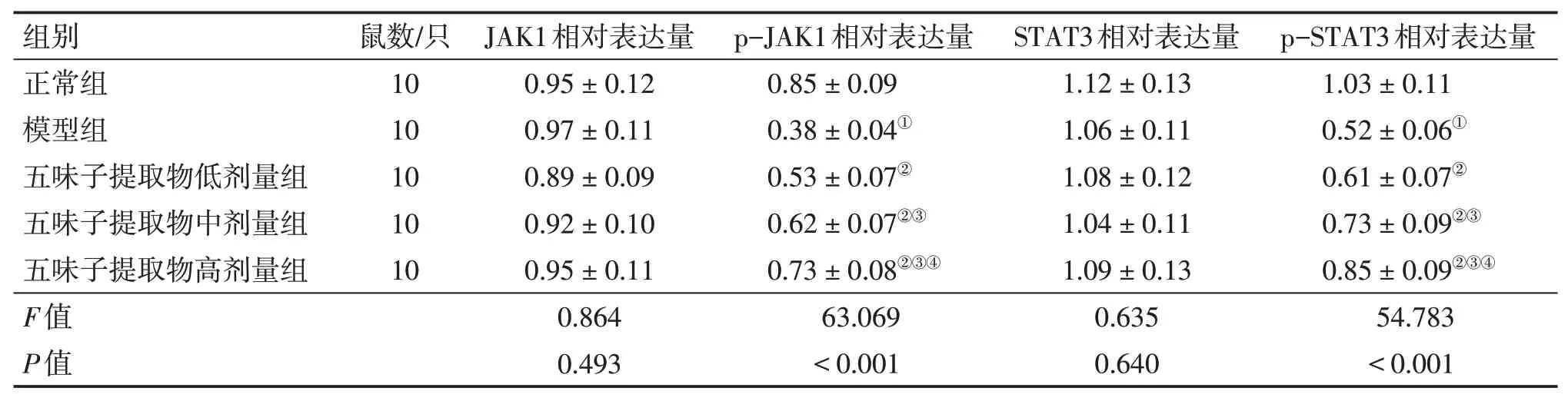
表2 各组大鼠海马组织JAK1、p-JAK1、STAT3、p-STAT3蛋白表达比较Table 2 Comparison of protein expression of JAK1,p-JAK1,STAT3 and p-STAT3 in hippocampal tissues between various groups of rats(±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与五味子提取物低剂量组比较;④P<0.05,与五味子提取物中剂量组比较
组别正常组模型组五味子提取物低剂量组五味子提取物中剂量组五味子提取物高剂量组F值P值鼠数/只10 10 10 10 10 JAK1相对表达量0.95±0.12 0.97±0.11 0.89±0.09 0.92±0.10 0.95±0.11 0.864 0.493 p-JAK1相对表达量0.85±0.09 0.38±0.04①0.53±0.07②0.62±0.07②③0.73±0.08②③④63.069<0.001 STAT3相对表达量1.12±0.13 1.06±0.11 1.08±0.12 1.04±0.11 1.09±0.13 0.635 0.640 p-STAT3相对表达量1.03±0.11 0.52±0.06①0.61±0.07②0.73±0.09②③0.85±0.09②③④54.783<0.001

图3 各组大鼠海马组织JAK1、p-JAK1、STAT3、p-STAT3蛋白Western Blot电泳条带灰度比较Figure 3 Comparison of the gray level of JAK1,p-JAK1,STAT3 and p-STAT3 proteins in hippocampaltissues between various groups of rats by Western Blot electrophoresis
JAK/STAT信号通路广泛存在于各种组织中,参与多种细胞因子的信号转导活动。JAKs属于非受体型酪氨酸蛋白激酶,STATs是JAKs的下游底物,STATs通过与磷酸化JAKs偶联活化,完成细胞外信号转导并启动核内基因转录,发挥生物学效应[19]。JAK1/STAT3是JAK/STAT信号通路中的一条重要途径,与神经元凋亡关系密切。细胞因子作用于JAK1,导致JAK1活化,激活下游STAT3,p-STAT3进入细胞核结合靶基因,可活化下游基因表达,调控神经元的增殖与凋亡[20]。既往研究显示,激活JAK1/STAT3通路可减少小鼠小胶质细胞和PC12神经细胞凋亡[21-22]。本研究结果显示,五味子提取物各剂量组p-JAK1、p-STAT3蛋白表达量较模型组显著升高,提示五味子提取物可能通过激活JAK1/STAT3信号通路发挥对海马神经元的保护作用。
综上所述,五味子提取物的抗抑郁作用机制,可能与激活JAK1/STAT3信号通路进而抗神经元凋亡有关。
