姬玉露组织培养繁育技术研究
2022-06-09华玲玲韦庆华李慧敏朱旭东王鹏凯
华玲玲,韦庆华,李慧敏,朱旭东,王鹏凯*
(苏州农业职业技术学院,江苏苏州 215008)
姬玉露的常规繁殖方式为种子繁殖和分株繁殖,这些繁殖方法的繁殖系数无法与组织培养繁育方法相比,生长周期长且育苗速度较慢,无法满足实际种苗生产的需要[3]。因此,采用植物组织培养方法可以较好地解决这些问题。组织培养繁育技术进行种苗生产性扩繁,具有培养周期短、扩繁效率高的优点,能够为姬玉露优质种苗的快速繁育提供有效途径。因此,建立高效的姬玉露组织培养繁育技术体系也越来越迫切。与姬玉露同属的康平寿[4]、毛玉露[5]、克里克特寿[6]、和白银寿[7]等多肉植物都已经进行了组织培养繁育技术体系研发[8-9],并有相关的报道。姬玉露作为新品种,也开发有相应的组织培养技术体系。为此,通过组织培养这种无性繁殖的方式,研究建立适用于姬玉露组培与快速繁育方法的技术体系,快速繁育优良姬玉露苗,以满足市场上的大量需求。
1 材料与方法
1.1 试验材料
组织培养起始外植体取材于苏州农业职业技术学院苏州市相城校区科技园。选择植株正常生长、叶片无病虫害且健壮的姬玉露植株所结种子消毒后长成的无菌苗作为外植体供体,取其叶片和叶芽作为外植体进行组织培养扩繁试验。
1.2 试验方法
1.2.1 外植体消毒。将姬玉露种子用自来水冲洗1~2h,再用清水浸泡30min,将剩余种子放入2%NaClO 溶液中灭菌10min,无菌水冲洗至少5 次后,置于无菌滤纸上吸干放在MS 基本培养基上。经过3 周的培养形成无菌苗作为外植体供体。
1.2.2 诱导培养。选用MS 为基础培养基,添加不同植物生长调节剂配制诱导培养基,将姬玉露无菌苗切除多余组织后,从基部切下叶片和芽作为外植体进行不定芽诱导培养。同时叶外植体采用平放、竖插以及去顶端平放的方式观察不同接种形式对不定芽诱导培养的影响。每20d 更换1 次培养基,保证培养环境稳定,养分充足。
1.2.3 增殖培养。将诱导培养过程中在愈伤组织上形成的不定芽,分别移植到不同的增殖培养基(表1)内进行进一步的增殖培养。增殖培养效果统计后转换为不定芽增殖率和增殖系数进行对比,以确定增殖培养基的效果。每20d 更换1 次培养基,保证培养环境稳定,养分充足。不定芽增殖率(%)=(发生不定芽增殖苗数/接种总数)×100;增殖系数=增殖完成后获得不定芽数/接种总数
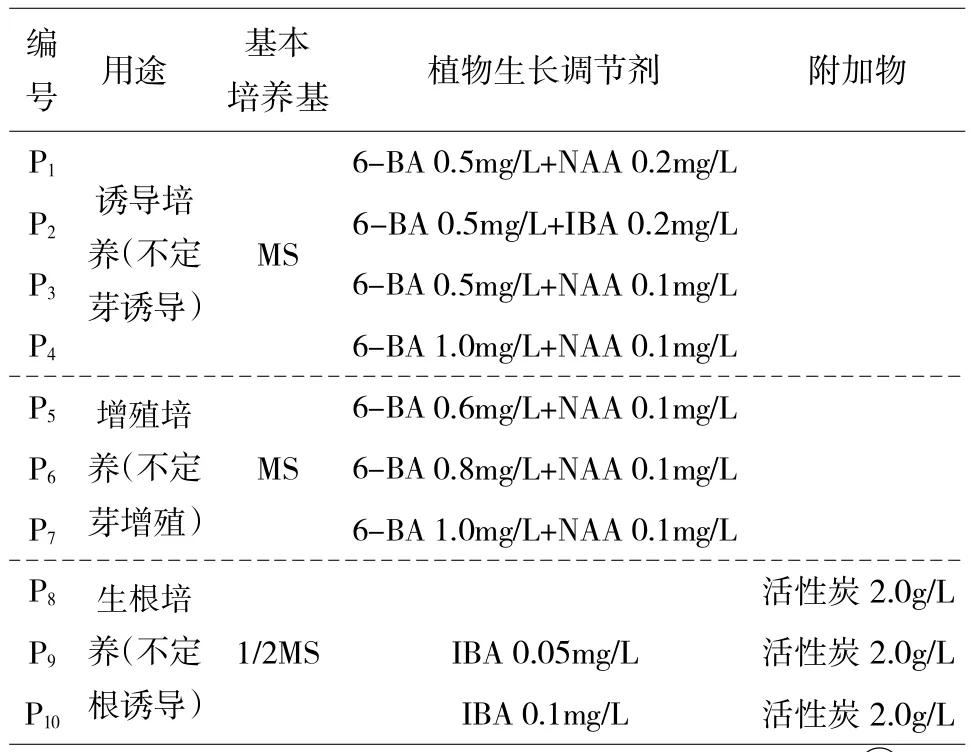
表1 组织培养研究使用培养基配方
1.2.4 生根诱导。将增殖培养获得的不定芽进行分离,分别转接到不同的生根培养基内(表1),进行生根培养,培养效果通过统计计算生根率。

1.2.5 驯化移栽。选择根系生长健壮的幼苗放入温室驯化1~2d,按60%湿度的标准拌土,将土平铺到穴盘中。再将培养基瓶口打开,取出幼苗,捏住幼苗顶部将根系放入多菌灵溶液中蘸2~3s,取出移植到穴盘中。
1.3 培养条件
组织培养温度[8-9]22℃(±2℃),湿度50%~60%,室内培养阶段光照强度为2000Lx;炼苗移栽阶段应选择空气流通、有散射光的培养环境,培养温度在15~28℃,空气湿度70%~90%,需要严格监控土壤水分,防止水分过多造成生长不良。
2 结果与分析
2.1 不同植物生长调节剂、浓度及接种方式对姬玉露不定芽诱导的影响
诱导培养10d 后,部分接种外植体的基部切割面边缘处开始分化,出现黄绿色的颗粒状疏松愈伤;此愈伤经过10d 的培养,继续膨大形成透明颗粒状愈伤组织(图4-A);更换1 次培养基后经过10d 的培养,愈伤组织继续生长,在其顶部出现圆形的隆起,随后在隆起部位的愈伤组织开始分化成不定芽(图4-B)。
试验结果显示,外植体摆放方式和外植体种类对不定芽形成存在影响。经过比较发现,以叶片作为外植体竖直插入培养基的培养效果最好,但是芽作为外植体的不定芽诱导效果明显优于竖直插入培养基的叶。因此,在外植体充足的情况下,可以直接选用芽作为外植体进行初代培养,如果材料较少,可以使用叶片作为外植体先扩大材料基数,再进行培养。但在培养过程中发现,叶片平放在培养基上虽然萌动较快,但是玻璃化现象[10]较为严重,可以用增加初代培养、继代培养次数来解决此问题。

图1 不同激素组合、浓度及接种方式对姬玉露不定芽形成的影响
本研究中使用的4 种诱导培养基(P1-P4,表1)中,除P4培养基(6-BA 1.0mg/L+NAA 0.1mg/L)外,其他3种培养基在以芽为外植体的诱导试验中均可以达到100%的诱导率。以叶片为外植体的诱导试验中,4 种培养基中P1(6-BA 0.5mg/L+NAA 0.2mg/L)的诱导率最高,在叶片竖直插入培养基的情况下可以达到76.5%。
2.2 不同植物生长调节剂添加量对姬玉露不定芽增殖的影响
将诱导培养基中得到的不定芽直接接种于增殖培养基中进行增殖培养,经过10d 的培养后芽基部继续膨大,形成叶片形态;再经过10d 的培养,会在叶片内部继续形成新的不定芽,并长出新叶片(图4-C)。试验结果显示,以诱导培养中形成的不定芽为外植体在P6培养基(6-BA 0.8mg/L+NAA 0.1mg/L)中的增殖率和增殖系数最高,可以达到90.5%和6.27,(图2)。试验过程中也尝试使用增殖培养基(P5-P7)直接对无菌芽进行诱导,发现玻璃化情况严重,无法形成正常的不定芽。
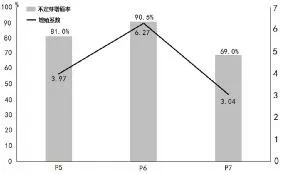
图2 不同植物生长调节剂添加量对姬玉露不定芽增殖效率的影响
2.3 姬玉露生根诱导培养中IBA 效果
将生长健壮的不定芽从增殖培养基接种到生根培养基中,经过10d 的生根培养,芽的基部生长出白色细长的根,长度约1.8cm。同时,在基部茎段位置也可以持续长出新的芽(图4-D)。经过20d 的生根培养,根系生长粗壮,可以形成正常完整的植株结构。经过MS(生根率72.4%)和1/2MS(生根率81.0%)对比试验结果可以看出,对于姬玉露而言,基本培养基选用1/2MS 更为适合生根诱导,附加的活性炭可使生根率在原有基础上增加10%。IBA 在0~0.1mg/L 的范围内,随着IBA 用量的增加,出现了生根率降低的结果(图3)。因此,姬玉露诱导生根可以不添加激素。

图3 IBA 使用对姬玉露诱导生根的影响

图4 姬玉露组织培养生长过程
2.4 多芽和单芽组培苗炼苗移栽的影响
将生根的组培苗按多芽和单芽分别进行炼苗移栽培养1 周后,2 种组培苗都能适应新环境并生长,但1 周后多芽组培苗的生长状态明显好于单芽组培苗,2 周后单芽组培苗约30%出现萎缩发黄现象。
3 结论与讨论
诱导培养过程中姬玉露叶片不同的接种方式(包括平放、竖放、去端平放)结果显示出竖放最佳,其次平放,去端平放为最差。而以芽作为外植体诱导成功率明显好于叶片。因此,在姬玉露组织培养扩繁过程中,外植体充足的情况下可以直接选用芽作为外植体进行初代培养,如果材料较少,可以使用叶片作为外植体先扩大材料基数,再进行培养。通过观察植物生长调节素的不同浓度发现,以芽作为外植体对激素浓度变化并不敏感,但以叶为外植体,则对激素浓度和激素种类变化会在诱导率上形成差别。因此,姬玉露叶片初代培养基以MS+0.5mg/L 6-BA+0.1mg/L NAA+5g/L 琼脂+30g/L蔗糖为宜。
姬玉露不定芽增殖过程中,6-BA 在0.6~1.0mg/L范围内都可以使不定芽进行增殖,最终结果显示,在添加0.8mg/L 6-BA 和0.1mg/L NAA 的增殖培养基中,丛生芽数量较多,增殖系数可达6 以上。同时,培养结束时,在6-BA 浓度最高的培养基中增殖效率最低,且出现了明显的玻璃化现象。同时,试验结果发现,增殖培养基无法直接用于不定芽诱导,玻璃化情况严重,无法形成正常的不定芽。这说明姬玉露对细胞分裂素浓度比较敏感,后期可以在细胞分裂素种类和用量上进行进一步的优化,争取将不定芽诱导和增殖培养步骤合并,简化培养步骤。
生根诱导培养基为1/2MS+2g/L 活性炭,不添加任何植物生长调节剂。培养材料接种后经20d 培养后可以形成根系,生根率为81.0%。比较培养结果后还发现,活性炭用量的增加虽然不会影响生根率,但会增加根系形成的时间,如在只添加5g/L 活性炭的培养基中,叶片外植体经过30d 的培养才能形成根系。值得注意的是,培养材料在不加IBA 的培养基中生根率最高,相比于原有加激素的情况,可进一步降低生产成本。
姬玉露炼苗移栽过程中,应选用疏松透气、排水良好、不易结块的基质,试验中以草炭土︰蛭石︰珍珠岩为3︰2︰1 的基质作为培养基质。光照过强、湿度过大、大棚内温度过高等多种因素,都会导致驯化移栽后组培苗出现萎缩发黄现象。移栽试验结果还发现,单芽较多芽组胚苗更为脆弱,可作为后期工厂化生产的质控依据。多肉植物栽培本身就要求严格控制环境条件[11],必须在通风良好、有散射光,温度在15~28℃的环境下生长,不可曝晒,也不可没有光照。同时,不宜过分浇水,无光和过度湿润的环境下都会导致姬玉露徒长;若是徒长,可通过砍头等方式进行处理。刚移栽或者生长情况较差的植株不用施肥,等植株生长较为健壮之后,每月可对其施肥1 次,从而确保姬玉露的健康生长。姬玉露组织培养研究有利于其市场推广,也为后期品种选育提供技术支撑。
