电子供体对向日葵秸秆厌氧发酵产酸和微生物群落结构的影响
2022-06-09封丽梅林淼姜茂成程秀花吉慧敏
封丽梅 林淼 姜茂成 程秀花 吉慧敏

摘要:为探究电子供体对瘤胃微生物发酵向日葵秸秆产C2~C6脂肪酸的影响,采用体外连续传代和高通量测序技术,比较添加乙醇或乳酸对脂肪酸产量及细菌和真菌群落结构的影响。结果表明,添加乙醇和乳酸显著提高了总C2~C6脂肪酸的产量,乙醇提高了乙酸、戊酸和己酸产量,乳酸提高了丙酸、丁酸、戊酸和己酸产量。与对照组相比,乙醇组的拟杆菌门相对丰度下降,而变形菌门相对丰度上升;乳酸组的变形菌门相对丰度下降,而放线菌门相对丰度上升。添加乙醇或乳酸对相对丰度前5的真菌菌门无显著影响。添加2种电子供体都显著改变了细菌和真菌的群落结构。添加乙醇显著提高萨特氏菌属、解琥珀酸菌属和脱硫弧菌属的相对丰度,添加乳酸显著提高巨型球菌属、Shuttleworthia、互营球菌属、光冈菌属、未定义的普雷沃氏菌的相对丰度。在种水平上,普雷沃氏菌、亨氏丁酸弧菌、埃氏巨型球菌与丁酸、戊酸产量呈显著相关。
关键词:乙醇;乳酸;瘤胃微生物;向日葵秸秆;C2~C6脂肪酸
中图分类号:X712 文献标志码: A
文章编号:1002-1302(2022)09-0247-06
我國是农业大国,主要农作物秸秆产生量为9.84亿t,可收集量达8.24亿t,占全球秸秆总产量的20%左右[1]。2019年全球向日葵总种植面积约为2 590万hm2,大部分地区在向日葵收获后采用焚烧的方式处理,不仅污染环境,也浪费能源[2-5]。农作物秸秆含有很高的纤维性碳水化合物,对其进行有效的降解利用和转化已成为研究的热点,而生物质的资源化和能源化利用对能源发展和环境保护具有重要的价值和意义。目前生物法降解废弃物,主要有酶处理法和微生物处理法,用于生产甲烷、乙醇和挥发性脂肪酸[6-8]。因具有反应条件温和、污染小的特点,具有巨大的应用潜力[9-10]。
向日葵秸秆作为丰富的木质纤维素资源,可以发酵生产燃料乙醇,也可直接饲喂反刍动物[11-12]。瘤胃微生物栖息在反刍动物瘤胃中,是分解利用纤维类物质效率最高的天然微生态体系[13]。瘤胃微生物可实现厌氧发酵秸秆,获得甲烷和挥发性脂肪酸,这在新型高值化利用方面也具有深度挖掘的价值[14]。厌氧发酵产生的挥发性脂肪酸主要通过水解和产酸步骤形成,其中,戊酸和己酸是乙酸、丙酸和丁酸进一步合成的产物,并且可提供更多能量[15-16]。利用乙醇或乳酸作为电子供体,在特定微生物的作用下进行脂肪酸β氧化的逆循环实现短链脂肪酸碳链延长,提高戊酸和己酸的产量[17-18]。相关研究表明,乙醇有助于奶牛瘤胃细菌发酵纤维类底物产生更多的乙酸和己酸,该类电子供体具备帮助细菌利用有机废弃物生产己酸的潜力[19-20]。目前,对向日葵秸秆厌氧发酵生产C2~C6脂肪酸的能力和主要的微生物群落少有报道。
本试验研究瘤胃液与向日葵秸秆共培养利用乙醇或乳酸的C2~C6脂肪酸产量的变化,阐明微生物群落结构特征,揭示瘤胃发酵向日葵秸秆的产酸特点,同时为向日葵秸秆的有效利用提供参考依据。
1 材料与方法
1.1 试验材料
向日葵秸秆于2020年11月取自扬州大学试验牧场。风干处理后的向日葵秸秆(65 ℃,干燥 48 h),再粉碎过40目标准筛,放入样本瓶中保存备用。发酵液取自干奶期荷斯坦奶牛的瘤胃,瘤胃液经采集和过滤后,立刻于39 ℃水浴带回实验室。
1.2 厌氧发酵
矿物盐培养缓冲液:1.10 mg/L CaCl 2·2H 2O,0.83 mg/L MnCl 2·4H 2O,0.08 mg/L CoCl 2·6H 2O,0.67 mg/L FeCl 3·6H 2O,5.83 mg/L NaHCO 3,0.95 mg/L Na 2HPO 4,1.03 mg/L KH 2PO 4,0.10 mg/L MgSO 4·7H 2O。在矿物盐缓冲液中加入体积分数0.1%的刃天青,搅拌并持续通入CO 2(纯度:99.9%以上)约3 h (pH值6.8±0.1)后密封备用。
称取0.16 g向日葵秸秆于150 mL干燥厌氧培养瓶中,加入矿物盐培养缓冲液15 mL,硫化钠溶液(浓度2.5%)0.15 mL和瘤胃液2 mL,胶塞密封。将培养瓶放于39 ℃培养箱静置发酵72 h。每3 d将2 mL混合发酵液取出,接种到含相同底物和新鲜矿物盐缓冲液的新培养瓶中,其他操作同上,共培养8代。以不加乙醇和乳酸为对照组,试验组加乙醇或乳酸(0.2 mL),每组4个平行。
1.3 pH值和C2~C6脂肪酸测定
收集第8代的发酵混合液,测定发酵液pH值(PB-21 型pH计,Sartorius)。脂肪酸测定参照Lin等的方法[21]:取2 mL发酵液,离心(12 000 r/min,20 min)后,取上清液1 mL,加入0.2 mL的偏磷酸(浓度25%,含60 mmol/L巴豆酸),-20 ℃保存,测定前取出解冻后离心(转速和时间同前),过滤上清液(0.22 μm水相滤膜),上机测定C2~C6脂肪酸的含量。气相色谱条件:毛细柱(Agilent J & W Advanced Capillary GC columns,30 m×0.32 mm×0.25 μm),柱温100 ℃,FID检测器,检测器温度 200 ℃,载气为氮气,进样量1.0 μL。
1.4 微生物群落分析
用EDTA缓冲溶液(10 mmol/L EDTA,0.15 mol/L NaCl,100 mmol/L tris/HCl,pH值8.0)30 mL将固液混合发酵液洗涤至搅拌杯中,均质 2 min,经无菌纱布过滤入离心管,离心(12 000 r/min,30 min),弃上清,用1 mL提取缓冲液复悬沉淀,送北京诺禾致源生物技术有限公司测序分析。细菌和真菌的扩增引物分别为16S V4区的515F和806R、ITS 5-1737F和ITS 2-2043R。菌群结构分析参照Lin等的方法[21]:将一致性>97%的序列聚类为OTUs,从标准化OTUs (operational taxonomic units)数据中计算微生物群落结构,对相对丰度与C2~C6脂肪酸产量进行Spearman 相关分析。
1.5 统计方法
用单因素ANOVA进行差异显著性分析,用Tukeys法进行两两比較(SPSS 18.0)。当方差齐性检验显著时,用非参数检验重新分析数据在3组间的差异显著性。表格内的数据以“平均值±标准差”表示。
2 结果与分析
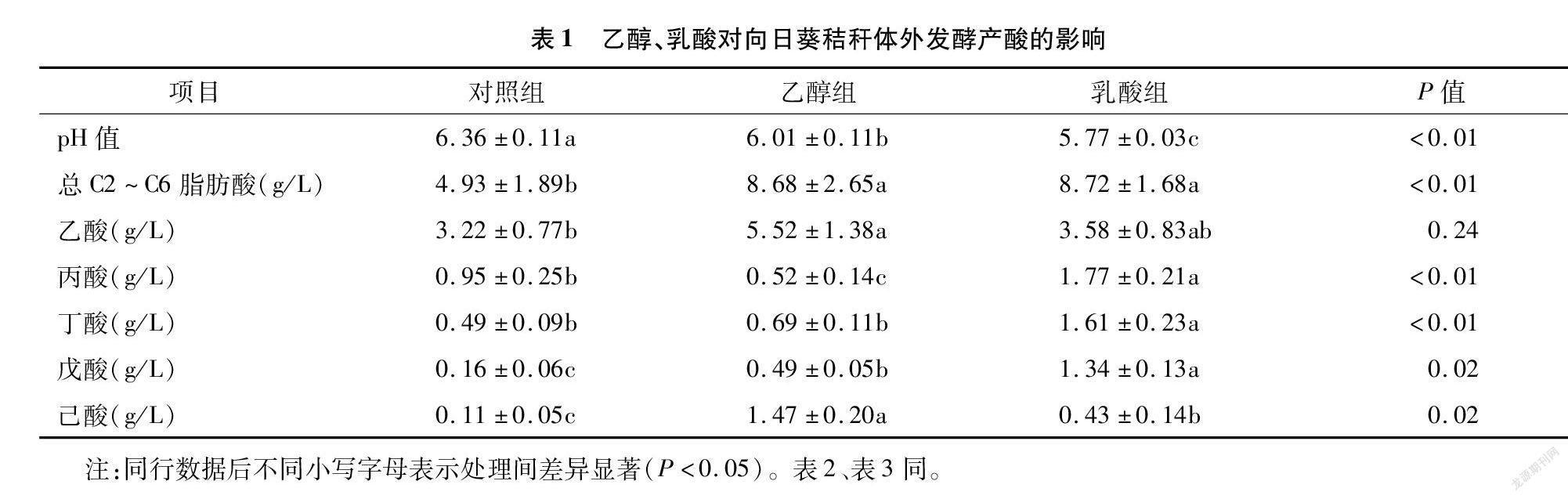
2.1 不同处理pH值和产酸比较
由表1可知,与对照组相比,添加乙醇和乳酸作为电子供体显著降低pH值,并且乳酸组pH值最低。添加乙醇和乳酸显著提高了总酸的产量,与对照组相比,乙醇和乳酸产量分别提高了76.1%和76.9%。对单一脂肪酸分析结果表明,添加乙醇显著提高了乙酸、戊酸和己酸含量,分别提高了71.4%、206.3%和1 236.4%。添加乳酸显著提高丙酸、丁酸、戊酸和己酸产量,分别提高了86.3%、228.6%,737.5%和290.9%。乙醇组乙酸和己酸产量最高,乳酸组丙酸、丁酸和戊酸产量最高。
2.2 不同处理多样性分析
由表2可知,与对照组相比,乙醇组细菌和真菌的Chao1(丰富度)指数和Shannon(多样性)指数显著降低,细菌Shannon指数和Chao1指数分别下降了15.4%和24.6%,真菌Shannon指数和Chao1指数分别下降了16.3%和30.4%。与对照组相比,乳酸组与乙醇组相似,细菌Shannon指数和Chao1指数分别下降了25.4%和46.3%,真菌Shannon指数和Chao1指数分别下降了27.5%和47.6%。乳酸对瘤胃细菌和真菌的丰富度和多样性影响大于乙醇。
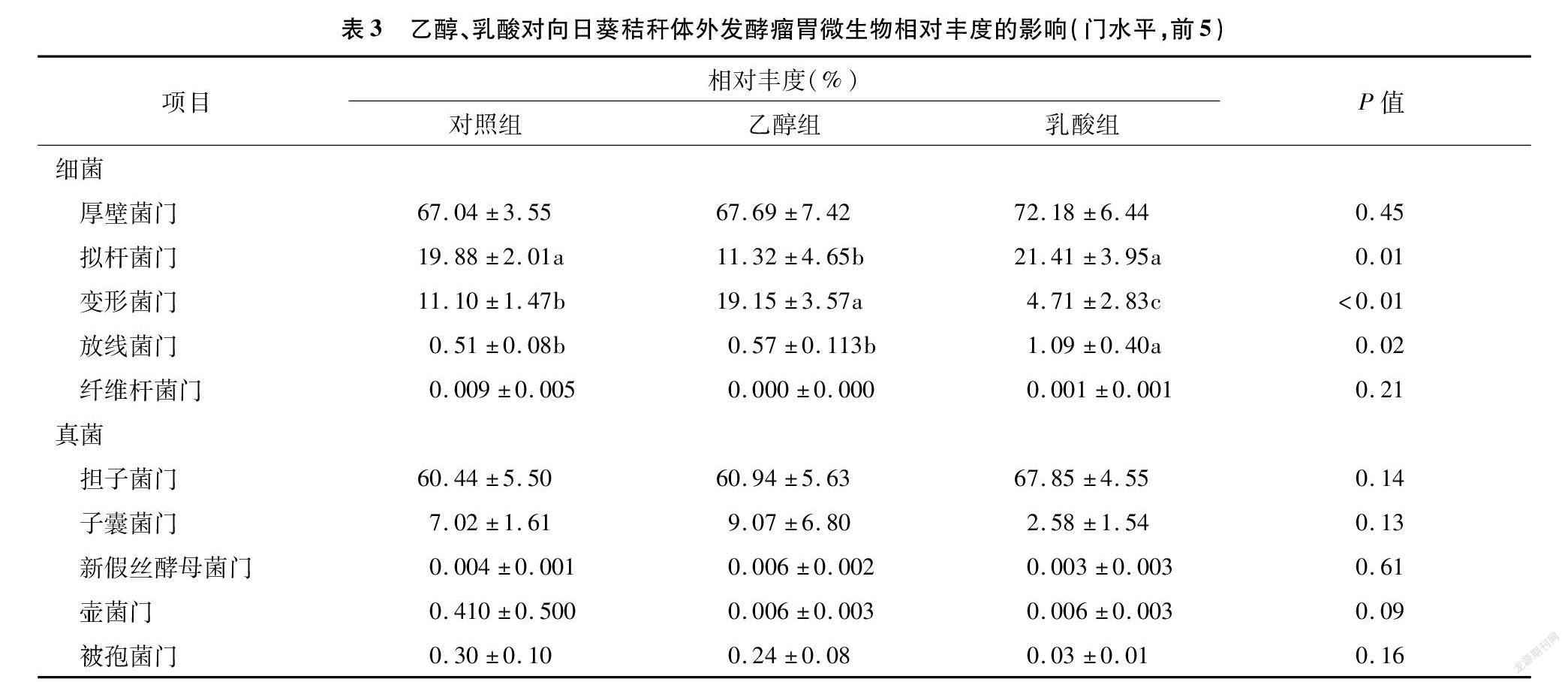
2.3 不同处理相对丰度和相关性分析
门水平上相对丰度的比较分析见表3。对照组和电子供体添加组的厚壁菌门、拟杆菌门和变形菌门的相对丰度总和均>95%,且厚壁菌门>拟杆菌门>变形菌门。与对照组相比,添加乙醇显著降低拟杆菌门的相对丰度,降低43.1%;显著提高变形菌门的相对丰度,提高72.5%。添加乳酸显著降低变形菌门的相对丰度,降低57.6%;显著提高放线菌门的相对丰度,提高113.7%。
对照组和电子供体添加组的担子菌门和子囊菌门的相对丰度总和均>67%,是主要的优势菌门,担子菌门的相对丰度>子囊菌门。与对照组相比,添加乙醇或乳酸对相对丰度前5的真菌门无显著影响。
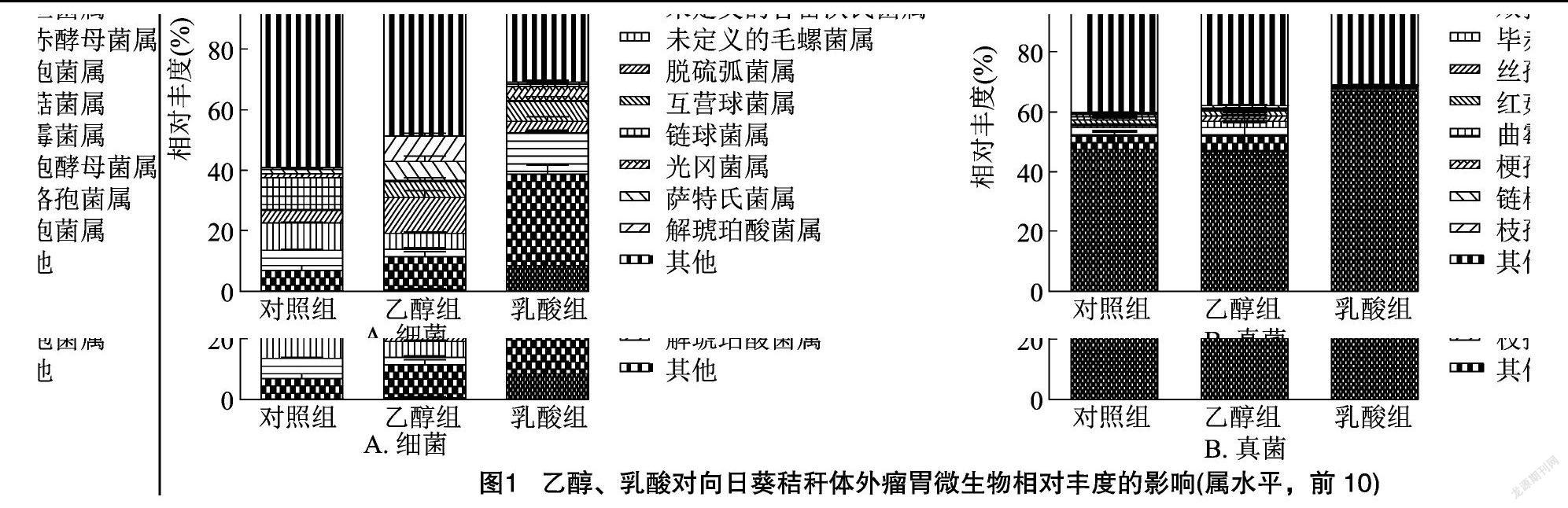
属水平上各组细菌和真菌相对丰度的差异见图1。从图1-A可知,与对照组相比,添加乙醇显著提高脱硫弧菌属、萨特氏菌属和解琥珀酸菌属的相对丰度,分别提高191.0%、294.4%和 1 157.6%;添加乳酸显著提高巨型球菌属、Shuttleworthia、互营球菌属、光冈菌属、未定义的普雷沃氏菌的相对丰度,分别提高7 700%、345.3%、1 968.2%、281.0%和101.4%。由图1-B可知,在属水平上,与对照组相比,添加乙醇显著提高丝孢菌属和毕赤酵母菌属的相对丰度,分别提高403.1%和236.6%。添加乳酸显著提高节担菌属的相对丰度,提高40.5%。
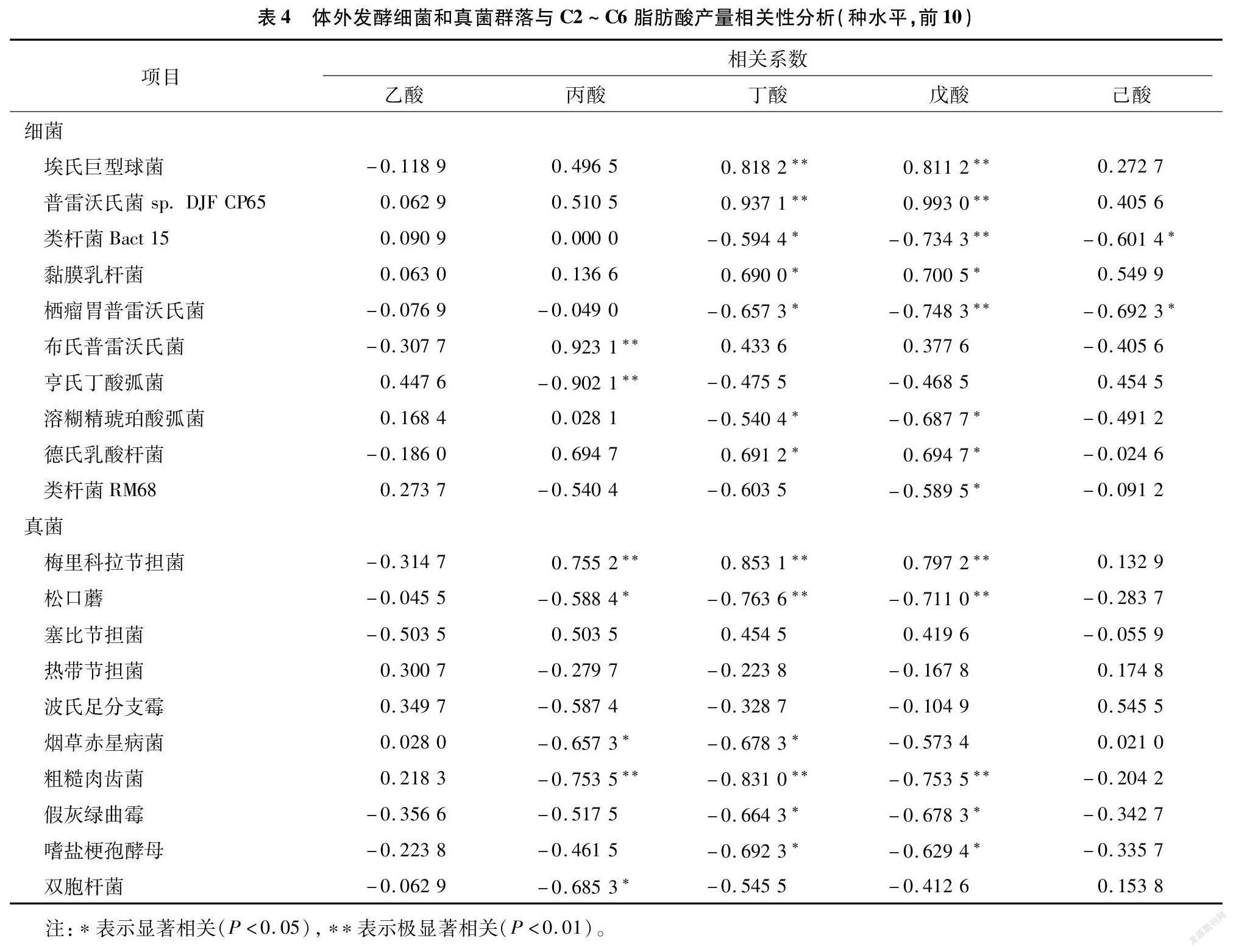
在种水平上,挑选r2≥0.8的数据分析,从表4可以看出,在菌相对丰度与产酸量之间,布氏普雷沃氏菌与丙酸呈显著正相关,而亨氏丁酸弧菌与丙酸呈极显著负相关。埃氏巨型球菌和普雷沃氏菌 sp. DJF CP65与丁酸和戊酸呈极显著正相关。梅里科拉节担与丁酸和戊酸呈极显著正相关,粗糙肉齿菌与丁酸呈极显著负相关。
3 讨论与结论
瘤胃发酵有机物产生的有机酸增多会导致pH值降低。本研究中,瘤胃发酵在乙醇和乳酸都提高了体外总脂肪酸的产量,同时降低了pH值,说明pH值的下降可能是由于有机酸产量增加导致,同时推测由于乙醇和乳酸作为电子供体在降解纤维为有机酸中提供了底物,使发酵纤维更彻底。3组的发酵液pH值为5.77~6.36,其中乳酸组最低。瘤胃液pH值若长时间低于5.6会导致革兰氏阴性菌的死亡[22],本试验乳酸组的细菌和真菌的丰富度和多样性均最低,推测原因是低pH值杀死了不耐酸的微生物。传统的戊酸从甘油中获得,己酸从椰子油中获得,但得率很低。厌氧发酵有机废弃物可以增加己酸的产量[20],添加乙醇可有效促进高纤维底物中己酸的产量[8,19]。Chwialkowska等比较乙醇或乳酸对乳清厌氧发酵的产酸效果差异发现,乳酸更能提高戊酸的产量[23]。本试验同样发现戊酸和己酸产量随着添加乙醇或乳酸而升高,说明乙醇和乳酸在向日葵秸秆与瘤胃液共培养生产高附加值化学品中具有潜力。
埃氏巨型球菌是瘤胃的固有细菌,在研究奶牛乳脂降低中被认为可利用乳酸[24]。相关报道,该菌可利用葡萄糖和乳酸生产丁酸、戊酸和己酸[20,25]。Weimer等认为,该菌对葡萄糖的利用率低,且不具有工业化合成己酸的潜力[26]。Kim等认为,该菌可以转化葡萄糖获得高浓度己酸[27]。本研究中,乙醇促进了戊酸和己酸的产生,乳酸促进了丙酸、丁酸、戊酸和己酸的产生,并且埃氏巨型球菌相对丰度与丁酸、戊酸产量呈极显著正相关,推测该菌与存在乙醇或乳酸的厌氧发酵向日葵秸秆时的产物可能是丁酸和戊酸。普雷沃氏菌属于拟杆菌门,在瘤胃中分布广泛,数量多,包括半纤维素分解菌和蛋白分解菌,降解蛋白质的产物是氨基酸和氨,降解碳水化合物的产物是丙酮酸和挥发性脂肪酸[28]。因此,普雷沃氏菌可增加瘤胃内乙酸和丁酸的比例[29]。本研究中,布氏普雷沃氏菌相对丰度与丙酸产量呈极显著正相关,普雷沃氏菌 sp. DJF CP65相对丰度与丁酸和戊酸产量呈极显著正相关,说明该菌能够在产丙酸、丁酸和戊酸中发挥作用。Yang 等报道在含乙醇的污泥厌氧发酵液中,脱硫弧菌属是优势菌属,稻秸瘤胃发酵液中添加乙醇也提高了脱硫弧菌属的相对丰度[8,30],本试验结果与这些结论相似,说明脱硫弧菌属在利用乙醇作为碳源代谢产己酸过程中有潜在作用。
瘤胃厌氧真菌可以在木质纤维素底物降解过程中分泌一系列的粗纤维降解酶,从而达到预处理底物并释放可溶性糖的作用,尤其与甲烷菌共培养后,其粗纤维降解能力增强[31]。梅里科拉节担菌属于担子菌亚门,目前对该菌的研究较少。Sun等认为,该菌具有独特的系统发育地位以及对环境的适应性很强[32]。Skalskid等在小鼠和人的疾病模型研究中发现,该菌具有耐药性且可能加剧肠道菌群结构变化并加重病情[33]。本研究中,梅里科拉节担菌相对丰度与丁酸和戊酸产量呈显著正相关。表明该菌在瘤胃体外发酵产酸中有潜在作用,但是否能作为发酵产酸菌有待进一步研究。
本试验结果表明,在向日葵秸秆的瘤胃体外发酵体系中,添加乙醇或乳酸显著提高C2~C6总酸的产量。乙醇組己酸产量最高,乳酸组戊酸产量最高,二者对瘤胃细菌的影响大于真菌。埃氏巨型球菌属、普雷沃氏菌属、脱硫弧菌属和梅里科拉节担真菌在本试验培养体系中实现碳链衍生发酵产酸中有潜在作用。
参考文献:
[1]石祖梁,王 飞,王久臣,等. 我国农作物秸秆资源利用特征、技术模式及发展建议[J]. 中国农业科技导报,2019,21(5):8-16.
[2]Sharma R. Agricultural straw burning and its impact on the environment[J]. International Journal of Environment Research,2021,3(7):26-31.
[3]Kumar D,Singh B,Korstad J. Utilization of lignocellulosic biomass by oleaginous yeast and bacteria for production of biodiesel and renewable diesel[J]. Renewable and Sustainable Energy Reviews,2017,73:654-671.
[4]Tsui T H,Wong J W C. A critical review:emerging bioeconomy and waste-to-energy technologies for sustainable municipal solid waste management[J]. Waste Disposal & Sustainable Energy,2019(3):151-167.
[5]Sherif N,Gadalla M,Kamel D. Acid-hydrolysed furfural production from rice straw bio-waste:process synthesis,simulation,and optimisation[J]. South African Journal of Chemical Engineering,2021,38:34-40.
[6]Poszytek K,Ciezkowska M,Sklodowska A,et al. Microbial consortium with high cellulolytic activity (MCHCA) for enhanced biogas production[J]. Frontiers in Microbiology,2016,7:324.
[7]Safaripour M,Ghanbari A,Seyedabadi E,et al. Investigation of environmental impacts of bioethanol production from wheat straw in Kermanshah,Iran[J]. Biomass Conversion and Biorefinery,2021:1-11.
[8]林 淼,王阔鹏,陈映良,等. 乙醇对瘤胃液接种稻秸的体外发酵产物及细菌群落结构的影响[J]. 生物技术通报,2020,36(2):91-99.
[9]Patel A K,Singhania R R,Sim S J,et al. Thermostable cellulases:current status and perspectives[J]. Bioresource Technology,2019,279:385-392.
[10]Zheng Y,Zhao J,Xu F Q,et al. Pretreatment of lignocellulosic biomass for enhanced biogas production[J]. Progress in Energy and Combustion Science,2014,42:35-53.
[11]田亚红,王巍杰,王丽萍,等. 向日葵秸秆发酵生产乙醇工艺的研究[J]. 酿酒科技,2013(6):40-42.
[12]张 佳,王 园,安晓萍,等. 向日葵副产物的营养特性及在反刍动物中的应用[J]. 中国畜牧兽医,2021,48(3):916-924.
[13]Yue Z B,Li W W,Yu H Q. Application of rumen microorganisms for anaerobic bioconversion of lignocellulosic biomass[J]. Bioresource Technology,2013,128:738-744.
[14]艾 平,田启欢,席 江,等. 稻秸预处理厌氧强化产挥发性脂肪酸研究[J]. 农业机械学报,2018,49(3):309-316.
[15]Bengtsson S,Hallquist J,Werker A,et al. Acidogenic fermentation of industrial wastewaters:effects of chemostat retention time and pH on volatile fatty acids production[J]. Biochemical Engineering Journal,2008,40(3):492-499.
[16]Weimer P J,Kohn R A. Impacts of ruminal microorganisms on the production of fuels:how can we intercede from the outside?[J]. Applied Microbiology and Biotechnology,2016,100(8):3389-3398.
[17]Grootscholten T I M,Steinbusch K J J,Hamelers H V M,et al. Chain elongation of acetate and ethanol in an upflow anaerobic filter for high rate MCFA production[J]. Bioresource Technology,2013,135:440-445.
[18]王薪淯,朱晓宇,李海翔,等. 乳酸碳链延长技术及其在有机废弃物资源化中的应用研究进展[J]. 应用与环境生物学报,2020,26(4):827-835.
[19]Lin M,Dai X X,Weimer P J. Shifts in fermentation end products and bacterial community composition in long-term,sequentially transferred in vitro ruminal enrichment cultures fed switchgrass with and without ethanol as a co-substrate[J]. Bioresource Technology,2019,285:121324.
[20]Chen W S,Strik D P B T B,Buisman C J N,et al. Production of caproic acid from mixed organic waste:an environmental life cycle perspective[J]. Environmental Science & Technology,2017,51(12):7159-7168.
[21]Lin M,Feng L M,Cheng Z Q,et al. Effect of ethanol or lactic acid on volatile fatty acid profile and microbial community in short-term sequentially transfers by ruminal fermented with wheat straw in vitro[J]. Process Biochemistry,2021,102:369-375.
[22]Kleen J L,Hooijer G A,Rehage J,et al. Subacute ruminal acidosis (SARA):a review[J]. Journal of Veterinary Medicine Series A,2003,50(8):406-414.
[23]Chwialkowska J,Duber A,Zagrodnik R,et al. Caproic acid production from acid whey via open culture fermentation—evaluation of the role of electron donors and downstream processing[J]. Bioresource Technology,2019,279:74-83.
[24]Weimer P J,da Silva C L,Cacite F. Effects of ruminal dosing of Holstein cows with Megasphaera elsdenii on milk fat production,ruminal chemistry,and bacterial strain persistence[J]. Journal of Dairy Science,2015,98(11):8078-8092.
[25]Angenent L T,Richter H,Buckel W,et al. Chain elongation with reactor microbiomes:open-culture biotechnology to produce biochemicals[J]. Environmental Science & Technology,2016,50(6):2796-2810.
[26]Weimer P J,Moen G N. Quantitative analysis of growth and volatile fatty acid production by the anaerobic ruminal bacterium Megasphaera elsdenii T81[J]. Applied Microbiology and Biotechnology,2013,97(9):4075-4081.
[27]Kim H,Choi O,Jeon B S,et al. Impact of feedstocks and downstream processing technologies on the economics of caproic acid production in fermentation by Megasphaera elsdenii T81[J]. Bioresource Technology,2020,301:122794.
[28]張 洁,张力莉,徐晓锋. 反刍动物瘤胃内普雷沃氏菌的研究进展[J]. 中国饲料,2020(7):17-21.
[29]Fraga M,Fernández S,Perelmuter K,et al. The use of Prevotella bryantii 3C5 for modulation of the ruminal environment in an ovine model[J]. Brazilian Journal of Microbiology,2018,49:101-106.
[30]Yang P X,Leng L,Tan G Y A,et al. Upgrading lignocellulosic ethanol for caproate production via chain elongation fermentation[J]. International Biodeterioration & Biodegradation,2018,135:103-109.
[31]Solomon K V,Haitjema C H,Henske J K,et al. Early-branching gut fungi possess a large,comprehensive array of biomass-degrading enzymes[J]. Science,2016,351(6278):1192-1195.
[32]Sun X H,Gostincˇar C,Fang C,et al. Genomic evidence of recombination in the basidiomycete Wallemia mellicola[J]. Genes,2019,10(6):427.
[33]Skalski J H,Limon J J,Sharma P,et al. Expansion of commensal fungus Wallemia mellicola in the gastrointestinal mycobiota enhances the severity of allergic airway disease in mice[J]. PLoS Pathogens,2018,14(9):e1007260.
