脂肪酸及表面活性剂对广叶绣球菌液体培养的作用研究
2022-06-08刘晓瑜肖冬来江晓凌应正河林衍铨
刘晓瑜 马 璐 杨 驰 肖冬来 江晓凌 应正河 林衍铨
(福建省农业科学院食用菌研究所 特色食用菌繁育与栽培国家地方联合工程研究中心,福建 福州 350014)
广叶绣球菌(Sparassis latifolia)又名绣球菌,含有丰富的生物活性物质,具有抗肿瘤[1]、提高造血功能[2]和调节免疫[3]等作用,在保健品、功能食品和化妆品等领域有很好的应用前景[4]。绣球菌近年来已实现工厂化栽培,以瓶装木屑菌种为主,液体菌种培养是其重要生产环节。
研究表明,许多外源添加物如脂肪酸、有机溶剂、表面活性剂、植物油等能够提高多种食用菌在液体培养中的菌丝生长速度,同时增加活性代谢物的产量。表面活性剂分子通过改变细胞膜结构、增大细胞膜通透性,促进细胞内次级代谢产物分泌[5],如在发酵第5天向虎奶菇(Pleurotus tuber-regium)培养液中添加3.0 g/L吐温(Tween 80),可使菌丝体生物量和多糖产量分别提高51.3%和41.8%[6];桦褐孔菌(Inonotus obliquus)液体培养中添加体积分数为0.1%的Tween 80、TritonX-100(聚乙二醇辛基苯基醚,一种表面活性剂),对桦褐孔菌多糖的促进效果显著[7]。脂肪酸或油脂类物质广泛应用于食用菌液体培养研究,能够促进灵芝(Ganoderma lucidum)、灰树花(Grifola frondosa)等菌丝生长及真菌多糖的产生[8,9];添加0.5%的橄榄油和大豆油能够提高灰树花胞外多糖的含量[10]。
目前绣球菌液体培养研究多以培养工艺条件优化及提高次生代谢产物为主[11-15],前期研究已获得适宜的培养基配方,并优化了培养条件[16,17],但关于脂肪酸、有机溶剂、表面活性剂和植物油等外源添加物对绣球菌液体培养效果评价的研究较少。本试验探究外源添加物对绣球菌液体培养的作用,以为其液体菌种工艺优化提供参考。
1 材料与方法
1.1 供试菌种
广叶绣球菌‘闽绣1号’由福建省农业科学院食用菌研究所提供。
1.2 培养基
母种培养基(PDPA):马铃薯200 g/L,葡萄糖20 g/L,鱼粉蛋白胨2 g/L,琼脂粉16 g/L。
液体菌种培养基:马铃薯200 g/L,葡萄糖20 g/L,鱼粉蛋白胨3 g/L,MgSO4·7H2O 3 g/L,KH2PO41.5 g/L,pH自然。
脂肪酸、有机溶剂、表面活性剂试验基础培养基:葡萄糖70 g/L,鱼粉蛋白胨2 g/L,KH2PO43 g/L,pH 自然。
消泡剂试验基础培养基:葡萄糖20 g/L,鱼粉蛋白胨2 g/L,KH2PO42 g/L,pH自然。
Tween 80添加量试验基础培养基:葡萄糖15 g/L,玉米粉10 g/L,糯米粉30 g/L,KH2PO43 g/L,pH自然。
Tween 80添加时间试验基础培养基:葡萄糖30 g/L,玉米粉10 g/L,糯米粉30 g/L,KH2PO43 g/L,Tween 80 4 g/L,pH自然。
1.3 试验方法
(1)菌种活化及液体菌种培养。制备PDPA斜面培养基,接种后避光、24±1 ℃培养20天备用。制备液体菌种培养基,采用250 mL三角瓶,装液量100 mL,灭菌后接种活化菌种6~8块,于24±1 ℃、150 r/min下震荡培养10天,备用。
(2)外源添加物对液体培养的影响。选取4大类14种外源添加物加入液体培养基中进行液体培养,以不添加为对照。
脂肪酸4种,分别为亚油酸、油酸、软脂酸、硬脂酸,添加量为2 g/L。
有机溶剂4种,分别为甲醇、乙醇、正己烷、氯仿,添加量为体积分数0.2%。
表面活性剂4种,分别为Tween 20、Tween 80、CHAPS、Triton X-100,添加量为2 g/L。
消泡剂2种,分别为橄榄油(Olive oil):0.1、0.2、0.3、0.4、0.5、0.6 g/L;花生油(Peanut oil):0.1、0.2 、0.3、0.4、0.5、0.6 g/L。
(3)Tween 80添加量及添加时间对液体培养的影响。Tween 80添加量分别为2、4、6、8、10、12、14、16 g/L,以不添加为对照。Tween 80(4 g/L)分别在接种后0(CK)、3、5、7、11、15 天加入基础培养基中。
(4)液体培养条件。采用250 mL三角瓶,装液量100 mL,灭菌后按体积分数为8%的接种量接种液体菌种培养基,避光、24±1 ℃、150 r/min下培养15 天后,按以下方法进行测定。
1.4 测定指标
培养基pH:培养结束后,用pH计测定培养基终点pH。菌球直径与菌球密度:采用移液枪随机吸取一定体积培养液,将培养液中的菌球排列成直线,测总长度,取平均值,得菌球直径(mm);对培养液中的菌球计数,得菌球密度(个/mL)。菌丝体生物量:用清水充分冲洗经纱布过滤的菌球,将菌球于40 ℃下烘干至恒重,用电子天平称重后即得菌丝体生物量(g/L)。
1.5 数据分析
用SPSS Statistics 25.0(SPSS, Chicago, Illinois)对上述实验结果进行统计学分析,采用单因素方差分析和Duncan 检验(P< 0.05)分析试验组与对照组间的差异显著性。
2 试验结果
2.1 脂肪酸对绣球菌液体培养的作用
在液体培养基础培养基中分别加入2 g/L的亚油酸、油酸、软脂酸和硬脂酸后,绣球菌液体培养效果如表1所示。培养基终点pH,与对照相比,添加亚油酸的试验组显著提高,其他3个脂肪酸组也有提高,但差异不显著。菌球直径,添加油酸组较对照提高37.67%,差异显著,其余3种脂肪酸均有提高作用,以油酸效果较明显,比对照提高33.34%,但未达到显著性差异。菌丝体生物量,加入油酸对其有促进作用,较对照提高17.65%,而加入亚油酸则显著降低。
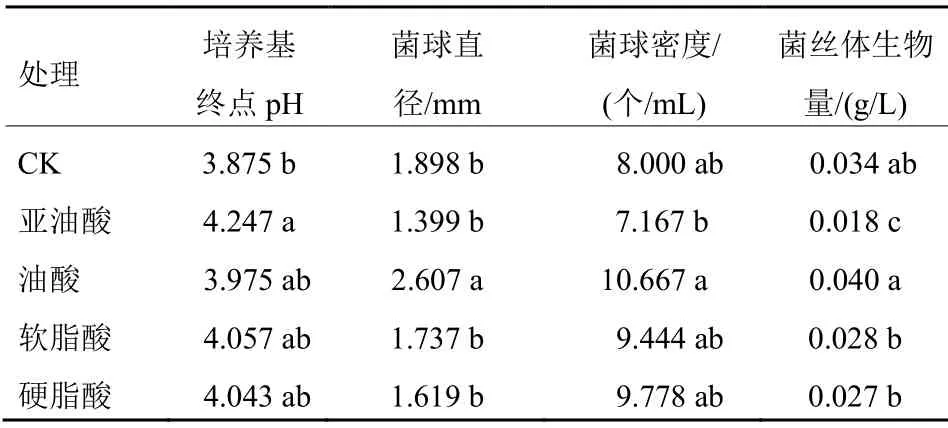
表1 培养基中添加不同脂肪酸的绣球菌液体培养情况
以上表明,添加2 g/L油酸对菌球直径、菌球密度和菌丝体生物量均有一定促进作用,而添加等量的亚油酸、软脂酸和硬脂酸对绣球菌液体培养生物量的提高无明显效果。
2.2 有机溶剂对绣球菌液体培养的作用
在液体培养基础培养基中分别加入体积分数为0.2%的甲醇、乙醇、正己烷和氯仿后,绣球菌液体培养效果如表2所示。甲醇和乙醇显著降低培养基终点pH。四者均可增大菌球直径,但仅氯仿的效果达到显著水平。甲醇对提高菌球密度有一定促进作用,并使菌丝体生物量较对照增加24.14%,差异显著;其余3种有机溶剂均降低菌球密度,而对菌丝体生物量无显著影响。表明加入体积分数为0.2%的甲醇对菌球直径、菌球密度和菌丝体生物量均有一定促进作用,而添加等量的乙醇、正己烷和氯仿对绣球菌液体培养生物量的提高无显著效果。

表2 培养基中添加不同有机溶剂的绣球菌液体培养情况
2.3 表面活性剂对绣球菌液体培养的作用
液体培养基础培养基中分别加入2 g/L的Tween 20、Tween 80、CHAPS和Triton X-100后,绣球菌液体培养效果如表3所示。CHAPS和Triton X-100严重抑制菌丝生长,无菌球或仅有少量菌球生长,均不适合用于绣球菌液体培养。Tween 20对提高菌球密度及菌丝体生物量有促进作用,分别较对照提高20.00%和10.53%;Tween 80也能在一定程度上提高菌球密度,但效果次于Tween 20。

表3 培养基中添加不同表面活性剂的绣球菌液体培养情况
2.4 植物油对绣球菌液体培养的作用
油脂类用于液体培养不仅可消泡,还可为菌丝生长提供一定营养,已广泛应用于液体培养工业。在绣球菌液体培养基中添加橄榄油和花生油的试验结果见图1。
在添加浓度范围内,随着橄榄油添加量的增大,培养终点pH逐渐降低,但未达显著性差异(图1-A)。菌球直径,添加量为0.2~0.6 g/L的试验组与对照组相比均显著增大,其中以添加量为0.5 g/L的最大(图1-B)。菌球密度在添加量为0.2 g/L时促进效果较好,但在试验浓度范围内,各组间无显著性差异(图1-C)。菌丝体生物量在供试添加量范围内整体呈上升趋势,各试验组与对照相比,均达到显著性差异,且以添加量为0.5 g/L的最大(图1-D)。表明在培养基中加入0.5 g/L的橄榄油能显著提高菌球直径和菌丝体生物量。
花生油除添加量为0.1 g/L时的培养基终点pH有显著增大外,其他试验组的变化差异均不显著(图1-A)。菌球直径随添加量的增加呈上升趋势,添加量为0.3 g/L、0.4 g/L、0.5 g/L和0.6 g/L时,分别较对照组提高23.93%、24.90%、25.29%和27.97%(图1-B),差异均显著。在添加量0.1~0.6 g/L范围内,菌球密度的变化差异不显著(图1-C)。随着花生油添加量的增加,各试验组菌丝体生物量分别较对照提高60.68%、94.87%、79.49%、123.93%、117.09%和100.00%,均显著高于对照,其中以添加量为0.4 g/L的最高(图1-D)。表明在培养基中加入0.1~0.6 g/L花生油均能促进绣球菌菌丝体生物量的积累,添加量为0.4 g/L时促进效果较好。
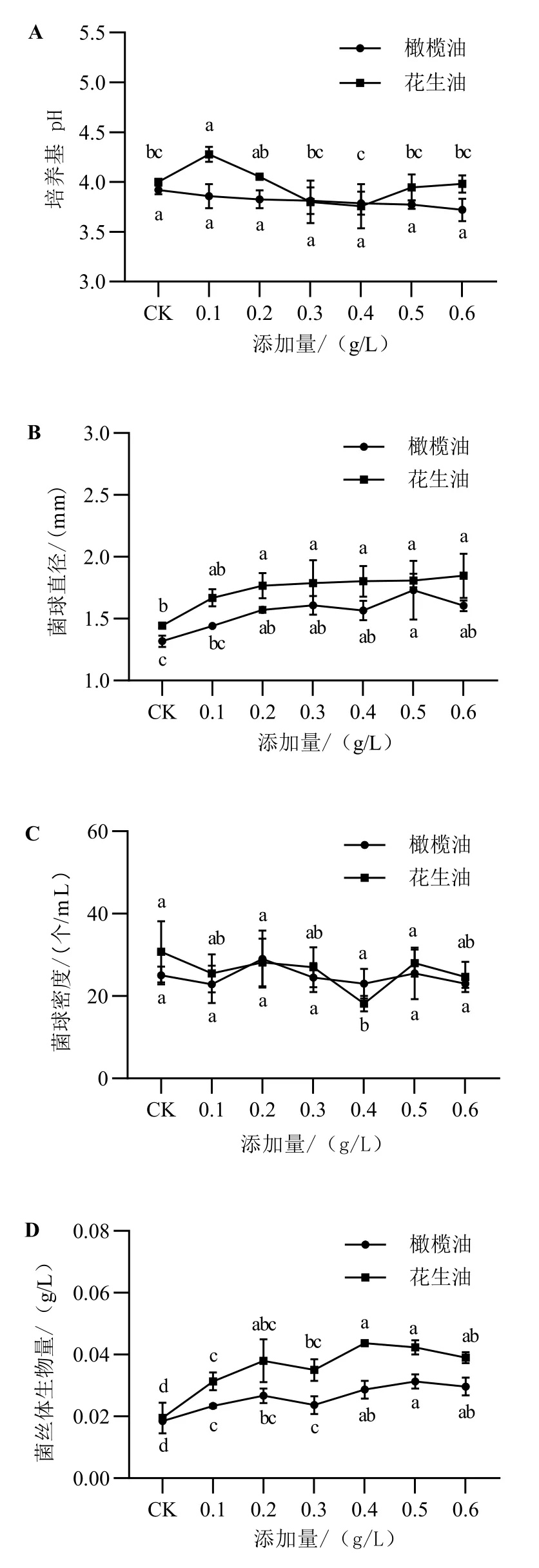
图1 橄榄油及花生油添加量对绣球菌液体培养的影响
2.5 Tween 80添加量及添加时间对绣球菌液体培养的作用
Tween 80在食用菌液体培养中的应用较广,前期试验结果显示其可提高绣球菌的菌球密度,本试验进一步探索其适宜的添加量和添加时间。在供试培养基中加入2~16 g/L Tween 80后,培养基终点pH和菌球直径无显著变化,但对菌球密度的影响较大(表4)。添加量为2 g/L时,菌球密度显著降低,之后随添加量增大,菌球密度逐渐升高,添加量为16 g/L时最大,比对照提高28.63%,达到显著水平。在供试范围内,添加Tween 80均可显著提高菌丝体生物量,添加量为4 g/L时达到较高水平,为0.107 g/L,之后随添加量的继续增加,增势趋缓,添加量为14 g/L时达到最大,为0.109 g/L,较对照提高28.23%。

表4 不同Tween 80添加量的绣球菌液体培养情况
在液体培养不同时间添加4 g/L Tween 80,对培养基终点pH和菌球直径的影响不大(表5);而菌球密度有一定提高,以接种后第11天添加Tween 80的菌球密度最大,较对照提高48.89%,但差异不显著;菌丝体生物量以接种后第3天加入Tween 80的最大(1.41 g/100mL),较对照提高34.29%,差异显著,其后随添加时间的延迟而逐渐降低。表明添加4 g/L的Tween 80能在一定程度上促进绣球菌液体培养的菌丝生长,且在培养初期(3天)添加可获得较好的促进效果。
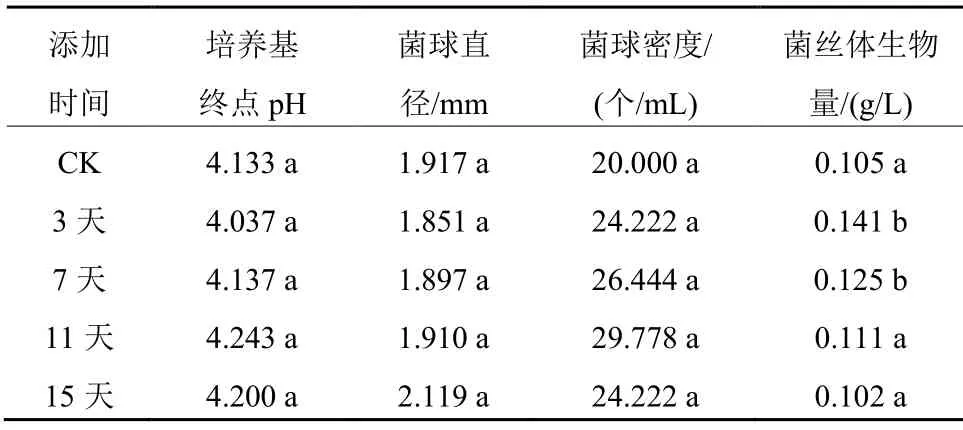
表5 Tween 80不同添加时间的绣球菌液体培养情况
3 结论与讨论
食药用菌液体培养中加入一定量的外源物质,可显著提高菌丝体生物量,这些物质通过改变细胞膜通透性,在培养体系中起缓冲作用,或提供一定的营养成分起到促生作用,以脂肪酸、有机溶剂、表面活性剂、植物油类研究较多,相关研究在多种食用菌中已有报道。
不同脂肪酸对绣球菌液体培养效果的作用存在差异,其中油酸对菌球直径、菌球密度和菌丝体生物量均有一定促进作用;软脂酸和硬脂酸能增加菌球密度,但菌丝体生物量有所下降;亚油酸显著降低菌丝体生物量,抑制菌丝生长。这与虎奶菇[6]、桦褐孔菌[7]和蛹虫草[18]的液体培养研究结果一致。Kavishree等[19]测定了不同食用菌的脂质组成,发现绣球菌中含有饱和脂肪酸软脂酸和多不饱和脂肪酸亚油酸,同时亚油酸和油酸比例小于1。不同菌类的菌丝体脂肪酸构成不同,可能会影响添加外源脂肪酸的作用效果,菌丝体脂肪酸组成和外源添加脂肪酸之间的相互作用还有待进一步研究。
有机溶剂能有效提高细胞膜的相容性,改变细胞膜通透性,影响细胞对营养物质的吸收,是一种经济易得、可提高次级代谢产物和菌丝体生物量的有效添加剂[6,20]。本试验研究4种常用有机溶剂甲醇、乙醇、正己烷和氯仿对绣球菌液体培养效果的影响发现:体积分数为0.2%的甲醇对菌球直径、菌球密度和菌丝体生物量的提高均有一定促进作用,其中菌丝体生物量有显著提高;氯仿虽能显著增大菌球直径,但菌球密度下降,整体生物量与对照差别不大。
表面活性剂广泛应用于菌类液体培养和生物降解,通过改变细胞膜疏水性或干扰细胞膜屏障,影响物质吸收转运过程[5]。本研究发现Tween 20和Tween 80对绣球菌菌丝生长有一定促进作用,而CHAPS和Triton X-100严重抑制菌丝生长,这与虎奶菇和桦褐孔菌液体培养中添加CHAPS和Triton X-100会产生明显抑制作用的结论相一致。但在桦褐孔菌多糖含量和抗氧化活性方面,Triton X-100则表现出较好的促进作用[6,7,21]。本研究结果还显示,当Tween 80添加量为4 g/L时,菌丝体生物量达到较高水平(1.07 g/100mL),且在培养初期(3天)添加能获得较好的促进效果,这与灰树花液体培养第3天添加体积分数为0.5%的Tween 80时其生物量达到最大的结果相符[10]。在虎奶菇液体培养研究中添加3 g/L Tween 80对菌丝生长和多糖合成的促进效果最佳,Tween 80浓度过高会产生较多气泡,影响菌丝聚集和热量传导,不利于维持液体培养的无菌环境[6]。
植物油可作为液体培养的消泡剂,能够减少菌丝体表面褶皱,延迟细胞老化[8]。本试验结果显示,添加0.5 g/L橄榄油和0.4 g/L花生油能显著提高绣球菌液体培养的菌球直径和菌丝体生物量,且花生油对菌丝体生物量积累的促进效果更好。添加植物油对绣球菌菌丝的促生长作用明显,这与灰树花、桦褐孔菌液体培养研究结果一致[10,22]。研究还显示,在牛樟芝液体培养初期添加大豆油能够诱导多酚类物质的产生和分泌[23]。
液体菌种具有菌龄一致、制备周期短的优点,适合食用菌大规模工厂化栽培。目前绣球菌栽培采用瓶装木屑菌种,制种周期长,使用液体菌种进行生产能够缩短制种和栽培周期。本研究选取了多种不同类别的外源添加物对绣球菌液体培养条件进行优化,其中油酸、甲醇、橄榄油、花生油和Tween 80对菌丝体生物量积累的效果较好,后续可进一步研究不同外源添加物的协同作用效果,为绣球菌液体菌种扩大培养提供参考。
