基于TLR4/NF-κB/MyD88通路探讨清解化攻方抑制雨蛙素诱导重症急性胰腺炎模型大鼠炎症反应的生信分析及实验验证
2022-06-08秦百君唐曦平卜献忠宫文浩陈月桥陈国忠
秦百君,唐曦平,杨 昕,卜献忠,宫文浩,陈月桥,陈国忠
(1.广西中医药大学,广西 南宁 530001;2.广西医科大学附属肿瘤医院,广西 南宁 530021;广西中医药大学第一附属医院,广西 南宁 530023)
重症急性胰腺炎(severe acute pancreatitis, SAP)是多种病因引起的胰蛋白酶异常激活、胰腺组织水肿坏死及炎症介质大量释放,继发全身炎症性反应综合征和多器官功能障碍综合征的急危重症,包括中国在内的亚洲国家本病发病率约(36~125)/10万人,在急性胰腺炎患病人数中占比约20%,死亡率可达6.5%~26%,患病进展迅速,预后凶险[1-3]。SAP发病机制十分复杂,其中“炎症介质与细胞因子学说”在阐述SAP发病进展过程具有重要地位,由于胰腺腺泡细胞内广泛的酶激活现象能够促使腺体自溶、细胞坏死,从而释放大量炎症介质与细胞因子入血,进而引起氧自由基产生和血管损伤,级联式炎症反应加重多器官损伤[4]。而TLR4/NF-kB/MyD88信号通路是关键的炎症转导途径之一,可调控多种炎症介质和细胞因子的表达,该通路活化在SAP发病过程中发挥重要作用[5]。
清解化攻方(QingJieHuaGong decoction, QJHGD)是广西中医药大学第一附属医院治疗SAP名医验方的院内制剂,已在我院及医联体合作单位使用多年,临床疗效显著[6],目前复方已获得国家发明专利(专利号:ZL201811021893.2)。课题组前期实验证明QJHGD对SAP大鼠可减少胰腺出血、降低坏死程度,减轻炎症细胞浸润,但具体机制未明。本研究结合生信数据分析,构建QJHGD调控网络并富集相关信号通路,通过雨蛙素联合脂多糖(caerulein-lipopolysaccharide,CAE-Lps)复制SAP大鼠模型,揭示QJHGD通过调控TLR4/NF-κB/MyD88信号通路从而发挥抑制炎症反应、缓解胰腺炎病情的作用。
1 材料与方法
1.1 QJHGD网络药理学预测
1.1.1在线数据库及分析软件 中药成分数据库TCMSP(http://tcmspw.com/tcmsp.php及https://www.tcmsp-e.com)、TCMID(http://www.megabionet.org/tcmid/);药物靶点数据库BATMAN TCM (http://bionet.ncpsb.org/batman-tcm/)、Pubchem(https://pubchem.ncbi.nlm.nih.gov/)、swiss target prediction(http://www.swisstargetprediction.ch/);疾病数据库GeneCards(www.genecards.org/)、TTD(http://db.idrblab.net/ttd/)、OMIM(https://omim.org/)、pharmgkb(www.pharmgkb.org/)、Drugbank(https://go.drugbank.com/)。蛋白互作用String数据库(https://string-db.org/)、蛋白数据库Uniprot(https://www.uniprot.org)。基因功能注释网站Metascape(https://metascape.org/)。作图工具Cytoscape 3.7.1、yihanbo网站(http://www.ehbio.com/ImageGP/index.php/)。
1.1.2QJHGD活性成分及靶点筛选 利用TCMSP、TCMID数据库检索QJHGD中柴胡、大黄、厚朴、黄芩、木香、桃仁、枳实7味中药的化学成分,筛选条件满足“Lipinski类药原则”,且药物相似度DL≥0.18、口服生物利用度OB≥30%、Caco-2细胞表观渗透系数≥-0.4。删除人工检索无文献支撑的化合物,结合参考文献及PubChem数据库结果,将没有满足药动学参数化合物去掉,最终保留QJHGD有效成分。筛选后的活性成分结合Pubchem、swiss target prediction逐一配对潜在药物作用靶点,综合BATMAN TCM数据库结果,得到QJHGD作用靶点集合。gene symbol通过UniProt数据库注释。
1.1.3SAP疾病相关靶点筛选 以“Severe acute pancreatitis”为关键词,综合GeneCards、TTD、OMIM、pharmgkb、Drugbank数据库收集SAP相关疾病靶点,将QJHGD作用靶点集合与SAP疾病靶点交互映射,以交集韦恩图形式展示QJHGD干预SAP的相关靶点集。
1.1.4蛋白互作用网络构建 将交集靶点输入String网站,构建蛋白质互作用网络图。选择“Muitiple proteins”,物种“Homo sapiens”,置信度设置为>0.90。
1.1.5“药物-成分-靶点”网络构建 药物有效成分与QJHGD干预SAP的靶点集相互映射,成分靶点逐一匹配,借助Cytoscape 3.7.1软件绘制QJHGD干预SAP的“药物-成分-靶点”网络图。
1.1.6GO和KEGG富集分析 Metascape数据库对核心靶点进行基因本体论(GO)功能富集和京都基因与基因组百科全书(KEGG)通路富集分析,P<0.05。选择富集数目最多的前20个条目在yihanbo网站分别绘制GO和KEGG气泡图。
1.2 CAE-Lps诱导SAP模型大鼠体内实验验证
1.2.1动物 6~8周龄♂ SPF级SD大鼠40只,体质量(200±20) g,购于湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2019-0004。大鼠于广西中医药大学SPF级实验室饲养[SYXK(湘)2019-0001],饲养条件:湿度55%~65%、温度(24±2)℃、光暗循环12 h·d-1。实验所涉及动物饲养符合福利标准。
1.2.2药品与试剂 QJHGD实验处方:柴胡、大黄、厚朴、黄芩、木香、桃仁、枳实,由广西中医药大学一附院煎药室制备,广西中医药大学中药资源中心鉴定药材符合《中华人民共和国药典》规定。药材加10倍蒸馏水浸泡24 h,先武火煮沸,后文火继续煮30 min,滤出药液常法下煎煮3次,过滤药液用旋转蒸发仪浓缩,配制1 kg·L-1生药。注射用乌司他丁(规格2 mL:10万IU,广东天普洛安生物,货号031905103)。Elisa试剂:大鼠α-AMS(赛默飞DG96286Q-96T)、大鼠脂肪酶(赛默飞DG96276Q-96T)、大鼠IL-6(武汉云克隆L210405259)、大鼠TNF-α(上海酶联m1064303-C)等试剂盒。免疫组化试剂:苏木素-伊红染色试剂盒(索莱宝,货号G1120),DAB显色试剂盒(中杉金桥,货号ZLI-9018),TLR4一抗(赛默飞,货号13-9924-81),NF-κB P65一抗(赛默飞,货号PA5-27617),MyD88一抗(赛默飞,货号PA5-19918),二抗通用二步法检测试剂盒(大鼠增强聚合物法检测系统,货号PV-9000)。雨蛙素(上海源叶生物,货号S62702),脂多糖(上海源叶生物,货号S11060)。
1.2.3仪器 Centrifuge5804R离心机(德国艾本德);ThermoFisher Multiskan GO全波长酶标仪(美国赛默飞);ZKPJ-1A烤片机(天津爱华);Histostar组织包埋机(美国赛默飞);ASP300S封闭式组织脱水机(德国徕卡);Coverslipper CS500全自动智能染色封片一体机(中国达科为);电子显微镜(德国徕卡)。
1.2.4动物造模 SD大鼠适应性喂养1周后,随机分为正常组、模型组、中药组、西药组,每组各10只,造模前24 h禁食不禁水。造模采用雨蛙素注射法[7],将雨蛙素用DMSO溶解后予0.9%生理盐水稀释成5 mg·L-1,参考《药理实验方法学》[8],根据临床体重折算,模型组及各给药组大鼠予50 μg·kg-1CAE腹腔注射,每小时注射1次,连续6次,第7次注射LPS 10 mg·kg-1复制SAP模型。注射结束后,中药组予QJHGD溶液灌胃7 g·kg-1(等同于临床等效剂量,且该剂量为前期实验确定最佳剂量故未设量效组别),正常组、模型组予相同容积生理盐水灌胃,西药组予乌司他丁皮下注射,按临床用量折算为2万IU·kg-1,每天2次,连续3 d。给药完成后,予腹腔注射戊巴比妥钠50 mg·kg-1麻醉。
1.2.5QJHGD对SAP大鼠血清淀粉酶、血清脂肪酶活性及炎症因子表达水平的影响 取材时充分暴露腹主动脉,置入套管针采血,留取血液标本,留取的血液标本在室温下放置2 h,然后在4 ℃下高速离心机以3 500 r·min-1离心10 min,取上层血清分装于试管中。采用酶联免疫吸附实验用酶标仪在450 nm波长下检测各组血清淀粉酶、血清脂肪酶、IL-6、TNF-α的OD值,绘制样品标准曲线并换算浓度。
1.2.6苏木精-伊红染色法观察QJHGD对SAP大鼠胰腺组织病理改变的影响 胰腺体部位取材,4%多聚甲醛固定,后石蜡包埋切片,予37 ℃恒温箱烤片1 h,二甲苯和无水乙醇脱蜡水化。切片经苏木精染色液染色5 min,分化液分化后予自来水浸泡,后将切片置于伊红染液1 min,自来水洗净切片,最后予脱水、透明、封片,镜下观察包含QJHGD中药组在内的各组SAP大鼠胰腺组织病理改变情况。
1.2.7免疫组化法检测胰腺组织TLR4/NF-kB/MyD88通路关键蛋白表达 石蜡切片于65 ℃烤片后予柠檬酸钠修复液浸泡并机器高压(100 ℃,100 kPa)修复1 h,阻断封闭之后,根据抗体说明书将抗体按1 ∶100比例稀释,孵育TLR4、NF-κB、MyD88一抗,存放在湿盒中4 ℃冰箱过夜。24 h后取出PBS洗涤3次,二抗滴片,孵育20 min后,洗净加入DAB显色液,后予苏木精复染转蓝,脱水、封片。Image pro plus6软件分析并计算平均光密度,测算方法参考李枫等[9]文献。

2 结果
2.1 网络药理学预测QJHGD防治SAP的成分及靶点
2.1.1QJHGD有效成分筛选及作用靶点预测 在TCMSP、TCMID数据库共收集到QJHGD成分1 415种,删除重复化合物,满足类药性DL、口服生物利用度OB、Caco-2细胞模型条件及Lipinski类药原则,选择具有良好ADME特性的化合物,并去除人工检索无文献支撑的成分。重新纳入文献研究中槲皮素(quercetin)、橙皮苷(hesperidin)等满足药动学参数条件的药效分子。最终确定Sainfuran、aloe-emodin、Magnolol等QJHGD有效成分105种化合物,其中柴胡13种、大黄10种,厚朴8种,黄芩32种,木香5种,桃仁18种,枳实19种,部分成分见Tab 1。筛选后的活性成分结合Pubchem、Swiss target prediction逐一配对潜在药物作用靶点,综合BATMAN TCM数据库结果,得到QJHGD作用靶点189种。

Tab 1 Information of main active ingredients in QJHGD*
2.1.2SAP疾病相关靶点 通过对GeneCards、TTD、OMIM、pharmgkb、Drugbank数据库逐一检索,分别收集到SAP相关靶点个数为6 989、12、147、121、12。5个数据集取并集后共得到SAP相关靶基因个数7 039。各数据集之间映射情况如Fig 1所示。

Fig 1 Vertical Venn diagram of SAP target gene
2.1.3QJHGD防治SAP重要靶点及蛋白互作用网络 QJHGD干预的189个中药靶点和7 039个SAP疾病相关靶点取交集后,得到QJHGD防治SAP的共同作用靶点167个,见Fig 2。在String网站输入该共同靶点集合,删除无效靶点后,得到124个重要靶点集合,见Fig 3。
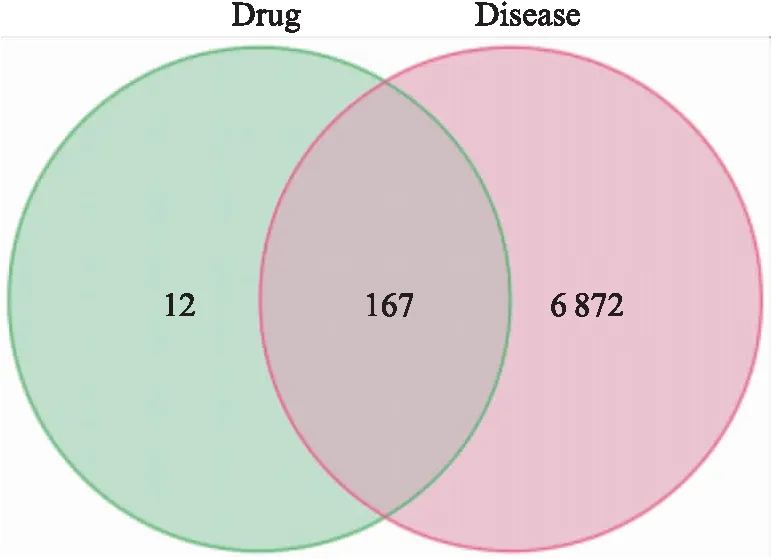
Fig 2 Venn diagram on intersection genes of QJHGD-SAP
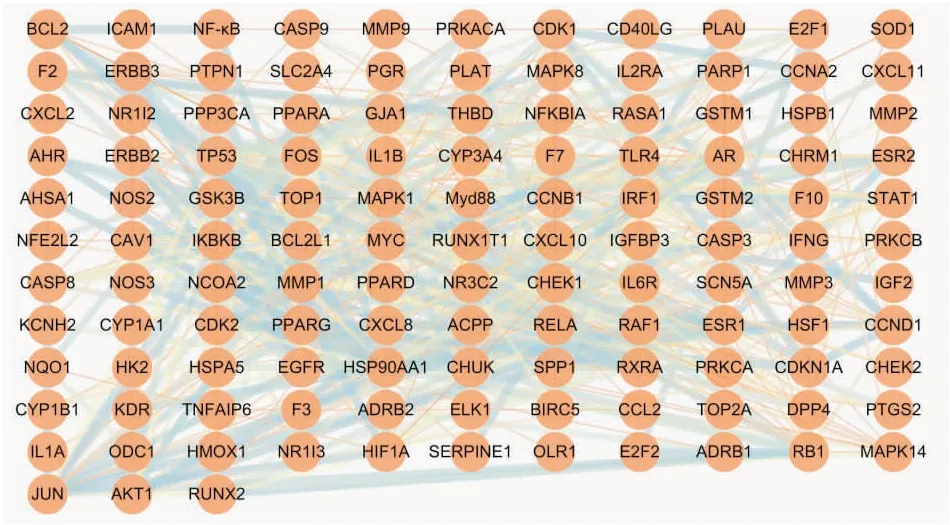
Fig 3 PPI network of QJHGD in treatment of severe acute pancreatitis
2.1.4QJHGD防治SAP的“中药-成分-靶点”调控网络 105种QJHGD中药有效成分和124个SAP疾病重要靶点输入Cytoscape绘制“药物-成分-靶点”网络图,该网络中含有318个节点和1 167条边。菱形代表疾病靶点,圆形代表中药成分,不同颜色的圆形节点代表不同的中药,体现了QJHGD多成分、多靶点、多途径防治SAP的特点,见Fig 4。其中,TLR4、NF-κB、Myd88靶点被柴胡、枳实、大黄、木香、黄芩、厚朴的中药有效成分交叉映射。Toll样受体4信号传递蛋白(Toll-like receptor4,TLR4)是炎症级联反应的门户启动蛋白,在SAP胰腺腺泡细胞和肠黏膜上皮细胞均有广泛分布;核转录因子κB(nuclear factor kappa B,NF-κB)被认为是SAP瀑布级联反应上游靶点,可上调免疫炎性相关的趋化因子、黏附因子表达,促成炎症反应不断放大加重器官损害;髓样分化蛋白88(myeloid differentiation factor88,MyD88)作为Toll通路下游重要的接头蛋白,在炎症免疫通路中发挥关键作用。上述3个靶点可能是QJHGD拮抗SAP炎症反应发挥调控作用的途径之一。
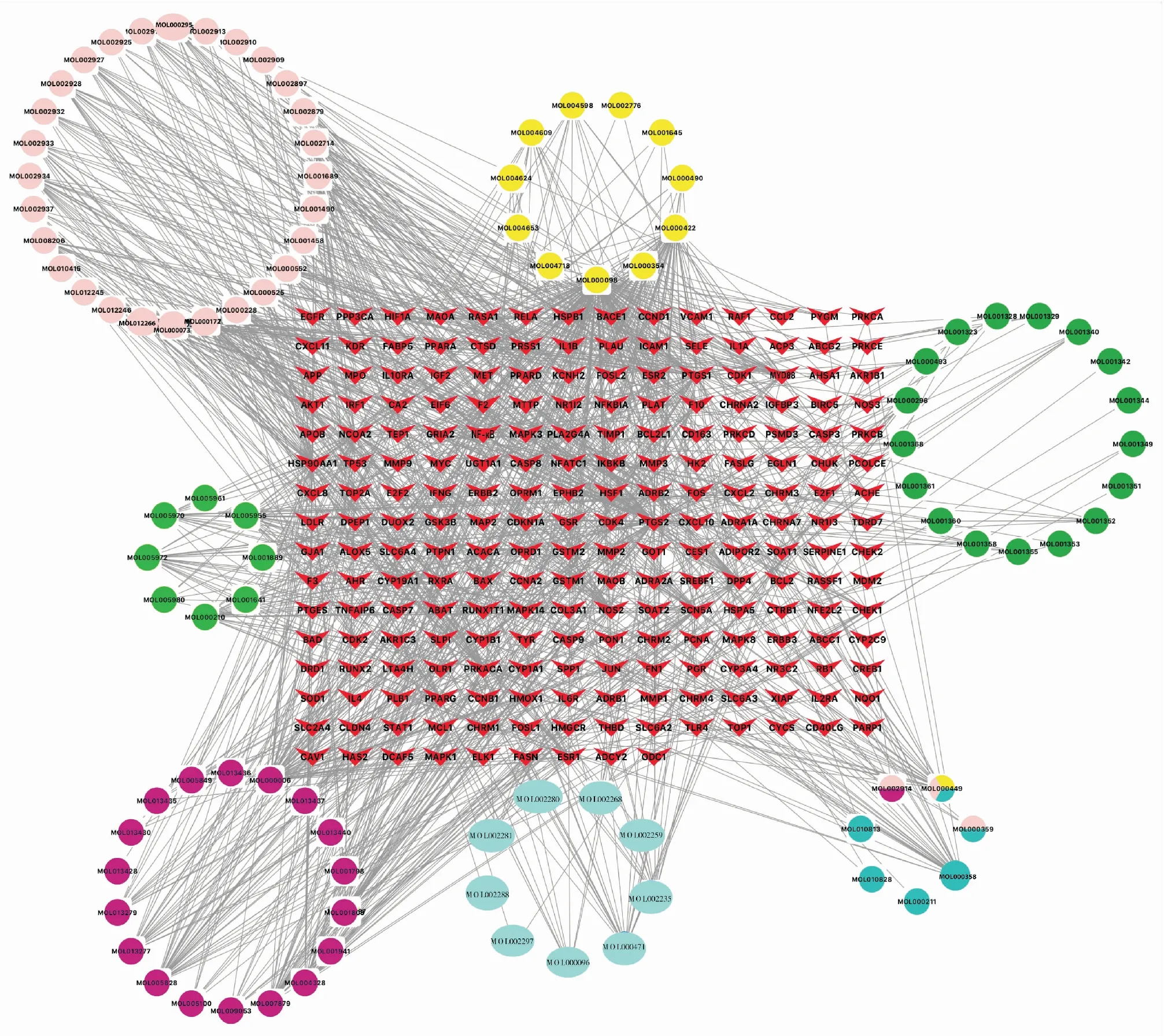
Fig 4 Network diagram on “TCM - component - target” of QJHGD
2.1.5GO和KEGG富集分析 QJHGD防治SAP重要靶点输入Metascape进行功能和通路富集分析。GO富集分析得到生物过程条目1 814、细胞组分条目94个、分子功能条目172个。生物过程包含脂多糖反应、细胞对有机环化合物反应等过程;细胞组分涉及细胞质的核周区、丝氨酸/苏氨酸蛋白激酶复合物等;分子功能包括转录因子结合、G蛋白偶联胺受体激活等,见Fig 5。KEGG通路富集分析,共富集到320条不同通路,其中Fig 6所示,Toll样受体经典通路与NF-κB通路为本研究关注的靶向通路。通路富集分析也进一步验证和揭示QJHGD可能通过调控Toll样受体、NF-κB经典通路从而发挥防治SAP作用,富集结果与中药作用的重要靶点相契合。后续动物实验围绕TLR4/NF-kB/MyD88通路蛋白表达情况进行验证。
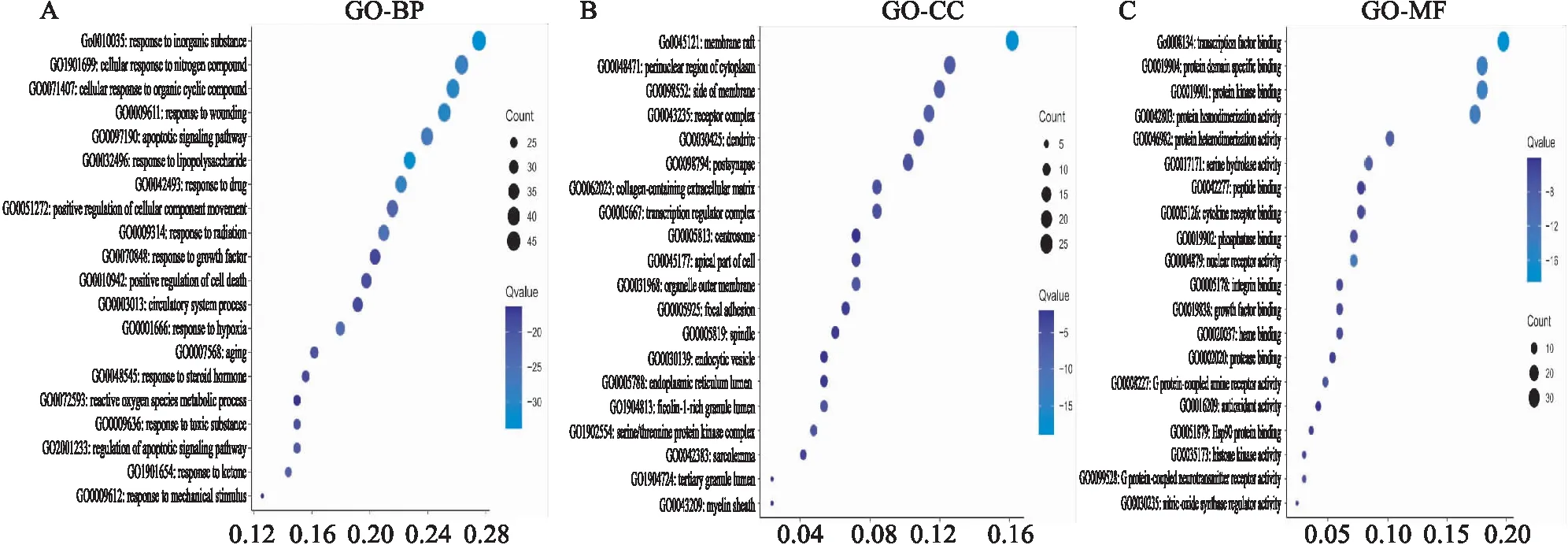
Fig 5 GO biological function enrichment analysis

Fig 6 KEGG pathway enrichment analysis
2.2 动物模型体内实验验证
2.2.1QJHGD对SAP大鼠血清淀粉酶、脂肪酶活性及IL-6、TNF-α含量的影响 相比于正常组,模型组大鼠血清中的淀粉酶、脂肪酶活性均升高(P<0.05);中药组和西药组两者水平较模型组低(P<0.05);中药组与西药组相比,血清淀粉酶活性降低,血清脂肪酶活性表达差异不明显。模型组大鼠TNF-α、IL-6含量较正常组、各给药组比较均升高(P<0.05);中药组IL-6含量明显低于模型组(P<0.05)。上述结果说明QJHGD可有效降低SAP模型大鼠血清淀粉酶、脂肪酶、IL-6、TNF-α表达水平,抑制大鼠炎症反应(Fig 7)。

Fig 7 Effect of QJHGD on expression of inflammatory factors in SAP n=6)
2.2.2QJHGD对SAP大鼠胰腺组织病理的影响 SAP模型大鼠胰腺组织病理检查显示,正常组大鼠胰腺小叶、腺泡结构均正常,组织结构缜密,未出现明显的水肿、充血、炎性浸润;模型组部分区域胰腺腺泡萎缩,炎细胞浸润,组织水肿及显著空泡样改变;中药组和西药组中胰腺腺泡结构大部分尚存,仅见少量坏死及轻度水肿(Fig 8)。

Fig 8 Effect of QJHGD on pancreatic pathology in SAP model rats(HE staining, ×200)
2.2.3QJHGD对SAP大鼠胰腺TLR4/NF-kB/MyD88信号通路的影响 正常组胰腺组织结构完整,TLR4 、NF-κB、MyD88阳性表达尚浅;模型组可见大量胞质TLR4、NF-κB阳性染色细胞和胞核MyD88阳性染色细胞;与正常组相比,模型组TLR4、NF-κB、MyD88表达均增高(P<0.05),阳性表达区域明显增多。中药组腺泡结构基本完整,TLR4、NF-κB、MyD88阳性染色细胞较模型组和西药组明显减少;与西药组相比,中药组TLR4、NF-κB阳性表达明显降低(P<0.05),中药组MyD88阳性表达差异不明显(P<0.05)(Fig 9-10)。
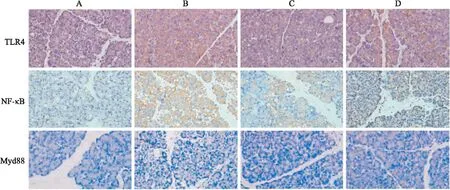
Fig 9 Expression of TLR4, NF-κB and Myd88 in pancreatic of mice in each group(immunohistochemical method ×200)

Fig 10 IOD value of TLR4, NF-κB and Myd88 in pancreatic tissues of each group of n=6)
3 讨论
重症急性胰腺炎是急性胰腺炎伴有持续性脏器功能障碍、全身炎症反应综合征、多器官功能衰竭的临床常见急危重症。在SAP早期及时予不同治疗手段干预,如中药鼻饲、灌肠、外敷等,中西医结合多途径缓解病情十分重要。中医理论认为本病属于湿热瘀浊绞结于中焦及肠道,日久成毒,耗气伤阴,治疗上当“清热化湿解毒、化瘀攻下存阴”并举[10]。清解化攻方是遵从上述治则,长期广泛使用确有疗效的临床协定处方,该方由柴胡等7味中药精心组合,以通腑泻浊的小承气汤为基础,配理气化湿、活血祛瘀、清热解毒药共奏荡涤毒邪、存阴护阳的作用。清解化攻方临床疗效确切,但作用靶点、通路机制等尚不明确。本研究结合网络药理学和分子生物学方法,探究清解化攻方治疗重症急性胰腺炎的作用机制。

Fig 11 Schematic diagram of QJHGD inhibiting
网络药理学多数据库收集清解化攻方化学成分,筛选满足Lipinski类药原则且药物相似度DL≥0.18、口服生物利用度OB≥30%、Caco-2细胞表观渗透系数≥-0.4要求,结合PubChem数据库,最终保留QJHGD有效成分105种。清解化攻方中柴胡的主要成分柴胡皂苷是天然的皂苷类化合物,有抗炎、调节免疫、促酶分泌等作用,雷霏等[11]报道柴胡皂苷可通过抑制c-fos、c-jun mRNA及蛋白表达改善胰腺炎大鼠胰腺外分泌功能,进而抑制胰腺酶蛋白过度合成抑制胰腺炎病情进展。大黄中主要成分为蒽醌类中的大黄素、大黄酸,可调节血脂、抗血小板聚集、抗氧化和免疫调节等,伍洋等[12]研究表明,TLR4高表达促进炎症反应进程,大黄素可通过下调TLR4等免疫因子的表达,恢复Treg/Th17免疫平衡,缓解SAP炎症反应;蔡丹莉等[13]通过开腹胰胆管注射牛磺胆酸钠复制SAP动物模型,也证实了大黄素可调节大鼠胰腺及肺组织Toll样受体4水平从而发挥抗炎作用。厚朴酚有抗炎抗菌、抗病原微生物,抗溃疡,抗氧化,抗肿瘤等作用,王燕等[14]研究表明,厚朴酚可抑制HMGB1-TLR4/NF-κB信号转导通路,降低炎症因子水平,缓解SAP及SAP相关肺损伤病情;另外,厚朴多酚清除氧自由基、改善微循环血流灌注对于缓解胰腺炎病情也发挥重要作用。黄芩苷是中药黄芩的主要有效成分,Jingmin等[15]报道了黄芩苷可抑制胰腺组织中NF-κB表达,减轻胰腺炎症反应,这与枳实的有效成分皂苷可抑制胰酶活性发挥抗炎作用类似。木香包含萜类、黄酮等多种成分,木香烃内酯作为其活性成分之一,可有效抑制脂多糖诱导的NO产生和NF-κB活化,抑制诱导型一氧化氮合酶(iNOS)基因的表达发挥抗炎作用[16]。兰涛等[17]报道了桃仁提取物可显著降低SAP大鼠TLR4和NF-κB p65的mRNA水平改善其免疫功能。上述实验及文献研究表明,清解化攻方中药的主要组分在抑制胰腺炎炎症反应、调节TLR4/NF-κB p65通路表达方面具有重要作用。
通过网络药理学GO和KEGG富集分析,结果表明清解化攻方防治SAP的生物学过程包括对无机物质响应、脂多糖反应、与转录因子结合等,交集靶点涉及PI3K-Akt、Toll样受体、NF-κB等经典信号通路。SAP炎症发生与模式识别受体识别病原相关分子模式,引发机体免疫应答、同时释放炎症介质相关。Toll样受体家族作为重要的炎症识别受体,该类跨膜蛋白能识别受体及复合物的胞外区域,从而激发下游分子通路。TLR4是最早被发现的I型跨膜蛋白受体,其胞内区的TIR结构域可与接头蛋白Myd88死亡结构域和中间域相结合,募集并分离集白介素受体相关激酶(IL-receptor-associated kinase,IRAK),与肿瘤坏死因子受体结合后激活下游通路的NF-κB诱导激酶((NF-κB inducing kinase,NIK),活化NIK进一步激活IκB激酶,后者通过与NF-κB复合物解聚,暴露核序列从而激发核转录因子途径,导致炎症反应和免疫应答[18]。在本研究动物实验中,通过腹腔注射雨蛙素和脂多糖复制SAP大鼠模型,该方法相比胆胰管逆行注射牛磺胆酸钠操作易行,造模成功率高,可稳定复制SAP模型。实验结果显示,模型组大鼠的血清淀粉酶、血清脂肪酶、IL-6、TNF-α活性较正常组相比均明显升高,胰腺组织部分区域胰腺腺泡萎缩,炎细胞浸润,组织空泡样病变,TLR4通路活化,NF-κB p65、MyD88蛋白的阳性表达明显升高;中药组大鼠血清中的淀粉酶、脂肪酶、IL-6、TNF-α等炎症因子表达水平明显降低,胰腺结构基本完整,无明显水肿充血,TLR4表达下调,NF-κB p65活化抑制,MyD88蛋白阳性表达降低。结果说明清解化攻方可通过下调TLR4/NF-kB/MyD88信号通路发挥抑制SAP大鼠炎症反应的作用,该结果与网络药理学KEGG富集的靶向信号通路相契合。
综上,本研究利用网络药理学生信数据分析,并通过雨蛙素联合脂多糖复制大鼠疾病模型,在体内实验验证了清解化攻方改善重症急性胰腺炎大鼠胰腺损伤的作用机制之一,可能与通过下调TLR4/NF-κB/MyD88通路关键蛋白表达相关,机制示意图见Fig 11。
