甲状腺乳头状癌细胞中长链非编码RNA FoxP4-AS1的表达及其生物学功能
2022-06-08杨惠芳汤蕊罗雪高庆军陈星宏赵代伟
杨惠芳,汤蕊,罗雪,,高庆军,陈星宏,赵代伟,4
(1.贵州医科大学临床医学院,贵州 贵阳 550000;2.贵州省毕节市第一人民医院甲状腺外科,贵州 毕节 551700;3.贵州医科大学附属医院甲状腺外科,贵州 贵阳 550000;4.贵州省第二人民医院甲状腺外科,贵州 贵阳 550004)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺癌中最常见的病理组织学类型,约占甲状腺癌(thyroid carcinoma, TC) 的80% 以上[1],近年来其发病率以每年4%的速度上升[2]。多数的PTC 患者通过手术治疗、促甲状腺激素(thyroid stimulating hormone,TSH) 抑制治疗及131I治疗后可达到临床治愈,但侵袭性较高的PTC 患者其5年复发率约5%[3],且晚期PTC 通常预后不良[4]。PTC 的发生发展机制尚不清楚,但已发现不少危险因素与PTC 的发生发展有关,包括遗传、环境暴露、表观遗传改变等[5-6]。因此,深入探讨PTC 发生发展的分子机理对于寻求新的防治靶点有着重要意义。
长链非编码RNAs (long non-coding RNA,lncRNA)在调控肿瘤的发生发展中起着重要作用。其中,长链非编码RNA FoxP4-AS1(lncRNA FoxP4-AS1) 是位于6 号染色体的基因间lncRNA,与FoxP4 反向头尾分布,但外显子无互补区域,含588 个碱基对[7-8]。lncRNA FoxP4-AS1 首次在结直肠癌中被发现[9],此后,人们在多种肿瘤中发现FoxP4-AS1 的表达,包括骨肉瘤[10]、胃癌[11]、前列腺癌[12]、宫颈癌[13]、鼻咽癌[14]、食管鳞状细胞癌[15]以及胰腺导管腺癌[16]等,且FoxP4-AS1 在肿瘤中高表达,预示着预后不良。而课题组前期研究[17]发现,FoxP4-AS1 在PTC 中表达下调,其低表达是PTC 区域淋巴结转移的独立危险因素。但FoxP4-AS1 对PTC 细胞生物学的影响及其作用机理目前尚不清楚。因此,本研究旨在通过慢病毒稳定转染技术探究lncRNA FoxP4-AS1 对PTC 细胞(TPC-1、K1 细胞) 生物学行为的影响,及其潜在的影响机制。
1 材料与方法
1.1 材料
人甲状腺乳头状癌细胞TPC-1(武汉普诺赛生命科技有限公司),人甲状腺乳头状癌细胞K1 及人正常甲状腺滤泡上皮细胞Nthy-ori3-1(上海市长海医院); RPMI 1640 培养基和DMEM 培养基(Gibco,美国);6 孔、24 孔组织培养板(康宁公司,美国);过表达慢病毒(上海吉凯基因医学科技股份有限公司,GOSL0262738,中国);TRIzol(Ambion,美国);ECL 显色试剂盒、nanodrop 2000(Thermo Fisher, 美 国); LnRcute LncRNA cDNA第一链合成试剂盒、LnRcute LncRNA 荧光定量检测试剂盒(天根生化科技有限公司,中国北京);CFX Connect 检测系统(Bio-rad,美国);CCK-8 试剂盒(APE×BIO 公司,美国);甲醇、4%多聚甲醛、苏木素(Servicebio,中国武汉);EdU 检测试剂盒(Ribobio,中国广州);DAPI(Solarbio,中国北京);周期试剂盒(凯基生物,中国);流式细胞仪(Beckman,美国);Transwell 小室、基质胶(Corning 公司,美国);抗体(贵州华远生物技术有限公司,中国)。
1.2 方法
1.2.1 细胞培养、分组和转染 人PTC 细胞TPC-1 和人正常甲状腺滤泡上皮细胞Nthy-ori3-1 培养在RPMI 1640 完全培养基(含10% 胎牛血清、0.1 mg/mL 链霉素和100 U/mL 青霉素)中,人甲状腺乳头状癌细胞K1 培养在DMEM 完全培养基(含10% 胎牛血清、0.1 mg/mL 链霉素和100 U/mL 青霉素)中,置于恒温培养箱中(37 ℃、5% CO2)。将甲状腺乳头状癌细胞(TPC-1、K1 细胞) 分别分为FoxP4-AS1组(转染FoxP4-AS1 过表达慢病毒载体)和阴性对照组(negative control,NC 组)(转染空载病毒)。慢病毒的构建由上海吉凯基因医学科技股份有限公司完成,其核苷酸序列为:FoxP4-AS1 组:GAG GAT CCC CGG GTA CCG GTC CCT GGT TTT CTG TGG AAA G; NC:CAC ACA TTC CAC AGG CTA GCT GCA CTT TGA TAA CAA TAA ACT C。取对数生长期细胞制备细胞悬液,以5×104个/孔的细胞密度接种于6 孔板中,待细胞贴壁,将配制好的病毒感染液(MOI=100,病毒滴度=1×108TU/mL)加入6 孔板中,置于细胞培养箱中培养12~16 h 后,更换为完全培养基,继续培养72 h,中途可换液。感染72 h 后(细胞汇合度达70%~80%),用嘌呤霉素(2 μg/mL)对细胞进行筛选,倒置荧光显微镜观察细胞感染效率。
1.2.2 RNA 提取及qRT-PCR TRIzol 试剂从细胞中提取总RNA,Nanodrop 2000 测定RNA 的浓度和纯度。取1 μg 总RNA,用LnRcute LncRNA cDNA 第一链合成试剂盒将RNA 逆转录成cDNA,LnRcute LncRNA 荧光定量检测试剂盒和CFX Connect 检测系统进行qRT-PCR 反应。lncRNAFoxP4-AS1 的表达以GAPDH 为内参,采用2-ΔΔCt法计算相对表达量。FoxP4-AS1 引物及内参引物均由上海捷瑞生物工程有限公司设计合成(表1)。 以上实验均重复3 次。

表1 FoxP4-AS1引物及内参引物序列Table 1 The primer sequences of FoxP4-AS1 and internal reference
1.2.3 细胞增殖实验(CCK-8 法) 细胞以5×103/孔的密度接种于96 孔板,在37 ℃、5% CO2的恒温培养箱中培养。转染0、1、2、3、4 d 后,将10 μL CCK-8 试剂加入每个孔中,在37 ℃下孵育1 h。使用酶标仪分别检测0、1、2、3、4 d 的450 nm 处的吸光度。以上实验均重复3 次。
1.2.4 细胞克隆形成实验 制备好细胞悬液后,以1 000 个/孔的细胞密度接种于六孔板中,每组设3 个平行复孔,置于37 ℃培养箱中培养。2 周左右肉眼可观察到细胞克隆团,弃去培养基,以PBS 洗3 次,甲醇固定细胞15 min,晾干后加入苏木素染色30 min,晾干后扫描拍照,计数肉眼可见的细胞克隆团。
1.2.5 EdU 实验 用EdU 检测试剂盒检测细胞的增殖能力。用慢病毒或空载体转染两种PTC 细胞系,以20 000 个细胞/孔的细胞密度接种于24 孔板中,每组设3 个平行复孔。将50 μM EdU 标记培养基加入到24 孔板中,置于培养于37 ℃、5% CO2的环境中孵育2 h。用4%多聚甲醛固定细胞30 min,甘氨酸(2 mg/mL) 洗涤残留的甲醛,用0.5% Triton X-100 脱色摇床孵育10 min。PBS 清洗后,加入抗EdU 工作溶液在室温避光染色30 min,然后用100 μL DAPI 在室温孵育5 min 并在荧光显微镜下进行观察。
1.2.6 细胞侵袭及迁移实验 用Transwell 小室检测细胞的侵袭及迁移能力。转染后的细胞消化,用无血清的RPMI 1640 或DMEM 培养基重悬,添加到涂有Matrigel 基质胶的Transwell 上室(迁移试验不添加基质胶)中,下室加入含10%血清的1640 或DMEM 培养基。小室置于细胞恒温培养箱中培养24 h 后,轻轻除去膜上的细胞,膜下的细胞用甲醇固定,结晶紫染色并计数。
1.2.7 流式细胞术检测细胞周期 制备好细胞悬液后,用PBS 缓冲液洗涤细胞1 次(离心800 r/min,5 min),收集细胞行70%乙醇4 ℃过夜,再离心收集细胞,PBS 重悬,加入提前配制好的500 μL 碘化丙啶(propidium,PI)/核糖核酸酶A(Rnase A)(Rnase A∶PI=1∶9) 染色工作液,室温避光染色30 min 后,经流式细胞仪分析细胞周期。以上实验均重复3 次。
1.2.8 Western blot 收集细胞后,经裂解液裂解,在4 ℃下离心12 000 r/min,30 min 提取蛋白。使用BCA 法测定蛋白浓度后,40 μg 蛋白经12% SDS 聚丙烯酰胺凝胶电泳后,转移至PVDF 膜上,在室温条件下用5% 脱脂牛奶封闭2 h,再加入CDK4/cyclinD1 抗体(1∶1 000)4 ℃孵育过夜。TBST 洗去一抗,HRP 标记 二抗(1∶5 000) 室 温孵育1 h,TBST 洗3 次,通过ECL 化学发光试剂盒显影,以GAPDH (1∶1 000) 作为内参。以上实验均重复3 次。
1.2.9 皮下移植瘤模型的构建 选取4~8 周龄雌性NOD-SCID 小鼠20 只,用耳标钳对小鼠标记,随机将小鼠分为4 组,每组5 只。消化细胞,用生理盐水重悬并调整细胞浓度为5×107个/mL,于小鼠背部皮下注射体积为0.2 mL 的单细胞悬液,接种后每5 天观察1 次,选取适当时间,将实验小鼠处死,取出肿瘤进行后续实验。本实验经贵州医科大学实验动物伦理委员会审批(伦理审批号:No1800829)。
1.2.10 FoxP4-AS1 在甲状腺癌中的功能富集分析下载KEGG 数据库中的GSEA 数据,对FoxP4-AS1 低表达和FoxP4-AS1 高表达的基因组之间的差异通路进行了富集分析。统计出满足标准(P<0.05)的相关信号通路,使用ggplot2 包可视化重要功能及通路。
1.3 统计学处理
分别采用SPSS 22.0 和Graphpad Prism 9.0 统计软件进行统计学分析和绘图,对符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采独立样本t检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 PTC细胞中lncRNA FoxP4-AS1表达水平
通过qRT-PCR 检测人PTC 细胞系(TPC-1、K1细胞)和人正常甲状腺滤泡上皮细胞(Nthy-ori3-1细胞) 中FoxP4-AS1 的表达情况。结果显示:人PTC 细胞系TPC-1、K1 中FoxP4-AS1 的表达水平明显低于人正常甲状腺滤泡上皮细胞Nthy-ori3-1,差异均有统计学意义(0.660±0.078vs.1.000±0.000;0.523±0.006vs.1.000±0.000,均P<0.05)(图1)。
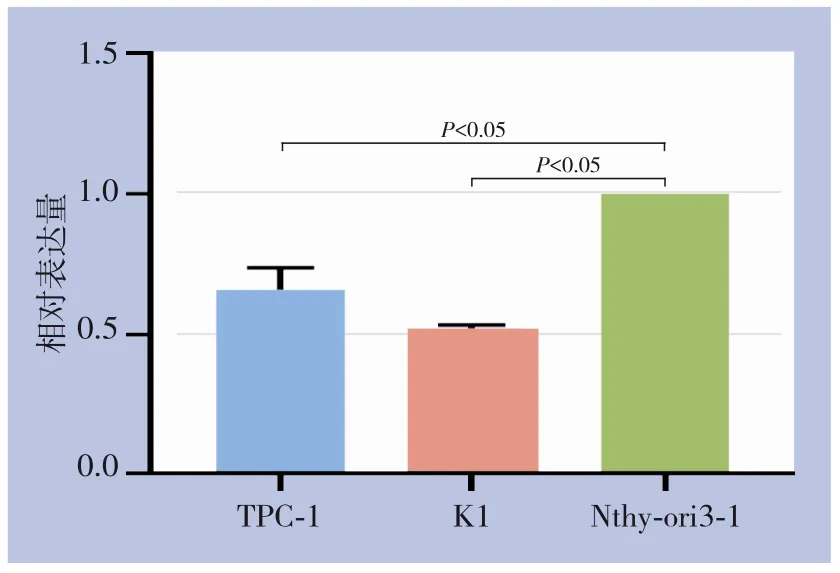
图1 qRT-PCR检测lncRNA FoxP4-AS1表达Figure 1 qRT-PCR detection of lncRNA FoxP4-AS1 expression
2.2 慢病毒稳定转染结果
为探讨FoxP4-AS1 在PTC 细胞中的生物学功能,通过慢病毒转染实验将FoxP4-AS1 过表达慢病毒转染到TPC-1、K1 细胞中,qRT-PCR 检验转染效能。结果显示,转染FoxP4-AS1 过表达慢病毒(FoxP4-AS1 组) 后,TPC-1、K1 细胞的FoxP4-AS1表达水平明显升高,与NC 组相比,差异有统计学意义(0.440±0.026vs.1.000±0.000;0.273±0.021vs.1.000±0.000,均P<0.01)(图2)。

图2 qRT-PCR检测转染效果Figure 2 qRT-PCR detection of transfection effect
2.3 FoxP4-AS1对PTC细胞增殖能力的影响
细胞增殖实验(CCK-8 法)、细胞克隆形成实验、EdU 实验结果均显示:慢病毒转染过表达FoxP4-AS1 后,TPC-1、K1 细胞的增殖能力明显降低,差异有统计学意义(均P<0.05)(图3)。
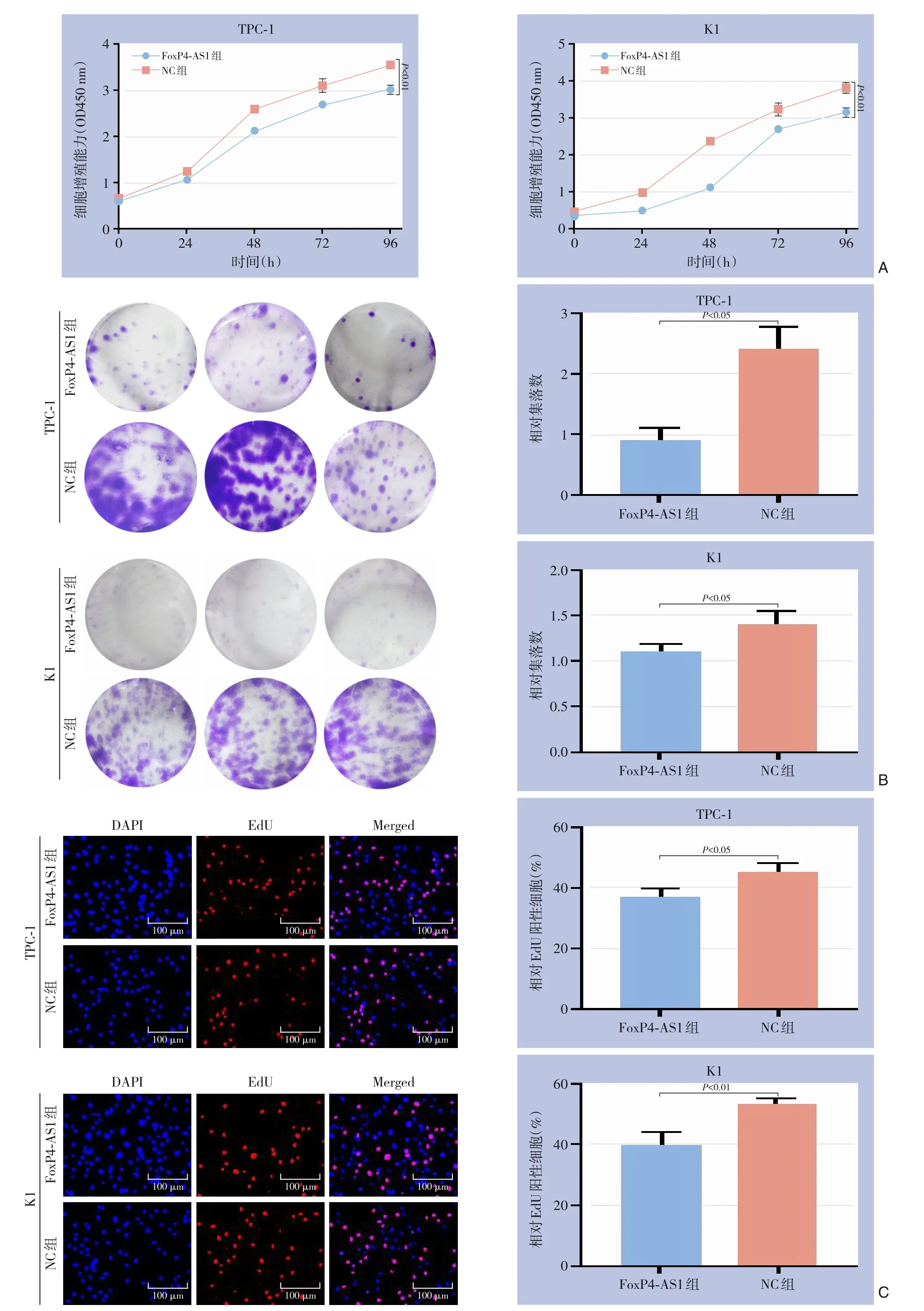
图3 细胞的增殖能力检测 A:CCK-8实验;B:细胞克隆形成实验;C:EdU实验Figure 3 Detection of cell proliferative capacity A:CCK-8 assay;B:Colony formation assay;C:EdU incorporation assay
2.4 FoxP4-AS1 对PTC 细胞侵袭和迁移能力的影响
Transwell 实验结果显示:使用慢病毒稳定转染技术过表达FoxP4-AS1 后,与NC 组相比,TPC-1、K1 细胞的侵袭和迁移能力明显降低,差异有统计学意义(均P<0.05)(图4)。

图4 Transwell实验检测PTC细胞的迁移和侵袭能力Figure 4 Transwell assay for detecting the migration and invasion abilities of PTC cells
2.5 流式细胞术检测细胞周期
细胞周期实验结果显示:通过转染使TPC-1、K1 细胞的FoxP4-AS1 表达上调,采用流式细胞术检测两种细胞周期情况。结果显示,过表达FoxP4-AS1 后,细胞周期阻滞在G0/G1期,差异有统计学意义(P<0.01)(图5)。

图5 流式细胞术检测PTC细胞的细胞周期Figure 5 Detection of cell cycle of PTC cells by flow cytometry
2.6 GEPIA数据库和LncTar网站的分析
GEPIA 数据库的预测信息显示,仅CDK4 在甲状腺癌和癌旁(thyroid carcinoma,THCA) 中有较为明显的差异,在CDK2 和CDK6 中无明显差异。LncTar(http://www.cuilab.cn/lnctar)网站通过FASTA格式预测FoxP4-AS1 与CDK4 的潜在相互作用靶点,结果显示,FoxP4-AS1 与CDK4 存在多个潜在的相互作用靶点,且结合较牢固(图6)。

图6 GEPIA数据库和LncTar网站分析FoxP4-AS1与CDK4潜在的相互作用靶点Figure 6 Analysis of the potential interaction targets of FoxP4-AS1 and CDK4 using the GEPIA database and LncTar website
2.7 Western blot检测转染后的PTC细胞中CDK4/cyclinD1表达情况
通过慢病毒过表达TPC-1、K1 细胞中的FoxP4-AS1 表达水平,采用Western blot 检测CDK4/cyclinD1表达情况。结果显示,过表达FoxP4-AS1 后,CDK4/cyclinD1 明显减少,差异有统计学意义(P<0.01)(图7)。
2.8 皮下移植瘤模型的构建
NOD-SCID 小鼠饲养于SPF 级的环境中,待小鼠适应环境,5 d 后于皮下接种细胞,30 d 后处死小鼠,每5 天对小鼠及瘤体进行观察和测量。结果显示:过表达FoxP4-AS1 后,皮下移植瘤大小及体积明显缩小。HE 染色显示:肿瘤细胞胞质稀疏,胞核形态各异,肿瘤为PTC。免疫组织化学染色实验结果表明:过表达FoxP4-AS1 后,Ki-67表达明显减少(图8)。

图8 皮下移植瘤实验 A:瘤体大小及体积;B:HE染色(×100);C:免疫组织化学染色法检测Ki-67的表达(×100)Figure 8 Subcutaneous tumor transplantation model A:Tumor size and volume; B: HE staining (×100); C:The expression of Ki-67 detected by immunohistochemical staining(×100)
2.9 TC中FoxP4-AS1的功能富集分析
基于KEGG 数据库,对FoxP4-AS1 低表达和FoxP4-AS1 高表达的基因组之间的差异通路进行了GSEA 富集分析,PI3K-Akt-mTOR 通路、细胞周期、细胞凋亡、免疫调节相互作用在FOXP4-AS1 低表达组中被富集(图9A-D);DNA 甲基化、氧化应激通路等在FOXP4-AS1高表达组中被富集(图9E-F)。

图9 通路富集分析 A:PI3K-Akt-mTOR 通路;B:细胞周期;C:细胞凋亡;D:免疫调节相互作用;E:DNA 甲基化;F:氧化应激通路Figure 9 Pathway enrichment analysis A: PI3K-Akt-mTOR pathway; B: Cell cycle; C: Apoptosis; D: Immunomodulatory interactions;E:DNA methylation;F:oxidative stress pathway
3 讨 论
近年来随着B 超、细针穿刺活检技术的普及,PTC 的发病率逐年升高,且逐渐趋向年轻化[18]。尽管PTC 的治疗手段取得了长足的进步,但PTC 患者的复发率和癌症相关病死率并没有明显改善[19]。因此,寻找PTC 有效的分子生物标志物和治疗靶点是十分必要的。
lncRNA 是肿瘤发生发展的重要调控因子。它是一类长度超过200 个核苷酸,大小在200 bp 到100 kb 之间,且无编码蛋白质能力的转录物[20]。许多研究表明lncRNA 对肿瘤的发生发展中起着关键作用[21],通过多种方式参与调控细胞生物学过程,促进或抑制肿瘤发生与进展[22]。研究[23]发现lncRNA 是多种生物调节活性的主要调控因子,如基因表达、剂量补偿、等位基因印迹和基因组包装等。随着人们对lncRNA 研究的深入,越来越多的证据表明lncRNA 表达失调对肿瘤的发生发展发挥至关重要的作用,它们的表达失调与恶性肿瘤的发生、侵袭和转移有关[24-26],lncRNA FoxP4-AS1是其中研究相对较少的基因。已有研究[9-16]证明FoxP4-AS1 在许多恶性肿瘤中高表达,其高表达预示着预后不良。而在甲状腺乳头状癌中,已有文献[17]表明,FoxP4-AS1 在PTC 中表达明显降低,其低表达是PTC 区域淋巴结转移的独立危险因素,但其对PTC 细胞生物学行为的影响及其作用机理目前尚不明确。
因此,本实验在此基础上继续研究,首先通过qRT-PCR 检测lncRNA FoxP4-AS1 在PTC 细胞和人甲状腺正常滤泡上皮细胞中的表达水平,通过慢病毒稳定转染技术对PTC 细胞(TPC-1 细胞和K1 细胞)进行FoxP4-AS1 过表达,qRT-PCR 检测其转染效能;同时探究FoxP4-AS1 对PTC 细胞生物学行为的影响。此外,通过生信分析预测FoxP4-AS1 与CDK4 之间的潜在作用靶点,并通过Western blot 进行验证,同时进行动物实验验证。研究发现,FoxP4-AS1 在PTC 细胞中表达下调,这与汤蕊等[17]研究结果一致。过表达FoxP4-AS1 后,CCK-8 实验和细胞克隆形成实验均显示FoxP4-AS1 组的增殖能力降低,这提示FoxP4-AS1 可抑制PTC 的增殖。同时EdU 实验结果表明:在TPC-1 细胞和K1 细胞中,FoxP4-AS1 组的细胞数目(带红色荧光)较NC 组来说是减少的,说明上调FoxP4-AS1 表达可抑制两种细胞的增殖能力,进一步证明FoxP4-AS1 能够抑制PTC 细胞增殖。此外,上调FoxP4-AS1 后,Transwell实验结果显示:两种细胞的侵袭和迁移能力明显降低,提示FoxP4-AS1 可以降低PTC 的侵袭性,可以作为PTC 的一个保护性因素。增殖作为癌细胞的重要特性,由于肿瘤细胞周期失控,增殖无极限性,是导致恶性肿瘤复发的重要原因[27]。因此我们通过流式细胞术检测PTC 细胞的周期,结果表明:过表达FoxP4-AS1 后,细胞周期阻滞在G0/G1期。由于CDK 是调控细胞周期的一个关键物质,它是通过对其他蛋白质的化学修饰来驱动整个细胞周期的,而cyclin 具有调控CDK 的功能,且通常以cyclin/CDK 复合物的形式发挥作用,CDK 和cyclin 相互配合能更有效地控制整个细胞周期的全过程[28]。细胞周期的失调会导致一系列的疾病,如癌症、神经退行性疾病和中风等[29-30]。因此,本研究使用GEPIA 数据库预测CDK2/4/6 在THCA 中的表达,发现仅CDK4 在THCA 中的表达有差异,而CDK2 和CDK6 则没有明显差异,LncTar 网站分析显示FoxP4-AS1 与CDK4 之间存在潜在的相互作用靶点,且结合较牢固,提示FoxP4-AS1 可能直接与CDK4 相互结合而发挥作用。因在细胞周期的调控过程中,CDK4 通常与cyclinD1 结合发挥作用[31],因此,通过Western blot 实验检验FoxP4-AS1 与CDK4 之间的相关性发现,上调FoxP4-AS1 后,CDK4/cyclinD1 表达减少,提示FoxP4-AS1 可能负向调控CDK4/cyclinD1,进而抑制细胞增殖。通过建立NOD-SCID 小鼠异种移植瘤模型,发现过表达FoxP4-AS1 后,NOD-SCID 小鼠所成肿瘤的大小和体积均明显降低,且Ki-67 表达减少,提示FoxP4-AS1可能作为一个保护性因素在PTC 中发挥作用。甲状腺癌中FoxP4-AS1 的功能富集分析显示,PI3KAkt-mTOR 通路、细胞周期、细胞凋亡、免疫调节相互作用在FoxP4-AS1 低表达组中被富集,与细胞功能学实验结果相一致。提示FoxP4-AS1 通过细胞周期发挥作用。
综上所述,FoxP4-AS1 在PTC 中发挥抑癌基因作用,过表达FoxP4-AS1 后,CDK4/cyclinD1 表达减少,抑癌作用增强,FoxP4-AS1 在PTC 中可能通过负向调控CDK4/cyclinD1 的表达发挥抑癌作用,且具有一定的抑制PTC 细胞增殖、侵袭和迁移的能力,有望成为PTC 治疗的潜在临床靶点。
利益冲突:所有作者均声明不存在利益冲突。
