智能化辅助调药系统在甲状腺乳头状癌患者术后内分泌抑制治疗中的应用
2022-06-08陈承坤陶玄斌张颖超邓先兆郭伯敏丁政李鸣周健包玉倩沈力郑元义樊友本
陈承坤,陶玄斌,张颖超,邓先兆,郭伯敏,丁政,李鸣,周健,包玉倩,沈力,郑元义,樊友本
(上海交通大学附属第六人民医院1.甲乳疝外科/上海交通大学甲状腺疾病诊治中心2.内分泌代谢科3.临床研究中心,上海 200233;4.上海交通大学超声医学研究所,上海 200233)
甲状腺癌是最常见的内分泌系统肿瘤[1],其发病率在国内外均呈逐年上升趋势[2],我国国家癌症中心数据[3]显示,甲状腺癌发病率已达14.6/10 万,术后5年生存率(84.3%)位居各类肿瘤之首。甲状腺癌中以甲状腺乳头状癌(papillary thyroid carcinoma,PTC)最为常见(90.2%)[4],PTC 患者术后需要长期[5]的促甲状腺激素(thyroid stimulating hormone,TSH) 抑制治疗,以减少疾病的复发转移,提高长期生存率。而TSH 抑制治疗要求患者频繁、定期地复查相关指标[5-6],这直接增加了门诊随访工作量。然而,在临床实践中发现相当一部分患者术后并未得到合适的TSH 抑制治疗。患者对频繁随访的懈怠和不同医师对TSH 抑制目标的理解差异可能是其中的重要原因。关于TSH 抑制治疗的研究当前集中于低危PTC 患者是否应接受TSH 抑制治疗[7-10]以及TSH 抑制治疗相关的副作用方面[11-13],而在术后规范TSH 抑制治疗、简化随访流程和节约医疗费用方面尚缺乏相关的研究报道。
因此,本中心根据当前的相关指南与文献,并结合当前互联网医疗的优势,探索性研究了PTC术后TSH 抑制治疗过程中药物调整管理的新路径,研发了PTC 患者术后TSH 抑制治疗的自动化辅助调药软件系统,以期规范和便利开展PTC 患者术后长期高效随访,减少用药不当带来的风险和副作用。现将研究结果报告如下。
1 资料与方法
1.1 临床资料
本研究纳入2021年2月—2022年1月间在上海交通大学附属第六人民医院甲乳疝外科随访的PE患者。指南[14]中指出,PTC 术后1年内为初治期,术后1年以上为随访期。本研究根据患者术后复查时间的长短分为初治期组和随访期组,其中初治期组97 例患者,随访期组50 例患者。患者于门诊就诊时被招募入组,在入组前均由临床医师调药。记录入组时患者的临床数据,包括一般资料[性别、年龄、体质量指数(BMI)]、手术范围、复发风险分层;调药时记录的参数指标包括:术后复查时间、甲状腺功能指标、甲亢或甲减相关症状发生例数、调药达标(即TSH 值处于目标范围内)例数,并以入组时记录的指标作为第1 次复查参数指标。智能化辅助系统的调药程序指在记录入组时医师调药结果的基础上进行随后的两次计算机辅助调药。
完成入组后,首先在调药系统中输入患者入组时的数据,调药系统即可生成新的用药方案(此次为第1 次应用系统进行调药),患者按照系统提供的方案适当调整左旋甲状腺素(商品名:优甲乐,50 μg,德国默克公司)的口服剂量,直至第2 次复查。相邻两次复查时间间隔安排:调整了优甲乐剂量的患者间隔4~6 周后复查,未调整剂量的患者3 个月后再复查。在患者第2 次复查时,同法记录相关指标,并应用系统再次生成新的调药方案(此次为第2 次应用系统进行调药),患者按照系统提供的方案再适当调整口服优甲乐的剂量,直至第3 次复查,复查时间间隔同前。患者完成第3 次复查时,即视为完成本研究的调药随访(图1)。

图1 患者参与系统调药流程图Figure 1 Flowchart of patient participation in adjuvant medicine regulation system
完成随访后,分别比较分析两次系统调药结果与系统调药前的医师调药结果之间的达标率(达标率=调药后的TSH 值处于目标范围内的患者人数/参与调药患者的人数×100%),以及患者甲亢或甲减相关症状的发生率。进一步根据患者的性别(男、女)、BMI(过低:<18.5 kg/m2;正常范围:18.5~<24 kg/m2;过高:≥24 kg/m2)、手术范围(单侧甲状腺切除术、双侧甲状腺切除术)、复发风险(低危、中高危)进行亚组比较分析。
入选标准:⑴年龄:16~80 岁;⑵体质量:40~125 kg;⑶术后病理证实为甲状腺乳头状癌。排除标准:⑴临床信息不完整;⑵精神疾病患者;⑶伴发严重基础性疾病;⑷伴发其他甲状腺癌病理类型;⑸妊娠状态。所有患者均知情并同意此次研究,本研究获得我院伦理委员会的批准(2021-014)。
1.2 调药系统设计
根据2015 版美国甲状腺协会(American Thyroid Association,ATA) 指 南[15]和2012 版中国《甲状腺结节和分化型甲状腺癌诊治指南》[14]设计调药系统,初治期术后复发风险分层为高危、中危、低危(表1),对应患者的目标TSH 范围分别为:0.03~<0.1 mU/L、0.1~<0.5 mU/L、0.5~2 mU/L。智能化辅助调药系统在TSH 参考范围(0.5~4.5 mU/L)的基础上设计为:<0.03 mU/L、>2~<4.5 mU/L、≥4.5 mU/L 3 个区间范围(表2)。再根据动态风险评估和副作用风险分层(表3),随访期患者的TSH 目标范围设定:0.03~<0.1 mU/L,0.1~<0.5 mU/L和0.5~2 mU/L(表4)。根据患者实测的TSH 值所在的区间与TSH 应在的目标区间之间相差的区间数乘以12.5 μg/d,生成优甲乐药物剂量增减的调药方案,当实测TSH 值小于目标范围值,则减少优甲乐药量,反之则增加;如当相差区间数>2 时,鉴于单次调药剂量过大可能会增加患者的不良反应风险,系统均生成每天增加或减少25 μg 优甲乐的调药方案或建议门诊医师调药。

表1 PTC患者术后TSH抑制治疗初治期复发风险分层Table 1 Recurrence risk stratification of patients undergoing TSH suppression therapy after operation for PTC

表2 PTC术后初治期TSH抑制目标范围(mU/L)Table 2 The target range of TSH suppression for PTC patients in postoperative initial treatment stage(mU/L)

表3 PTC患者术后副作用风险分层Table 3 Risk stratification of adverse effects in PTC patients after operation

表4 PTC患者术后随访期TSH抑制目标范围(mU/L)Table 4 The target range of TSH suppression for PTC patients in postoperative follow-up stage(mU/L)
调药系统的目标区间范围下限设置为0.03 mU/L[16-18],因为过低的抑制并不减少复发率,相反可能会增加副作用。初治期患者全甲状腺切除或近全甲状腺切除术后,当血清中几乎测不到Tg 时,TSH 抑制的目标范围设定为0.5~2 mU/L,调药系统限定Tg<0.2 ng/mL[19-21];当测到低水平Tg 时,TSH 抑制的目标范围设定为0.1~<0.5 mU/L,调药系统限定Tg 0.2~<10 ng/mL[22-23]。系统调药校正:在调药系统的查询调药界面会有甲亢症状(如:心慌、心律失常、多汗、心悸、气急、性格急躁、失眠、体重明显减轻等)、甲低症状(如:乏力、倦怠、水肿、体质量明显增加等)的提示供患者判断,患者可以根据自身情况进行选择。患者主诉有甲亢症状的,在TSH 数值达标或大于目标区间范围时,指导患者在系统调药的基础上每天再额外减12.5 μg的优甲乐,而有甲减症状的,在TSH 数值达标或小于目标区间范围时,则每天再额外加12.5 μg 的优甲乐(图2)。

图2 调药系统设计流程图Figure 2 Flow chart of the design process of the dose adjustment system
将设计好的调药规则编辑成计算机语言,结合网络服务器、客户端与用户终端形成调药系统。服务器用于存储系统用户的账户信息、病理信息和术后复查信息;客户端部署在一上位机上,与服务器之间建立数据交互,客户端设有评估模块和药量调整模块,评估模块用于确定患者复查的TSH 目标范围,药量调整模块可以结合TSH 目标范围和患者实际检测的TSH 值,自动确定新的优甲乐服药量;用户终端,部署在一移动设备上,可用于接收显示新的服药量,用户终端与客户端之间采用无线数据交互(图3)。

图3 调药系统架构示意图Figure 3 Illustration of the framework of the dose adjustment system
1.3 调药系统操作
患者输入网址: http://www.cnuca.com/web/fybphp7415/fybindex.php,屏幕会出现查询调药界面,在该界面患者可以输入最近一次的TSH 检查结果,并点击提交给医生审核调药,同时可以输入身份证号查询医生的调药建议。初次使用调药系统的患者需要点击页面上方“新患者第一步”,随后屏幕会出现录入基础信息界面,在该界面输入相关基本信息并提交医生审核后,患者可以使用调药查询界面进行调药方案的查询。医生在患者提交信息后,会在系统后台进行信息确认,并能查看系统生成的调药方案、调药参考指标以及注意事项,患者输入身份证号后可以查询医生确认过的调药方案。
1.4 统计学处理
对正态分布的计量资料以均数±标准差(±s)表示,组间比较使用独立样本t检验;非正态分布的计量资料以中位数(四分位间距)[M(IQR)]表示,采用Wilcoxon 符号秩和检验或Mann-WhitneyU检验。计数资料以频数和百分比[n(%)]表示,采用χ2检验或Fisher 确切概率法或McNemar's 检验检验,检验水准α=0.05。采用SPSS 25.0 软件进行数据分析。
2 结 果
2.1 患者一般资料
初治期患者共纳入99 例,剔除2 例,其中1 例自行调整药量,另1 例因甲亢症状明显而不能耐受系统调药剂量。97 例完成了随访与调药患者中,男18例,女79例;平均年龄(36.1±8.7)岁;平均BMI(22.7±3.1)kg/m2;单侧甲状腺腺叶切除55 例,双侧甲状腺腺叶全切除42 例;复发风险分层中低危34 例,中危56 例,高危7 例。随访期患者纳入50 例,均完成随访与调药,男9 例,女41 例;年龄(41.3±9.7) 岁,BMI (23.0±3.0) kg/m2;单侧甲状腺腺叶切除31 例,双侧甲状腺腺叶全切除19 例;复发风险分层中低危40 例,中危10 例(表5)。
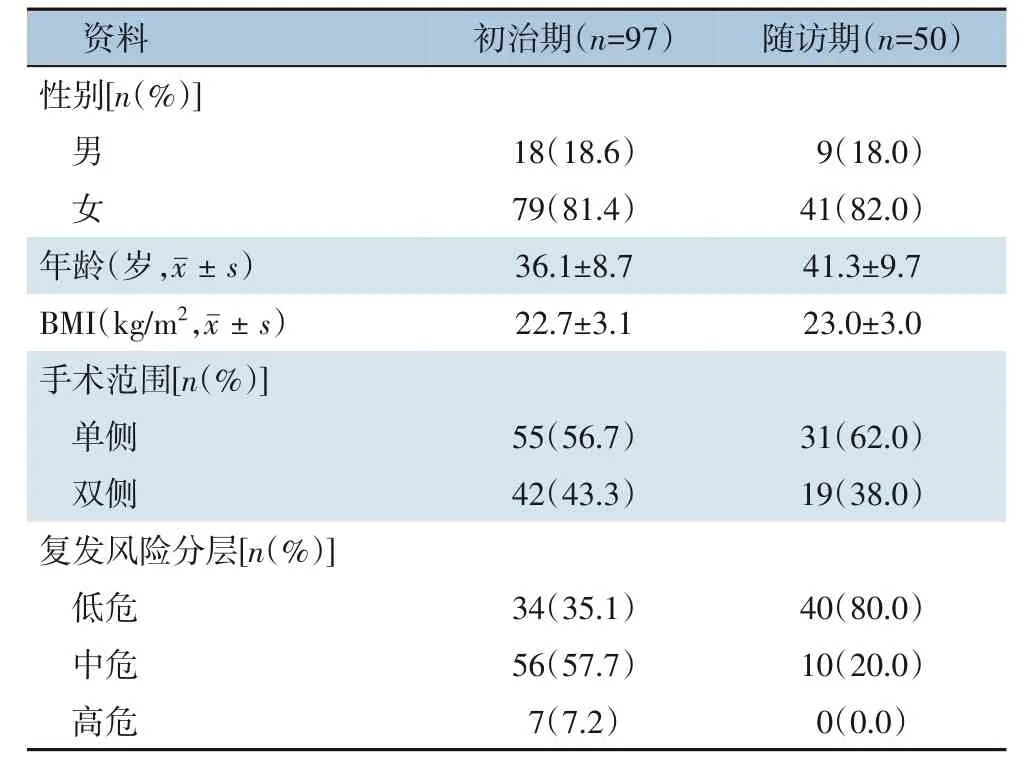
表5 患者一般资料Table 5 The general data of patients
2.2 患者调药结果
2.2.1 总体调药结果 初治期患者医师调药的结果显示复查中位数时间为术后2.7 (1.5~5.4) 个月,TSH 为0.6 (0.2~1.4) mU/L,系统第1 次调药的结果显示复查中位数时间为4.8 (3.4~7.8) 个月,TSH 为0.5 (0.2~0.9) mU/L,系统第2 次调药的结果显示复查中位数时间为8.5 (6.1~10.8) 个月,TSH 为0.4(0.2~1.0)mU/L。甲亢或甲减相关症状发生的例数为:医师调药有9 例(9.3%),第1 次系统调药有7 例(7.2%),第2 次系统调药有4 例(4.1%),两次系统调药与医师调药之间的甲亢/甲减相关症状发生率差异均无统计学意义(P=0.791、P=0.267)。医师调药达标33 例(34.0%),第1 次系统调药达标56 例(57.7%),第2 次系统调药达标62 例(63.9%),两次系统调药与医师调药达标率差异均具有统计学意义(P=0.001、P<0.001)(表6)。随访期患者中医师调药的结果显示复查中位数时间为术后22.8 (16.7~34.7) 个月,TSH为0.6(0.2~1.7)mU/L,系统第1 次调药的结果显示复查中位数时间为24.8(19.9~39.2)个月,TSH为0.8(0.4~1.2)mU/L,系统第2 次调药的结果显示复查的中位数时间为27.9 (24.5~43.0) 个月,TSH 为1.1(0.6~1.6)mU/L。甲亢或甲减相关症状发生例数为:医师调药有7 例(14.0%),第1 次系统调药有2 例(4.0%),第2 次系统调药有2 例(4.0%),两次系统调药与医师调药之间的甲亢/甲减相关症状发生率差异均无统计学意义(P=0.180、P=0.180)。医师调药达标18 例(36.0%),第1 次系统调药达标25 例(50.0%),第2 次系统调药达标33 例(66.0%),第1 次系统调药与医师调药达标率差异无统计学意义(P=0.143),第2 次系统调药与医师调药达标率差异具有统计学意义(P=0.007)(表7)。
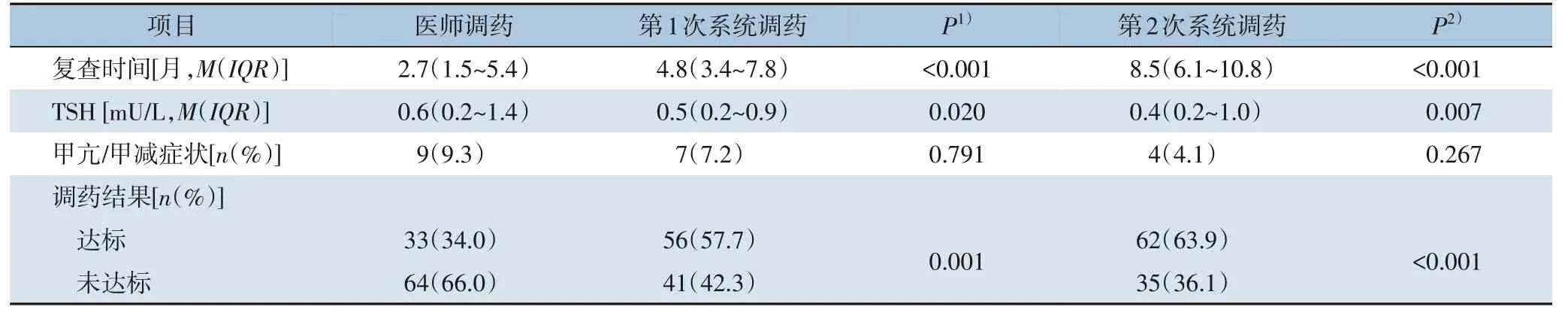
表6 初治期患者医师调药与系统调药结果比较Table 6 Comparison of the results between physician's adjustment and system adjustments of patients in initial treatment stage

表7 随访期患者医师调药与系统调药结果比较Table 7 Comparison of the results between physician's adjustment and system adjustments of patients in follow-up stage
2.2.2 亚组分析结果 进一步分析各因素对系统调药达标率的影响,结果显示在初治期患者中,两次系统调药在女性患者组、体质量正常组(BMI 18.5~<24 kg/m2) 以及体质量过高组(BMI≥24 kg/m2)均较医师调药达标率有明显提高(均P<0.05)。在单侧甲状腺切除患者组中,第2 次系统调药较医师调药达标率有明显提高(P=0.001),在双侧甲状腺切除患者组中,两次系统调药较医师调药达标率均有明显差异(均P<0.05)。在中高危患者组中,两次系统调药较医师调药达标率均有明显差异(均P<0.05),而在低危患者组中,两次系统调药较医师调药达标率差异均无统计学意义(均P>0.05)(表8)。对于随访期患者,在体质量过高组,第1 次系统调药较医师调药达标率差异有统计学意义(P=0.031)。在单侧甲状腺切除患者组,第2 次系统调药较医师调药达标率差异有统计学意义(P=0.049),而在双侧切除组,两者差异无统计学意义(P=0.049)。在低危患者组,第2 次系统调药较医师调药达标率差异有统计学意义(P=0.004),而在中高危组,两者差异无统计学意义(P=1.000)(表9)。

表8 初治期患者医师调药与系统调药分层分析[n=97,n(%)]Table 8 Stratification analysis of the results between physician's adjustment and system adjustments of patients in initial treatment stage[n=97,n(%)]

表9 随访期患者医师调药与系统调药分层分析[n=50,n(%)]Table 9 Stratification analysis of the results between physician's adjustment and system adjustments of patients in follow-up stage[n=50,n(%)]
2.2.3 初治期与随访期调药结果比较 TSH 达标率和甲亢或甲减相关症状发生率方面,医师调药及两次系统调药在初治期患者组和随访期患者组之间差异无统计学意义(TSH 达标率:P=0.811、P=0.372、P=0.802;甲亢/甲减:P=0.384、P=0.684、P=1.000)。两组的TSH 指标经医师调药后差异无统计学意义(P=0.602),而两组第1 次系统调药(P=0.028) 及第2 次系统调药(P<0.001) TSH 指标差异均有统计学意义(表10)。

表10 初治期与随访期调药结果比较Table 10 Comparison of the results of dose adjustments between patients in initial treatment stage and follow-up stage
3 讨 论
大部分PTC 患者术后预后良好,生存期长,术后进行合适的TSH 抑制治疗对PTC 患者预后十分重要。本研究中初治期患者中医师调药达标率为33.0%,随访期患者中医师调药达标率为36.0%,总体上医师调药达标率不高,这也验证了笔者在临床实践中发现的问题。除了前文所述的客观因素外,也可能由于不同的临床医生对于相关指南的不遵循所致[24],《分化型甲状腺癌术后管理中国专家共识(2020 版)》[6]是国内继2012年版《甲状腺结节和分化型甲状腺癌诊治指南》[14]以来最新的关于PTC 术后TSH 抑制治疗的共识文献,而且相关内容也和2015 版ATA 指南[15]相一致。因此,本研究中的调药系统在结合最新指南文献知识及统一调药标准方面具有一定的优势。
从总体的调药结果上看,患者在入组前已经经过医师调药一段时间,两组患者在应用系统调药后达标率均明显提升。初治期部分患者虽然经医师调药的时间较短,但第1 次系统调药后达标率在较短时间内提升。同时从随访期患者的调药结果看,应用系统调药的时间远少于医师调药的时间,且达标率也明显提升,证明调药系统在提升TSH 达标率的性能方面具有优势。两组患者主诉甲亢或甲减相关症状发生率在系统调药及医师调药无明显差异,结果初步说明系统调药具有与医师调药相同的准确性及安全性。
亚组分析的结果显示,在初治期,系统调药在女性患者达标率的提高方面效果更为明显,这可能由于本研究中女性患者占比更高所致,亦不能排除女性患者发病率约为男性患者的3 倍[3]这一客观因素的影响。系统调药能提高初治期中高危患者的达标率(从20.6%提升至58.7%)。相比于复发风险低危的患者,复发风险中高危的患者更需要精准控制TSH 水平[25-27],尤其是在初治期,TSH控制水平更应相对严格。
动态双风险分层这一概念最先在2008年被提出[28-29],之后被纳入最新的指南与共识[6,15],其目的是针对随访期患者进行更加合理、个体化地调药。特别是复发风险中高危患者,如果手术1年后为良好反应,则可以适当放宽TSH 抑制治疗水平,无需按初治期标准严格控制。同时TSH 抑制治疗应该持续至少5~10年[30-32],在长期的服药治疗过程中,合理放宽TSH 抑制水平可减少患者服用药量,进而减少药物副作用风险,提高患者长期生活质量[7,30]。从两组患者调药结果看,系统调药与医师调药在初治期与随访期患者的调药达标率及安全性方面均无明显差异。医师调药的TSH 指标从初治期到随访期没有明显变化,而系统调药的TSH 指标从初治期到随访期有明显提高,说明系统调药更符合动态双风险分层的概念,能够合理地减少患者服药量,减少药物副作用风险。
虽然近年对复发风险低危患者是否进行TSH抑制治疗存在一定争议[7-10,33],然而,根据2021年的一项调查结果[34]显示,大多数医生仍推荐PTC 术后进行TSH 抑制治疗,且更多的临床数据支持TSH抑制治疗的效果[35-37],因此,笔者团队认为应致力于将PTC 患者术后的TSH 抑制水平调至合理的范围。
综上,系统调药相比于医师调药在PTC 术后的随访与调药过程中有其优势,在临床实践中作为一种辅助手段,帮助医师给出调药参考建议,有助于更好地服务于患者,同时也适当减轻医师的门诊负担和患者的医疗费用。系统调药借助大数据的平台,促进互联网医院发展,方便患者异地就诊,也有助于长期监测指标,及时发现问题,且便于统一标准,提高随访质量,具有一定的科研和临床意义。
利益冲突:所有作者均声明不存在利益冲突。
