结核分枝杆菌Rv2941蛋白抗原表位集中区免疫原性研究
2022-06-08范雪亭栾秀丽赵秀芹李马超万康林卢选成李晓燕刘海灿
范雪亭,栾秀丽,赵秀芹,李马超,万康林,卢选成,李晓燕,刘海灿
结核病(Tuberculosis, TB)是由结核分枝杆菌(Mycobacteriumtuberculosis, Mtb)引起的一种人兽共患病。它仍然是世界上传染病中致命的主要原因之一,对人类健康造成巨大威胁[1-2]。据估计,全世界约1/4的人感染过结核,每年约150万人死于结核病[3]。随着耐药结核菌感染以及HIV合并感染的出现,使得结核病的防治面临更加严峻的挑战。
目前,预防和控制传染病最有效的方法是有效疫苗的预防接种。卡介苗(Bacillus Calmette Guérin,BCG)仍然是唯一批准用于人预防结核病的疫苗。有研究结果显示,接种BCG可以有效预防儿童结核病,同时也可以为麻风病患者提供结核病保护[4-5]。BCG的保护效果可以持续5~10年,可能更长。但是,BCG对于预防成人结核分枝杆菌的感染以及结核病复发的效果具有较大差异,从0~80%不等[6-8],以致认为无保护效果。因此,新型结核病疫苗及其免疫策略的研发变得十分迫切。国内外大量的研究者致力于寻找更为有效的结核病疫苗,主要包括以下几种类型:①活菌疫苗,主要有重组BCG和结核分枝杆菌减毒活疫苗;②亚单位疫苗,主要有病毒载体疫苗、蛋白疫苗等;③灭活疫苗等。
Rv2941又名fadD28,属于结核分枝杆菌脂肪酰基AMP连接酶(fatty-acyl AMP ligase,FAAL)家族蛋白,与结核分枝杆菌毒力相关[9]。目前,国内外关于该抗原的研究较少,对其生物学功能了解较少。本研究将Rv2941的T细胞表位集中区(命名为Rv2941p)在大肠杆菌中表达,同时与佐剂PolyI:C和DDA混合免疫BALB/c小鼠,评价其免疫原性,旨在为筛选新型结核病疫苗优势候选抗原提供依据。
1 材料与方法
1.1 菌株与质粒 本实验中所用的大肠杆菌菌株DH5α和BL21(DE3)感受态购买自北京全式金生物技术有限公司,所用载体pET32a由本实验室保存。
1.2 实验动物 本实验所用动物为6~8周龄SPF级BALB/c购买自斯贝福(北京)生物技术有限公司。所有动物实验均在中国疾病预防控制中心实验动物中心完成。
1.3 培养基及主要试剂 大肠杆菌使用LB培养基(1%胰蛋白胨,0.5%酵母提取物,1%氯化钠,固体培养基中添加1.5%~2%琼脂粉)培养。蛋白纯化所用Ni-NTA填料购买自GE Healthcare公司;HRP标记的羊抗鼠二抗(IgG、IgG1、IgG2a)购买自Biotech公司;淋巴细胞分离液购买自达科为生物技术有限公司;蛋白转运抑制剂(GolgiPlugTM Brefeldin A)、FITC标记的抗CD3抗体、BV421标记的抗CD4抗体、APC-Cy7标记的抗CD8抗体、PE-CF594标记的抗IL-4抗体、PE-Cy7标记的抗IFN-γ抗体以及BV650标记的抗TNF-α抗体均购自BD公司;免疫佐剂DDA和PolyI:C购买自Sigma公司。
1.4 重组质粒的构建 利用IEDB检索结核分枝杆菌Rv2941(NCBI Gene ID:887454)基因T细胞表位集中区,选取表位集中区用于后续实验。该段基因由生工生物合成连接至pET32a载体,命名为pET32a-2941p,用于后续实验。
1.5 重组蛋白的表达与纯化 将构建成功的重组质粒pET32a-2941p转化至大肠杆菌BL21(DE3)感受态细胞中。挑取单克隆于含有氨苄青霉素的LB液体培养基中,37 ℃培养过夜后,按照1∶1 000的比例转接至300 mL培养基中,当培养液OD值到达0.6~0.8时,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG), 37 ℃震荡培养4 h。
将培养后菌液4 000 r/min 离心10 min收集菌体。将菌体用普通裂解液(10 mmol/L pH8.0 Tris-HCl,10% TritonX-100)重悬后,超声破碎10 min后12 000 r/min离心10 min。离心后上清用Ni亲和层析纯化,具体操作如下:上清中加入终浓度为500 mmol/L的NaCl后上样于处理后的Chelating Sepharose Fast Flow层析介质中,待上样完成后分别用含有30 mmol/L、60 mmol/L以及300 mmol/L咪唑的平衡液洗脱,洗脱液用SDS-PAGE电泳分析。将纯化后的抗原利用BCA法检测蛋白质浓度,-20 ℃保存备用。
1.6 动物免疫及抗体检测 实验选用SPF级6~8周龄的BALB/c 雌性小鼠,随机将20只小鼠分成4组,每组5只小鼠,分别为PBS对照组、单独佐剂组、Rv2941p混合佐剂组以及阳性对照组(Ag85B混合佐剂),具体分组见表1。本研究选用DDA以及PolyI:C作为免疫佐剂,使用方法为抗原与佐剂按照体积1∶1混匀后乳化,经皮下多点免疫方式免疫3次,间隔周期为10 d。
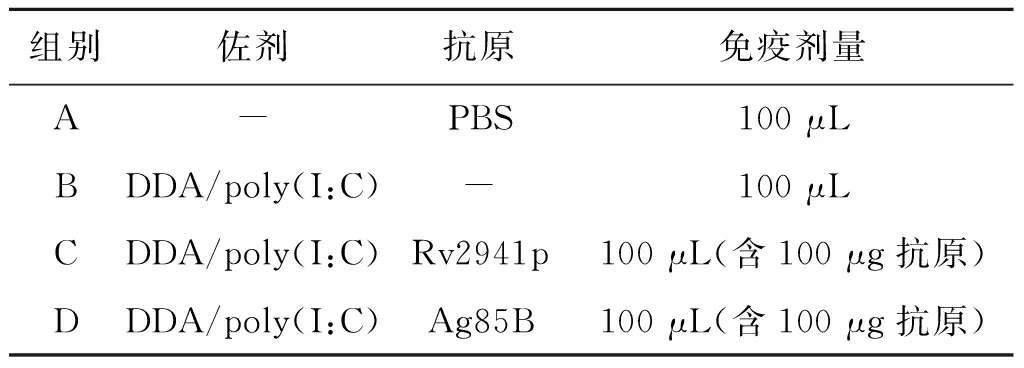
表1 小鼠免疫实验设计Tab.1 Experimetal design of mice immunization
在每次免疫前以及最后一次免疫后1周通过眼眶采血,将收集的血液在37 ℃静置2 h,4 000 r/min离心10 min,收集血清,放于-20 ℃保存。利用ELISA法检测血清中抗原特异性IgG抗体以及IgG亚型抗体滴度。
1.7 ELISA法检测淋巴细胞细胞因子分泌水平 末次免疫后1周处死小鼠,取脾脏按照达科为淋巴细胞分离液说明书分离淋巴细胞,然后测定淋巴细胞浓度,将部分细胞浓度调整至2×105个细胞/mL,置于24孔板中,每孔500 μL,加入刺激抗原,在37 ℃、5% CO2细胞培养箱中培养48 h,收集细胞培养上清用于细胞因子检测。ELISA法测定细胞因子使用BD公司生产小鼠细胞因子检测试剂盒,检测方法按照说明书进行。本研究主要检测IFN-γ、IL-2、IL-4和IL-6。
1.8 流式细胞仪分析小鼠CD4+T、CD8+T细胞增殖及胞内细胞因子表达 将分离淋巴细胞调整浓度至2×106~3×106个细胞/mL,置于96孔板中,每孔100 μL细胞,加入蛋白转运抑制剂以及刺激抗原,在37 ℃、5% CO2细胞培养箱中培养12 h后收集培养细胞。用50 μL Staining Buffer重悬细胞,然后加入7-ADD、CD3、CD4以及CD8抗体,4 ℃孵育30 min,用Staining Buffer清洗细胞2次。然后利用BD公司的固定破膜试剂盒将细胞进行破膜,破膜后加入IFN-γ、IL-4以及TNF-α抗体,4 ℃孵育30 min,然后Perm/WashTMbuffer清洗两次,用50 μL Staining Buffer重悬细胞后加入250 μL 4%多聚甲醛溶液,上流式细胞仪检测。
1.9 统计学分析 采用GraphPad Prim 5.0 中的Tukey的多重比较检验进行单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 Rv2941基因T表位预测结果 利用IEDB数据库分析后,结果如图1。根据分析结果显示,Rv2941的氨基酸第220位至第340位存在7个表位区(F004-F010),占总表位数目的50%,同时考虑表位结构的完整性,因此,选择核苷酸第649~1 017 bp即氨基酸第216位至第339位用于后续重组表达载体构建。

图1 Rv2941基因T表位预测结果Fig.1 T cell epitopes prediction of Rv2941
2.2 重组蛋白的表达与纯化 重组质粒pET32a-2941p由生工生物(上海)合成后,将质粒交由北京擎科生物科技有限公司测序,测序结果比对正确,用于后续实验。在0.1 mmol/L IPTG,37 ℃诱导4 h后收集菌体,超声破碎离心,SDS-PAGE电泳结果显示在超声上清样品34 kDa处有明显的表达带,与目的蛋白大小一致,即该抗原在大肠杆菌表达系统中呈可溶性表达(图2A)。利用His亲和层析纯化处理的超声上清,电泳结果发现目的蛋白主要存在于300 mmol/L 咪唑洗脱液中,纯化后的目的蛋白纯度达98.89%(图2B),将蛋白分装于-20 ℃保存以用于后续实验。

A:Rv2941p小量表达(M:蛋白标准分子质量;1:阴性对照;2:全菌;3:沉淀;4:上清);B:纯化后蛋白(M:蛋白标准分子质量;1:洗脱目的蛋白)图2 Rv2941p蛋白表达纯化Fig.2 Expression and purification of Rv2941p
2.3 小鼠体内特异性抗体检测 BALB/c小鼠第3次免疫后1周,利用ELISA法检测血清中特异性IgG抗体滴度。结果显示Rv2941p联合佐剂使用后与单独佐剂组以及PBS组间的差异有统计学意义(P<0.001),即该蛋白作为抗原免疫小鼠,能产生高滴度的特异性抗体(图3A)。然而,与Ag85B组相比, Rv2941p免疫小鼠产生的特异性抗体滴度较低,两者间的差异有统计学意义(P<0.01)。
2.4 Rv2941p促进IgG2a抗体分化 处死前小鼠血清检测IgG1和IgG2a抗体滴度,结果显示Rv2941p和Ag85B都提高了IgG2a/IgG1比值,且Rv2941p比Ag85B高(图3B)。

A:IgG抗体滴度;B:IgG亚型抗体滴度;①:P<0.01; ②:P<0.001图3 体液免疫反应Fig.3 Humoral response
2.5 Rv2941p诱导的细胞免疫反应类型 为进一步评估Rv2941p作为疫苗候选抗原诱导的细胞免疫反应类型,本研究利用ELISA法检测免疫48 h后小鼠脾脏淋巴细胞分泌IFN-γ、IL-4、IL-2以及IL-6的水平。结果显示,与佐剂组相比,Rv2941p显著提高了IFN-γ的分泌,高达620 pg/mL,且差异具有统计学意义(F=5.193,P<0.001)。同时比Ag85B组(480 pg/mL)也显著提高(F=1.152,P<0.001)(图4A)。此外,与其他各组相比,免疫Rv2941p后显著提高了IL-6细胞因子的分泌,高达2 600 pg/mL,是Ag85B的10倍(F=2.408,P<0.001)(图4D)。而IL-2和IL-4各组分泌都较低(图4B和4C)。同时,本研究利用流式细胞技术检测淋巴细胞内IFN-γ、IL-4和TNF-α的分泌水平。与其他组相比,免疫Rv2941p后T细胞内IFN-γ的表达明显提高(F=1.377,P<0.05)(图5B)。免疫Ag85B和Rv2941p后,都提高了T细胞内TNF-α的表达,且两组的表达水平几乎一致(图5B)。显示Rv2941p诱导更强的Th-1类免疫反应。
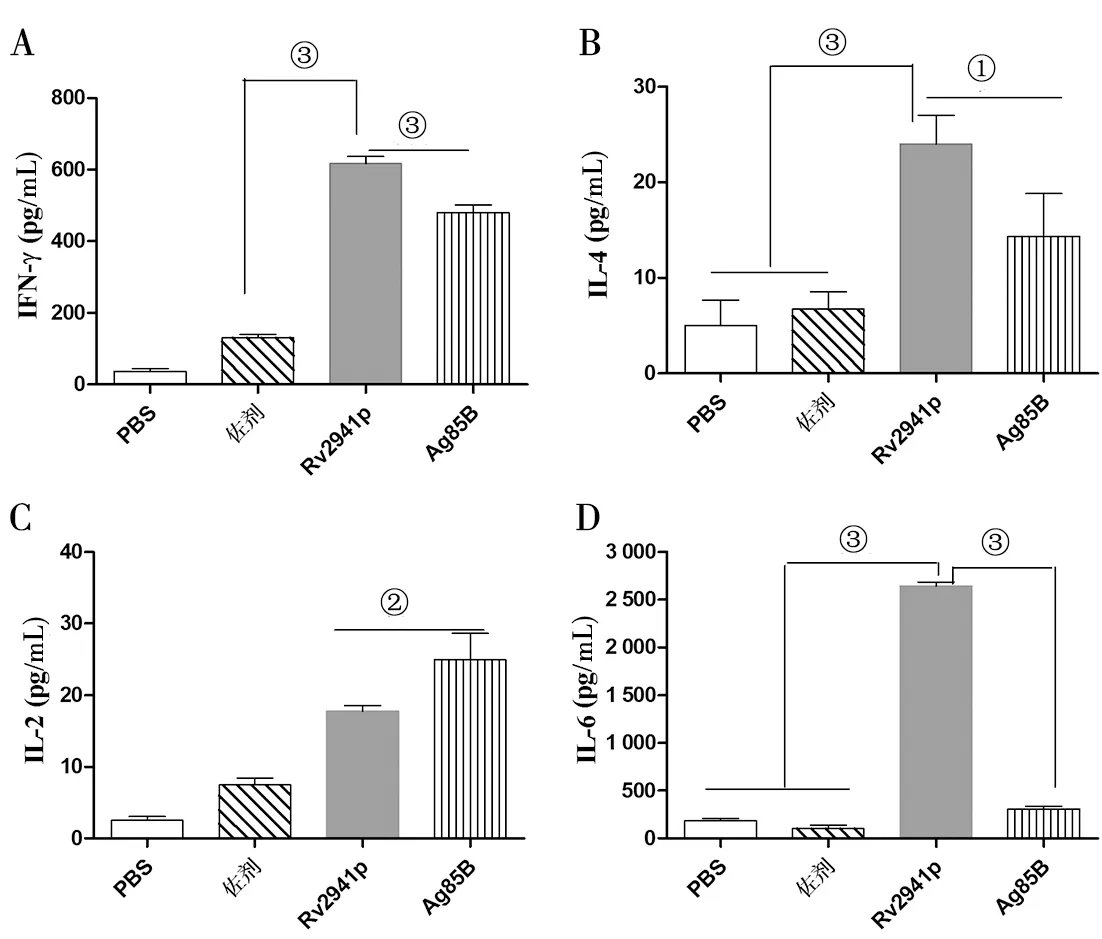
A:IFN-γ分泌水平;B:IL-4分泌水平;C:IL-2分泌水平;D:IL-6分泌水平;①:P<0.05; ②:P<0.01; ③:P<0.001图4 小鼠脾脏T淋巴细胞中细胞因子分泌水平Fig.4 Representative cytokine production in mouse spleen T cells after immunization
2.6 Rv2941p促进T淋巴细胞增殖 流式细胞技术分析免疫后小鼠脾脏T淋巴细胞内CD4+和CD8+细胞增殖分化情况。结果显示,Rv2941p和Ag85B都提高了CD4+T和CD8+T细胞的比例(图5A)。Rv2941p中CD4+T细胞比例比Ag85B中略低,而CD8+T细胞则比较高。

①:P<0.05图5 T细胞增殖(A)及胞内细胞因子(B)表达情况Fig.5 Proliferation and cytokine profiles of T cells after immunization
3 讨 论
尽管目前广泛采用了标准药物治疗方案,现代诊断方法和疫苗(卡介苗),但是全球结核病的流行仍未得到充分的控制,因此,研发新型安全有效的结核病疫苗迫在眉睫。而不管是亚单位疫苗还是重组BCG疫苗,筛选有效的抗原尤为关键。据研究报道,迄今为止,只有7%的结核分枝杆菌抗原能够激活T细胞反应[10]。因此,在剩余的结核分枝杆菌抗原中筛选更多的免疫显性T细胞表位至关重要。Rv2941是一种参与调控Mtb细胞壁脂质形成的基因,而这种脂质在致病Mtb逃避宿主的防御能力发挥重要作用[11],但是对于该抗原的免疫原性未见报道,关于其T细胞表位区更是鲜有报道。因此,我们利用免疫表位数据库(IEDB,https://www.iedb.org/)分析抗原Rv2941的T细胞表位区,根据分析结果选择位于第649~1 017 bp的T细胞表位集中区进行免疫原性分析。
结核分枝杆菌是一种胞内寄生菌,寄生在特殊的囊泡和结核分枝杆菌吞噬体,因此,T细胞免疫对结核免疫至关重要,尤其是Th-1类免疫反应[12]。IgG1和IgG2a分别是代表Th-2和Th-1型反应的重要生物标志物[13]。本研究发现Rv2941p可以促进IgG2a的分化,提高IgG2a/IgG1的比值,这一结果表明Rv2941p倾向于刺激机体Th-1类免疫反应。此外,本研究中还检测了Th-1类细胞因子IFN-γ和IL-2,结果显示免疫Rv2941p后,小鼠脾脏淋巴细胞IFN-γ和IL-2的分泌显著提高,尤其是IFN-γ,这一数据也表明Rv2941p可以刺激机体产生较强的Th-1类免疫反应。
在结核分枝杆菌感染中,IL-6是激活分泌IFN-γ的T细胞的关键,同时是一种主要的诱导保护性T细胞的分子,加强IFN-γ的作用[14]。本研究证实Rv2941p可以明显促进T淋巴细胞分泌IL-6细胞因子,高达2 600 pg/mL(图4D),这一结果为Rv2941p可以作为结核病新型疫苗候选抗原提供依据。
在小鼠感染模型研究中证实CD4+T和CD8+T细胞在抗结核免疫中发挥关键作用。CD4+T细胞可以与感染Mtb的巨噬细胞相互作用,通过分泌细胞因子(如IFN-γ等)限制结核分枝杆菌在细胞内的复制。同时,CD8+T细胞分泌穿孔素裂解Mtb感染的巨噬细胞和直接杀死细胞内Mtb[15]。本研究发现,Rv2941的T细胞表位区(Rv2941p)显著提高了CD4+和CD8+T细胞的增殖分化(图5A)。另外,有研究证实,IFN-γ、TNF-α、IL-12以及IL-17的表达是对抗结核的保护性免疫的重要指标,特别是对高毒性结核分枝杆菌谱系[16]。本研究利用流式细胞技术发现淋巴细胞胞内CD4+T细胞内IFN-γ和TNF-α的表达水平较高(图5B),IFN-γ和TNF-α属于Th-1类细胞因子,这一结果表明Rv2941p可以加强CD4+Th-1类免疫反应。同时,从人类疾病和实验小鼠模型中可以明显看出,结核分枝杆菌特异性CD4+和CD8+T细胞产生的IFN-γ和TNF-α都是控制结核分枝杆菌感染的基础[17]。这些结果都提示Rv2941p的T细胞表位区可能是潜在结核病疫苗抗原。
B细胞在介导结核病疫苗效力方面的作用也在逐渐凸显,但是尚未完全了解其具体功能。在动物模型和人类感染的相关研究已经提供了明确的证据,即增殖的抗原特异性B细胞定殖于保护性肉芽肿内,这些肉芽肿是高度特殊化的空间结构,可以控制Mtb的进一步感染[18]。因此,除了T细胞外,B细胞有可能也参与疫苗诱导有效的抗结核病免疫反应的产生。本研究也证实Rv2941p可以刺激机体产生较强的IgG抗体,这一结果表明它可以刺激机体产生较强的体液免疫反应。
综上所述,本研究发现Rv2941的T细胞表位区核苷酸第649~1 017 bp具有较强的免疫原性,可以刺激机体产生较强的Th-1类免疫反应,可以作为结核病新型疫苗的候选抗原之一。
利益冲突:无
引用本文格式:范雪亭,栾秀丽,赵秀芹,等. 结核分枝杆菌Rv2941蛋白抗原表位集中区免疫原性研究[J]. 中国人兽共患病学报,2022,38(5):394-399. DOI:10.3969/j.issn.1002-2694.2022.00.061
