外源性IL-6 通过STAT3 通路促进卵巢癌细胞对顺铂耐药
2022-06-08沈洋洋牛秀珑郁春艳郑小燕刘俊汝邓为民
沈洋洋,牛秀珑,郁春艳,郑小燕,刘俊汝,邓为民
(1.天津医科大学基础医学院免疫学系,国家教育部免疫微环境与疾病重点实验室,天津 300070;2.中国人民武装警察部队特色医学中心勤务环境皮肤疾病防治研究所,天津 300162)
卵巢癌(ovarian cancer,OvCa)是妇科恶性肿瘤中最常见的死因之一,是全球女性第七位常见癌症,同时死亡率也较高,5 年生存率低于50%[1-2]。化疗是肿瘤治疗的重要手段之一,然而耐药严重阻碍了肿瘤化疗效果。顺铂是目前用于治疗OvCa 最有效的化疗药物之一,但患者经常会出现对顺铂治疗的耐药,因此了解OvCa 对顺铂耐药机制对肿瘤治疗具有重要意义。近年来,越来越多的研究关注肿瘤与炎症之间的联系。白细胞介素-6(interleukin 6,IL-6)是由多种细胞产生的炎症因子,研究发现,IL-6 与OvCa 之间关系密切,涉及肿瘤的生存、生长、侵袭、血管生成和耐药[3-4]。临床研究显示,IL-6水平与肿瘤的不良预后和化疗敏感性相关,IL-6 和OvCa 的恶性程度以及预后相关[5-6],IL-6 可以促进OvCa 干细胞聚集[7],可通过核因子(NF)-κB 途径促进OvCa 耐药[8]等。本研究对外源性IL-6 在诱导OvCa 顺铂耐药中的作用进行了初步研究,为临床解决OvCa 顺铂耐药提供新的思路。
1 材料与方法
1.1 材料 裸鼠购自中国北京军事医学科学院实验动物中心;人OvCa 细胞系A2780 细胞购自美国ATCC 公司;胎牛血清(FBS)购自美国GIBCO 公司;RPMI-1640 培养基购自中国南京凯基生物科技发展有限公司;重组人白细胞介素-6(recombinant human interleukin 6,rhIL-6)、AG490(JAK2/STAT3 抑制剂)购自美国Sigma 公司;STAT3 抗体购自美国SAB Biotech 公司;p-STAT3 抗体购自美国Cell Signaling 公司;β-actin 购自中国北京瑞康生物技术有限公司;顺铂购自中国齐鲁医药公司;HRP 酶标二抗购自美国Rockland 公司;Annexin V-FITC 凋亡试剂盒购自中国南京凯基生物科技发展有限公司;CCK8 试剂盒购自中国碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养 A2780 细胞用含有10%FBS 的RPMI-1640 培养基培养,培养基中含80 U/mL 青霉素和80 μg/mL 链霉素,置于5%CO2、37℃培养箱中培养,每1~2 d 更换培养基并消化传代。
1.2.2 CCK8 实验 取对数生长期A2780 细胞接种于96 孔板,每孔为3×103/100 μL,分为对照(Control)组、AG490 组、顺铂(Cisplatin)组、AG490+Cisplatin组、重组人白细胞介素-6(rhIL-6)组、rhIL-6+AG490 组、rhIL-6+Cisplatin 组和rhIL-6+AG490+Cisplatin 组,共8 组,每组设立3 个复孔。待细胞贴壁后,AG490 组、AG490+Cisplatin 组、rhIL-6+AG490组和rhIL-6+AG490+Cisplatin 组加入AG490(50 μmol)[9]预处理1 h,之后加入rhIL-6(50 ng/mL)[10]或顺铂(10 μmol),5%CO2、37°C 培养箱中培养72 h,培养结束后去除培养基,用Hank′s 洗涤两次,每孔加入100 μL 培养基(含10 μL 的CCK8 试剂),酶标仪检测波长为450 nm 的光密度值(OD450),利用SPSS 对数据进行统计学分析。
1.2.3 Western 印迹实验 取对数生长期A2780 细胞接种于6 孔板,每孔为5×105/2 mL,分为Control 组、AG490 组、rhIL-6 组和rhIL-6+AG490 组。细胞贴壁后加药处理12 h,将RIPA、蛋白酶抑制剂、磷酸蛋白酶抑制剂以100∶1∶1 配置裂解液,提取细胞总蛋白。BCA 蛋白检测试剂盒检测蛋白浓度,配置10%的分离胶,将40 μg/孔的蛋白用10%SDS-PAGE 进行电泳分离。电泳后将蛋白转印于PVDF 膜,100 V 转膜1 h,用3%牛血清白蛋白(BSA)室温封闭2 h 后,加入特异性一抗,4℃孵育过夜,TBST 漂洗3 次,每次10 min,加入HRP 标记的二抗室温孵育2 h。TBST清洗后化学发光底物检测试剂盒进行检测。将目的蛋白与内参的灰度比值作为蛋白的相对表达丰度。
1.2.4 细胞凋亡实验 取对数生长期A2780 细胞接种于12 孔板,每孔为1×105/mL,分为Control 组、AG490 组、Cisplatin 组、AG490+Cisplatin 组、rhIL-6组、rhIL-6+AG490 组、rhIL-6+Cisplatin 组和rhIL-6+AG490+Cisplatin 组,共8 组,同时设立空白管组和单染管组。细胞贴壁后AG490 组、AG490+Cisplatin 组、rhIL-6+AG490 组和rhIL-6+AG490+Cis platin 组加入AG490(50 μmol)预处理1 h 之后按实验方案各组加入rhIL-6(50 ng/mL)或顺铂(10 μmol),5%CO2、37℃培养箱中培养48 h。培养结束后用0.25%胰酶(不含EDTA)消化收集细胞,加入0.1%BSA-PBS 洗涤2 次。弃去上清,每管加入500 μL 试剂盒中的Binding Buffer 重悬细胞,混匀。加入5 μL的AnnexinV 溶液混匀,再加入5 μL 的碘化丙啶(PI)溶液,混匀。避光室温孵育10 min。细胞通过400 目筛网过滤成单细胞悬液备检。用流式细胞仪进行检测,用空白管和单染管调节电压和荧光补偿,Annexin V-FITC 绿色荧光通过FITC 通道(FL1)检测,PI 红色荧光通过PI 通道(FL2)检测,利用FlowJo 软件进行数据分析。
1.2.5 小鼠体内实验 将36 只8 周龄雌性裸鼠随机分为Control 组、rhIL-6 组、Cisplatin 组、AG490组、rhIL-6+Cisplatin 组和rhIL-6+AG490+Cisplatin组,共6 组,每组6 只。腹腔注射A2780 细胞(5×106/200 μL/鼠),按照不同分组腹腔注射rhIL-6、AG490和顺铂,其中第1 天开始注射rhIL-6[1 μg/(kg·周)],第1 天开始注射AG490[5 mg/(kg·d)],从第4 天开始注射顺铂 [4 mg/(kg·周)],Control 组腹腔注射PBS。4 周后颈椎脱臼处死小鼠,打开腹腔,观察瘤结节生成情况并拍照,计数瘤结节、称重。
1.3 统计学处理 采用SPSS13.0 软件进行统计学分析,其中符合正态分布数据以±s 表示。多组间相互比较采用单因素方差分析,两组间比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组OvCa 细胞增殖情况 由图1 可知,与Control 组相比,rhIL-6 组细胞增殖增加[(1.330±0.024)vs.(1.264±0.012),t=4.148,P<0.05],Cisplatin组细胞增殖降低[(1.199±0.005)vs.(1.264±0.012),t=8.050,P<0.01],AG490 组细胞增殖无变化[(1.283±0.024)vs.(1.264±0.012),t=1.201,P>0.05]。与Cisplatin 组相比,rhIL-6+Cisplatin 组细胞增殖增加[(1.314±0.022)vs.(1.199±0.005),t=8.439,P <0.01]。与rhIL-6+Cisplatin 组相比,rhIL-6+Cisplatin+AG490 组细胞增殖降低[(1.242±0.011)vs.(1.314±0.022),t=4.860,P<0.01]。
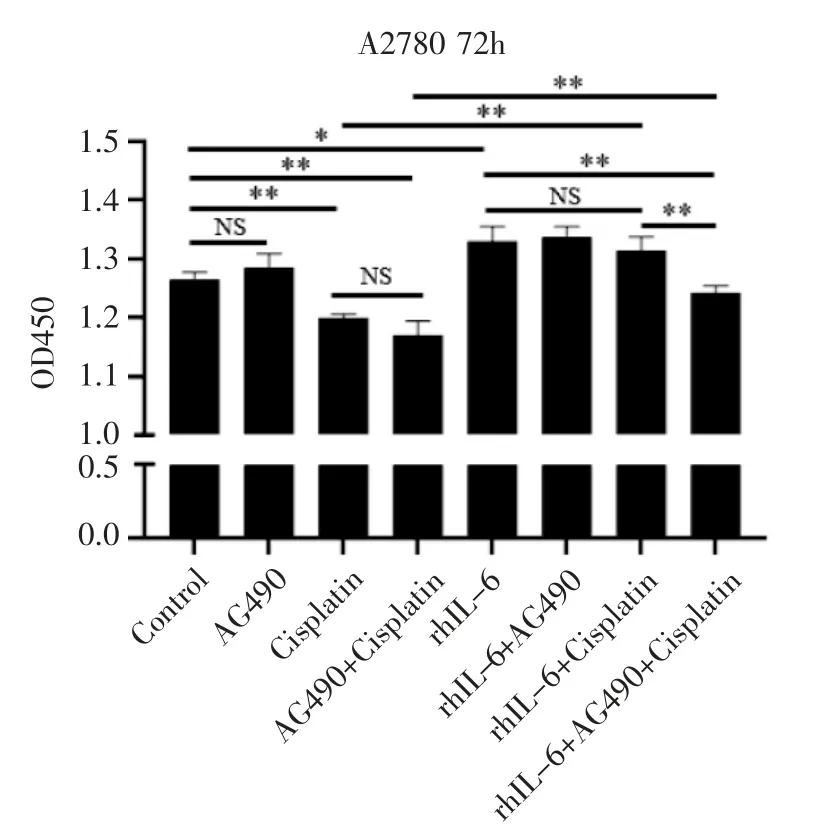
图1 各组细胞增殖的情况Fig 1 Result of cell proliferation in each group
2.2 各组p-STAT3 蛋白表达情况 由图2B 可见,与Control 组相比,rhIL-6 组p-STAT3 蛋白表达明显增加[(2.27±0.46)vs.(1.0±0),t=6.55,P<0.01]。与rhIL-6 组相比,rhIL-6+AG490 组的p-STAT3 蛋白明显降低[(0.99±0.12)vs.(2.27±0.46),t=6.34,P<0.01]。
2.3 各组细胞凋亡情况 由图3B 可知,与Control组相比,Cisplatin 组细胞凋亡显著增加 [(12.70±0.36)vs.(2.75±0.38),t=32.56,P<0.001]。rhIL-6 组与Control 组 对 比 没 有 统 计 学 差 别[(3.49±0.40)vs.(2.75±0.38),t=2.272,P>0.05]。与Cisplatin 组相比,rhIL-6+Cisplatin 组细胞凋亡显著降低[(7.75±0.23)vs.(12.70±0.36),t=20.03,P<0.001]。与rhIL-6+Cisplatin 组相比,rhIL-6+Cisplatin+AG490 组细胞凋亡显著增加[(13.36±0.37)vs.(7.75±0.23),t=22.16,P<0.001]。与AG490+Cisplatin 组相比,rhIL-6+Cisplatin+AG490 组细胞凋亡差异无统计学意义[(12.88±0.87)vs.(13.36±0.37),t=0.8836,P>0.05]。2.4 各组瘤结节重量和大小情况 由图4B 可知,与Cisplatin 组相比,rhIL-6+Cisplatin 组小鼠的瘤结节数量(图4A)和重量(图4B)明显增加[(0.206±0.072)vs.(0.107±0.022),t=2.783,P<0.05]。与rhIL-6+Cisplatin 组相比,rhIL-6+Cisplatin+AG490 组瘤结节数量和重量均显著降低[(0.065±0.035)vs.(0.206±0.072),t=3.306,P<0.05]。
3 讨论
OvCa 是困扰女性的三大生殖系统恶性肿瘤之一,且死亡率高居不下。顺铂是OvCa 主要的化疗药物,然而化疗耐药使肿瘤预后较差,耐药性是阻碍成功抗癌治疗的最棘手障碍之一,因此迫切需要解决耐药的问题。本实验通过体内体外两方面的实验,证实IL-6 可以通过STAT3 信号通路促进OvCa对顺铂耐药。
IL-6 是一种多功能促炎性因子,在与其膜结合受体(IL-6R)结合后激活经典的信号通路。IL-6 过表达和多种肿瘤相关,包括结直肠癌、OvCa、乳腺癌等[11],与OvCa 的发生、发展、预后等密切相关。临床资料显示,OvCa 患者高表达IL-6,IL-6 水平升高与不良预后和化疗敏感性差相关,IL-6 可以诱导OvCa 细胞多药耐药基因的表达,内源性或外源性IL-6 诱导A2780 细胞中多药耐药蛋白表达升高,且与IL-6 呈正相关[12],靶向IL-6 治疗已经被认为是一种可行的治疗手段。IL-6 调控下游多种信号通路,在肿瘤细胞对化疗耐药起着重要作用[11],其中研究最多的是IL-6/JAK2/STAT3 轴[13]。
IL-6/JAK2/STAT3 轴在许多类型的癌症中均异常激活,而这种过度激活通常与不良的临床预后相关。在肿瘤微环境中,IL-6/JAK2/STAT3 信号转导可驱动肿瘤细胞的增殖、耐药、侵袭性和迁移,同时强烈抑制抗肿瘤免疫反应[14]。人OvCa 细胞系A2780不分泌IL-6 且对顺铂敏感[8],因此本研究选择A2780 作为观察IL-6 影响OvCa 发生顺铂耐药机制的研究对象。CCK8 实验结果显示单独rhIL-6 可促进A2780 的增殖,顺铂联用rhIL-6 可以降低前者对A2780 增殖的抑制作用,而AG490 可以抑制rhIL-6 的作用,说明外源性IL-6 通过影响STAT3 通路促进A2780 增殖。细胞凋亡实验结果显示,与Cisplatin 组相比,联用rhIL-6 能促进A2780 对顺铂耐药,而这个作用被AG490 所抑制,同时与AG490+Cisplatin 组相比,增加rhIL-6 处理并无显著性差异,说明rhIL-6 通过STAT3 通路诱导OvCa 对顺铂耐药。此外Western 印迹结果表明,IL-6 可以显著促进p-STAT3 的表达,说明外源性IL-6 可以通过诱导STAT3 磷酸化来促进OvCa 抗凋亡和对顺铂耐药。和体外实验结果相同,小鼠体内实验结果显示,与Cisplatin 组相比,rhIL-6+Cisplatin 组小鼠瘤结节数量和重量明显增加,而再联用AG490会抑制rhIL-6 的作用,说明rhIL-6 通过STAT3 信号通路体内诱导OvCa 对顺铂耐药。IL-6/JAK2/STAT3 通路促进OvCa 对顺铂耐药的具体机制较为复杂,涉及多个方面,IL-6/JAK2/STAT3 轴在干细胞干性、诱导耐药蛋白、缺氧、上皮间质表型转化、促进抗凋亡蛋白表达和DNA 修复相关基因表达等多方面促进肿瘤耐药[15-20]。
综上所述,本研究从体内、体外两个方面证明外源性IL-6 可以通过STAT3 通路诱导OvCa 对顺铂耐药,为临床OvCa 患者治疗中炎症诱导耐药的处理提供新的思路和策略。
