CDT 对支架血管成形术治疗TASC ⅡD 级AIOD 患者近中期有效性与安全性的影响
2022-06-08刘宗玮戴向晨
刘宗玮,戴向晨
(天津医科大学总医院血管外科,天津 300052)
主髂动脉闭塞症(aortoiliacocclusivedisease,AIOD)是主要累及腹主动脉末端及髂动脉的血管硬化性疾病[1]。AIOD 最常见的病因是动脉粥样硬化,其他少见病因包括血栓闭塞性脉管炎或大动脉炎。依据2007 年提出的外周动脉疾病跨大西洋共识(Inter-Society Consensus for the Management of Peripheral Arterial Disease,TASC Ⅱ)[2],主-双股动脉旁路术(aorto-bifemoral bypass,ABF)具有80%~92%的5 年通畅率,可作为治疗TASC ⅡC、D 级病变患者的标准术式[3-4],但该手术围术期并发症发生率高达45%,手术死亡率高达4.4%,这使接受该治疗方式的患者同时也面临着巨大的手术风险[5-7]。目前,国内外已有许多研究表明腔内治疗方式(endovascular treatment,EVT)[4,8-9]与ABF 相比具有相似的中远期疗效,其二次通畅率与ABF 远期通畅率相似。此外EVT 的围手术期死亡率与并发症率远低于ABF,这使主髂动脉闭塞性疾病的治疗倾向于更加微创的治疗模式[10]。由于部分AIOD 患者的病变血管中可能含有血栓,这会对病变血管腔内治疗的疗效产生影响[11]。经导管定向溶栓(catheter-directed thrombolysis,CDT)的腔内减容方式有助于祛除血栓对病变的干扰,显示出病变的真实情况。有文献报道CDT 联合支架血管成形术将有助于提升治疗效果[11-12],但目前对于CDT 的使用缺乏统一标准,其安全性有待验证[13]。因此,笔者对105 例TASC ⅡD 级AIOD 患者进行溶栓或非溶栓的管腔处理方式的临床资料进行回顾性分析,探讨CDT 对于支架血管成形术治疗TASC ⅡD 级AIOD 患者的有效性及安全性的影响。
1 对象与方法
1.1 对象 收集2015 年1 月—2020 年12 月天津医科大学总医院血管外科行腔内治疗的105 例TASCⅡD 级AIOD 患者的临床资料。纳入标准:(1)严重间歇性跛行、静息痛病史伴或不伴下肢皮肤破溃、坏疽。(2)所有患者均为初次接受髂动脉支架植入。(3)患者术前接受血管成像(computed tomography angiography,CTA)或数字减影血管造影(digital subtraction angiography,DSA)检查确诊为血管狭窄及闭塞,病变主要部位累及髂动脉和(或)肾动脉以下的腹主动脉。排除标准:(1)重要脏器衰竭或严重功能障碍。(2)对比剂过敏。(3)资料不全。术前所有患者均行双侧踝肱比(ankle brachial index,ABI)检查。按照手术方式的不同,将患者分为溶栓组(n=13)、支架组(n=53)和联合组(n=39)。
1.2 方法
1.2.1 手术方法 首选超声引导下左肱动脉穿刺入路尝试顺行开通靶病变,复杂病变则联合股动脉穿刺入路配合开通。成功建立动脉入路后利用导丝配合导管通过靶病变段并在病变远端造影证实在真腔,部分患者真腔开通困难则采用内膜下开通方式。留置导丝送入小直径球囊自病变远心端向近心端扩张以建立动脉远端流出道。结合术前病史、血管CTA 检查、术中造影以及导丝导管通过靶病变情况判断病变处是否存在血栓。如果有血栓形成或疑似血栓存在,则依据术者经验判断是否行CDT 治疗。对于不进行CDT 治疗的支架组患者则直接于靶病变处置入球囊扩张支架或自膨式金属裸支架。选择CDT 治疗的溶栓组及联合组患者则选用4F 或5F Unifuse 溶栓导管(Angio Dynamics 公司)通过预留导丝置入靶病变中,溶栓导管头端需要越过病变远端,留置导管尾端与皮肤固定,返回病房。采用团注模式泵入尿激酶溶栓治疗,每次10 万单位,15 min内泵入,间歇期自鞘管持续泵入肝素钙生理盐水(2 000 IU,42 mL/h)。CDT 治疗期间密切监测患者情况,每24 h 监测一次纤维蛋白原,依据患者纤维蛋白原变化情况调整团注次数,若CDT 治疗期间出现穿刺点出血、消化道出血等溶栓相关出血事件或纤维蛋白原≤1.5 g/L 则立即停止CDT 治疗。持续动脉CDT 治疗结束后再次造影,明确血管通畅情况。若CDT 治疗后靶病变处仍有残余狭窄且大于正常血管直径的30%则选择球囊扩张+金属裸支架治疗。对于单个支架长度无法满足靶病变长度的患者则使用支架对接技术,通过多个支架重叠置入而达到靶病变全覆盖的治疗目的,支架之间重叠部分至少1 cm。若病变累及肾下腹主动脉或髂动脉分叉处则采用“对吻”或“拥抱”支架技术重建腹主动脉-髂动脉分叉处血运。在支架使用方面由于球囊扩张支架定位准确一般选择放置在病变的近心端;而自膨式金属裸支架的径向支撑力好且长度足够,因此常被选择用于病变远心端,术中影像见图1。
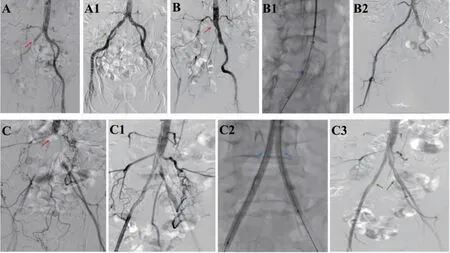
图1 溶栓组、支架组及联合组患者术中DSA 影像Fig 1 The operative DSA images of patients in thrombolysis group,stent group and combined group
1.2.2 研究方法
1.2.2.1 有效性与安全性指标 有效性指标:比较各组患者术中TASC Ⅱ分级改善程度及置入支架长度。安全性指标:比较各组患者围手术期与CDT 治疗相关的出血事件发生率(包括新发脑出血、消化道大出血、泌尿系出血、穿刺点出血等)以及术中射线暴露时间。
1.2.2.2 术后随访 术后1、3、6、24 个月门诊随访,此后每年门诊随访或电话随访,评估是否有靶病变再狭窄引起的缺血症状,包括静息痛或步行距离明显缩短,辅助检查包括ABI、下肢动脉彩超等。
1.2.2.3 随访观察指标 观察各组术后随访期一期通畅率,以免于临床驱动的靶病变重建(freedom from clinical-driven target lesion reintervention,f-cd TLR)表示。免于不良事件发生率(percentage of freedom from adverse event,PFAE)定义为免于下肢动脉缺血相关的截肢/截趾或全因死亡率。此外还观察各组患者术后ABI 值及Rutherford 分级变化程度。
1.3 统计学处理 采用SPSS 25.0 统计分析软件,正态分布计量资料以±s 表示,多组数据比较采用单因素方差分析,使用最小显著性差异法(LSD)比较方法进行组间两两比较,两组间比较采用t 检验。偏态分布资料以中位数(四分位间距)表示。计数资料以百分率表示,采用χ2检验或Fisher 精确概率检验。非正态分布数据使用(Mann-Whitney,U 检验)或(Kruskal-Wallis test,H 检验)。预测靶血管一期通畅率及免于不良事件发生率采用Kaplan-Meier 非参数方法评估。所有检验均为双侧检验,检验水准α=0.05,P<0.05 表示差异具有统计学意义。
2 结果
2.1 患者一般资料 支架组患者年龄高于溶栓组及联合组,其他指标差异均无统计学意义,见表1。
表1 TASC ⅡD 级AIOD 患者人口学特征以及Rutherford 分级[±s,n(%),M(P25,P75)]Tab 1 Demographic characteristics and Rutherford classification of AIOD patients with TASC ⅡD classification[±s,n(%),M(P25,P75)]
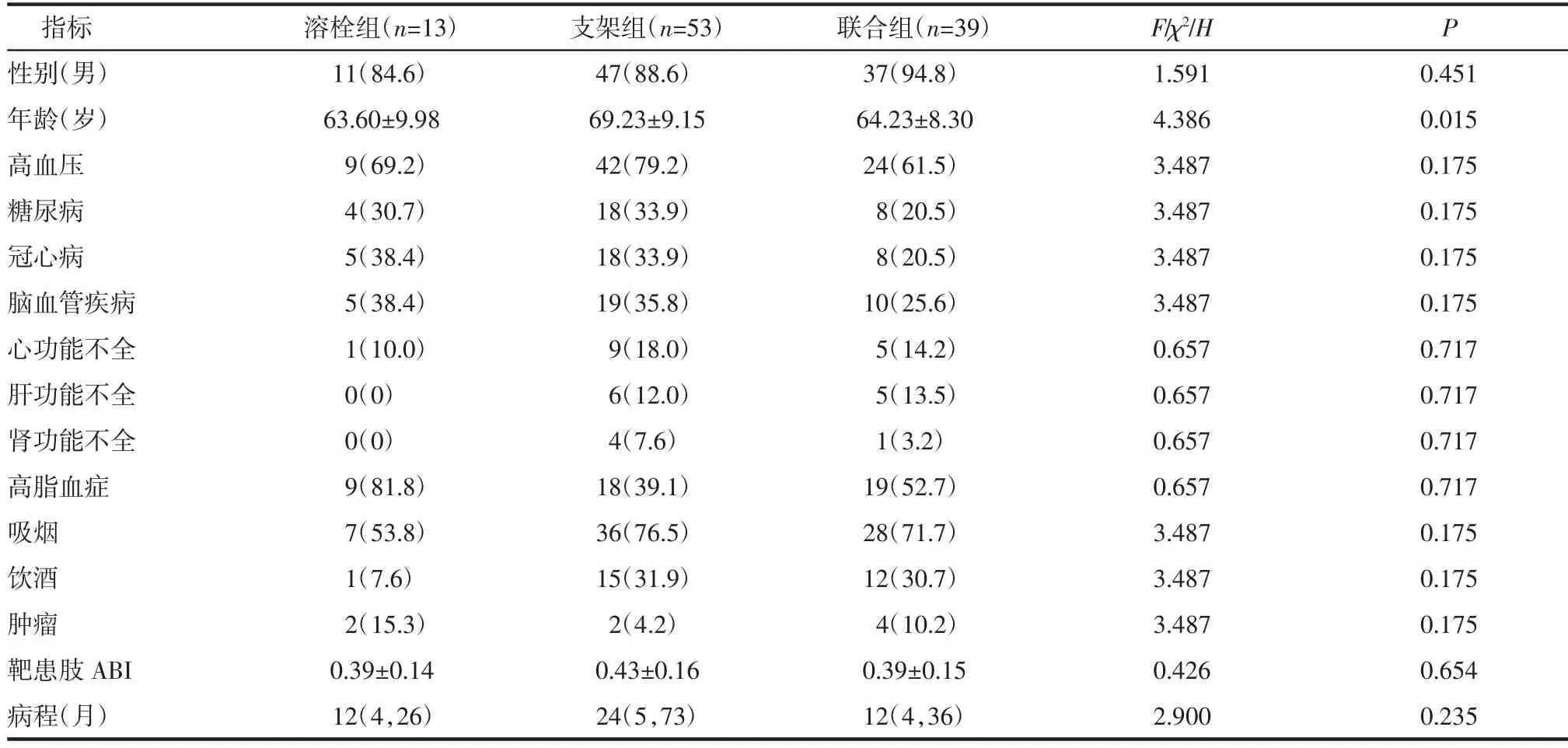
表1 TASC ⅡD 级AIOD 患者人口学特征以及Rutherford 分级[±s,n(%),M(P25,P75)]Tab 1 Demographic characteristics and Rutherford classification of AIOD patients with TASC ⅡD classification[±s,n(%),M(P25,P75)]
注:ABI:踝肱比
联合组(n=39) F/χ2/H P 1.591 0.451 4.386 0.015 3.487 0.175 3.487 0.175 3.487 0.175 3.487 0.175心功能不全 1(10.0) 9(18.0) 5(14.2) 0.657 0.717肝功能不全 0(0) 6(12.0) 5(13.5) 0.657 0.717肾功能不全 0(0) 4(7.6) 1(3.2) 0.657 0.717高脂血症 9(81.8) 18(39.1) 19(52.7) 0.657 0.717吸烟 7(53.8) 36(76.5) 28(71.7) 3.487 0.175饮酒 1(7.6) 15(31.9) 12(30.7) 3.487 0.175肿瘤 2(15.3) 2(4.2) 4(10.2) 3.487 0.175靶患肢ABI 0.39±0.14 0.43±0.16 0.39±0.15 0.426 0.654病程(月) 12(4,26) 24(5,73) 12(4,36) 2.900 0.235指标 溶栓组(n=13) 支架组(n=53)性别(男) 11(84.6) 47(88.6)37(94.8)年龄(岁) 63.60±9.98 69.23±9.15高血压 9(69.2) 42(79.2)糖尿病 4(30.7) 18(33.9)冠心病 5(38.4) 18(33.9)脑血管疾病 5(38.4) 19(35.8)64.23±8.30 24(61.5)8(20.5)8(20.5)10(25.6)
2.2 围手术期结果 共105 例(158 条患肢)TASCⅡD 级患者接受腔内治疗。成功开通靶病变患者共100 例(148 条患肢)。手术费用联合组多于溶栓组(P=0.005)和支架组(P=0.033),溶栓组与支架组比较差异无统计学意义(P=0.185);手术成功率支架组优于溶栓组(P=0.019),联合组与溶栓组相比差异无统计学意义(P=0.406),联合组与支架组相比差异无统计学意义(P=0.194),见表2。
2.2.1 CDT 围手术期安全性指标比较结果 射线暴露时间支架组多于溶栓组(P=0.000)和联合组(P=0.000),溶栓组与联合组相比差异无统计学意义(P=0.268),见表2。溶栓组及联合组共52 例经CDT 治疗的患者围手术期间无CDT 相关出血事件发生。
表2 各组围手术期结果比较[±s,n(%),M(P25,P75)]Tab 2 Comparison of perioperative results in each group[±s,n(%),M(P25,P75)]
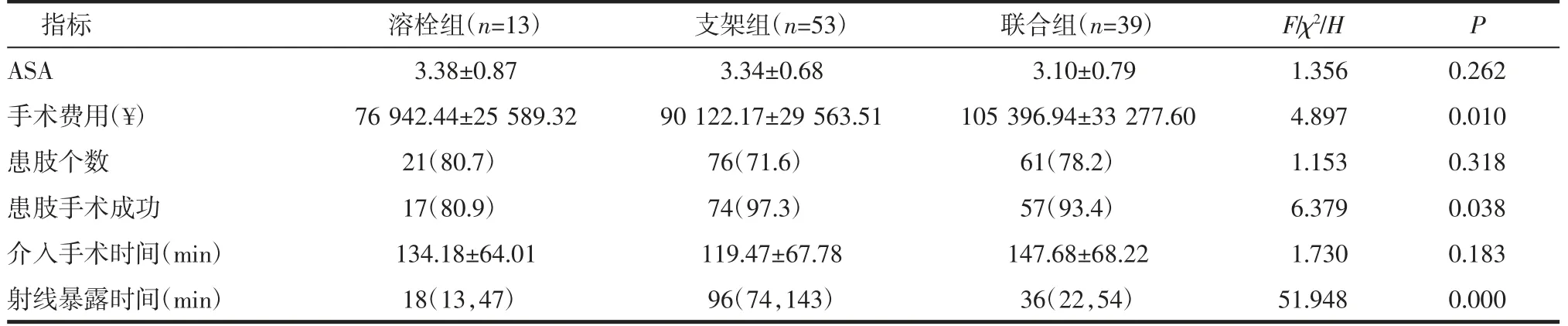
表2 各组围手术期结果比较[±s,n(%),M(P25,P75)]Tab 2 Comparison of perioperative results in each group[±s,n(%),M(P25,P75)]
注:ASA:美国麻醉师协会评分
指标 溶栓组(n=13) 支架组(n=53)ASA 3.38±0.87 3.34±0.68手术费用(¥) 76 942.44±25 589.32 90 122.17±29 563.51患肢个数 21(80.7) 76(71.6)患肢手术成功 17(80.9) 74(97.3)介入手术时间(min) 134.18±64.01 119.47±67.78射线暴露时间(min) 18(13,47) 96(74,143)105 396.94±33 277.60 61(78.2)57(93.4)147.68±68.22 36(22,54)联合组(n=39) F/χ2/H P 1.356 0.262 4.897 0.010 1.153 0.318 6.379 0.038 1.730 0.183 51.948 0.000 3.10±0.79
2.2.2 CDT 围手术期有效性指标比较 联合组支架置入长度(12.17±6.25)cm 明显短于原始病变长度(20.47±7.51)cm(t=5.019,P=0.000),支架组支架置入长度(14.69±6.27)cm 与原始病变长度(13.97±6.03)cm 相比差异无统计学意义(t=-0.656,P=0.513)。52 例经CDT 治疗的患者中有41 例(78.8%)TASCⅡ分级降低。
2.3 随访期结果 在成功开通靶患肢的100 例患者中,中位随访时间33 个月,随访期间各组患者无下肢动脉缺血相关的截肢/截趾事件发生,随访结果见表3。

表3 腔内治疗成功开通靶病变患者随访结果[n(%),M(P25,P75)]Tab 3 Follow-up results of patients with successful target lesion revascularization by endovascular treatment[n(%),M(P25,P75)]
2.3.1 Rutherford分级改善情况及术后ABI值变化 患者Rutherford 分级与术前相比均降低(Z=-10.102,P=0.000),联合组和支架组比溶栓组术后Rutherford分级改善程度更大(P=0.001、P=0.021),支架组与联合组比较差异无统计学意义(P=0.296),见表4。与术前ABI 值相比,术后1、3、6、24 个月各组患者ABI 值均提升(P<0.05),随访6 个月时联合组和支架组ABI 值均优于溶栓组(P=0.014、P=0.046),联合组与支架组相比差异无统计学意义(P=0.564),见表5。
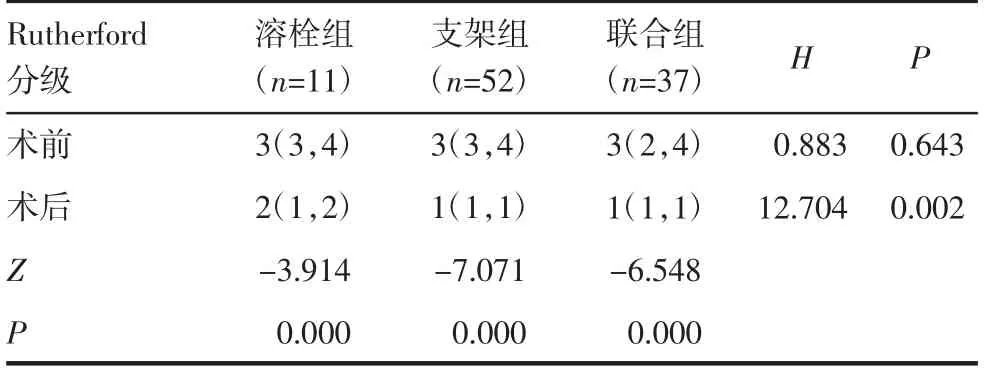
表4 腔内治疗前后患者Rutherford 分级比较[M(P25,P75)]Tab 4 Comparison of Rutherford classification before and after the endovascular treatment[M(P25,P75)]
表5 靶患肢术前与腔内治疗后ABI 值比较(±s)Tab 5 Comparison of target limbs′ ABI value before and after endovascular treatment(±s)
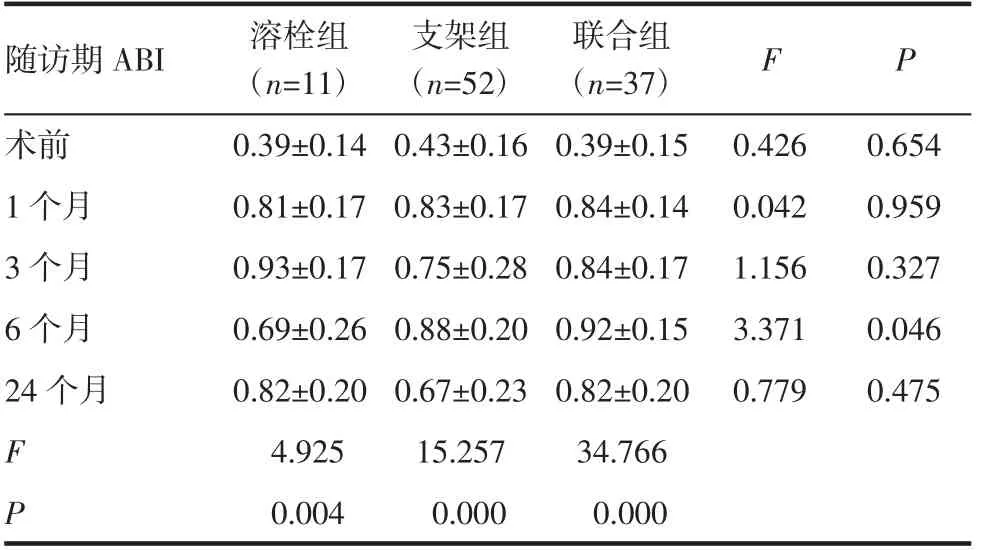
表5 靶患肢术前与腔内治疗后ABI 值比较(±s)Tab 5 Comparison of target limbs′ ABI value before and after endovascular treatment(±s)
注:ABI:踝肱比
随访期ABI 溶栓组(n=11)支架组(n=52)联合组(n=37) F P术前 0.39±0.14 0.43±0.16 0.426 0.654 0.042 0.959 3 个月 0.93±0.17 0.75±0.28 0.84±0.17 1.156 0.327 6 个月 0.69±0.26 0.88±0.20 0.92±0.15 3.371 0.046 24 个月 0.82±0.20 0.67±0.23 0.82±0.20 0.779 0.475 F 4.925 15.257 34.766 P 0.004 0.000 0.000 0.39±0.15 1 个月 0.81±0.17 0.83±0.17 0.84±0.14
2.3.2 靶患肢累积一期通畅率及累积免于不良事件发生率分析 累积一期通畅率36 个月支架组和联合组优于溶栓组(P=0.020、P=0.036),支架组与联合组比较差异无统计学意义(P>0.05);60 个月支架组和联合组优于溶栓组(P=0.032、P=0.036),支架组与联合组比较差异无统计学意义(P>0.05),见表6。术后36 个月及60 个月各组患者免于不良事件发生率相比差异无统计学意义(P>0.05)。
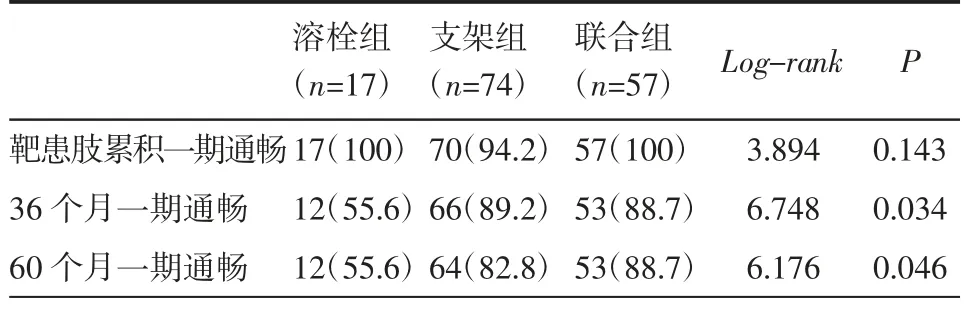
表6 随访期间靶患肢累积一期通畅率比较[n(%)]Tab 6 Comparison of primary patency of target limbs[n(%)]
3 讨论
AIOD 是中老年人下肢缺血的常见原因,病变向上可达到肾动脉水平,向下可累及双侧髂动脉,是临床常见的动脉硬化闭塞性疾病[14]。2007 年提出的TASC Ⅱ共识将主-双股动脉搭桥术作为治疗的标准术式,但其较高的围手术期并发症率以及死亡率使患者承受着巨大的手术风险。近年来,随着腔内治疗器械和设备的不断发展,腔内治疗已经成为TASC ⅡD 级AIOD 患者首选治疗方法。根据欧洲心脏病学会与欧洲血管外科学会2017 年指南推荐对有严重合并症的长段或双侧病变的AIOD 患者首选腔内治疗(Ⅱa 级推荐)[15]。TASC ⅡD 级AIOD 患者长段闭塞部位的两端多为内膜斑块增生导致的狭窄闭塞,中间多为血栓,病变处血栓的存在会影响治疗方案的选择[14]。CDT 是将溶栓导管直接插入靶血管病变处并持续注入溶栓药物,从而起到局部高浓度溶栓药物溶解血栓的作用。既往研究表明CDT 主要用于辅助治疗下肢动脉缺血性疾病伴有急性或亚急性期血栓的患者[11,16-17],但随着其使用经验的逐渐累积,目前对于慢性主髂动脉闭塞病变者使用CDT 辅助治疗也不乏成功的报道[18-20]。
本次研究共有105 例TASC ⅡD 级AIOD 患者选择腔内治疗方式重建靶病变血运;其中100 例患者成功通过腔内方式开通靶患肢血运,靶患肢手术成功率93.6%(148/158)。联合组与支架组相比手术成功率方面无明显差异,但经CDT 治疗的患者中有78.8%的患者术中TASCⅡ分级降低,并且联合组支架置入长度远低于原始病变长度,而支架组支架长度与原始病变长度比较无差异。因此,CDT 可缩短置入支架的长度,这有助于维持在体支架的稳定性,该结果与之前发表的结论一致[21],证实了CDT辅助治疗AIOD 患者的有效性。此外,联合组与支架组相比射线暴露时间缩短,减少射线暴露时间可降低放射线对患者及医疗人员健康的影响,并且在联合CDT 治疗期间无出血相关事件发生,这使得该辅助治疗方式的安全性得到证实。
CDT 可通过软化病变或消除血栓负荷来辅助随后的治疗。本组研究结果显示单纯溶栓组患者手术成功率低,术后ABI 值及Rutherford 分级改善程度不及支架组和联合组。联合组患者术后ABI 值、Rutherford 分级改善程度、一期通畅率、免于不良事件发生率与支架组比较差异无统计学意义。本研究结果显示:CDT 联合支架血管成形术治疗复杂病变的AIOD 患者虽不能提升靶患肢近中期一期通畅率,但可作为一种辅助治疗的方式用于减少腔内处理强度、缩短术中射线暴露时间以及减少腔内支架长度,这与之前研究结果一致[14]。
综上,CDT 辅助金属支架治疗AIOD 患者临床疗效好,安全性高,可作为处理复杂病变AIOD 患者可靠的腔内治疗方式。
