非洛地平纳米晶的固体化及大鼠体内药动学研究
2022-06-08吴玉萍李芳平
吴玉萍,李芳平,周 盾
1.武汉市红十字会医院中医科,武汉 430015;2.武汉市红十字会医院药剂科,武汉 430015;3.武汉市第一医院中医科,武汉 430015
非洛地平为二氢吡啶类钙通道阻滞剂,通过选择性扩张小动脉而达到降血压作用[1],由于其溶解度较差(溶解度<0.5 μg·mL-1)[2],并且存在肝脏首过效应[3],导致口服生物利用度较低(约为15%)[4]。目前已经开发了几种口服制剂来提高非洛地平的口服生物利用度,包括固体脂质纳米粒[5]、自乳化释药系统[6]、固体分散体[7]和介孔二氧化硅纳米粒[8]等。纳米晶是由药物和稳定剂(高分子聚合物和/或表面活性剂)构成的粒径小于1 μm(通常为200~500 nm)的胶体分散体[9],其在提高药物溶出速率、改善药物生物利用度、降低药物毒性和不良反应等方面具有显著优势[10]。本研究采用介质研磨法将非洛地平制备成纳米晶,并通过流化床层积上药技术将其固化到蔗糖丸芯上,制得非洛地平纳米晶微丸[11],并通过大鼠体内药动学评价其口服生物利用度,为改善非洛地平的口服生物利用度提供一种有效方法。
1 仪器与试药
1.1 仪器
DRS2000高速高剪切乳化分散机(德国IKA公司);DYNO-Mill Research Lab介质研磨机(华尔宝机械有限公司);氧化锆珠粒(直径为0.4 mm,萍乡市中欧新材料有限公司);Malvern Zetasizer Nano ZSE纳米粒度电位仪(英国马尔文公司);FEI Nova 400型场发射扫描电子显微镜(美国FEI公司);RT600溶出度仪(深圳市锐拓仪器设备有限公司);Midi Glatt型流化床(德国格拉特有限公司);DSC3型差示扫描量热仪(梅特勒-托利多国际有限公司)。
1.2 试药
非洛地平(江苏联环药业股份有限公司,批号20200311,质量分数为99.5%);聚乙烯吡咯烷酮K30(PVP K30,德国巴斯夫有限公司);羟丙基纤维素SSL(HPC SSL,日本曹达株式会社);吐温-80(Tween-80,湖南新绿方药业有限公司);蔗糖丸芯(杭州高成生物营养技术有限公司);维生素E聚乙二醇琥珀酸酯(TPGS,上海昌为医药辅料技术有限公司);去离子水(实验室自制);非洛地平片(规格:5 mg,阿斯利康制药公司)。
2 方法与结果
2.1 非洛地平纳米晶的制备
采用介质研磨法制备非洛地平纳米晶[12]。称取HPC SSL 1 g和TPGS 0.1 g,加水至100 mL,搅拌至完全溶解;另称取粒径(D90)约为5~10 μm的非洛地平原料药12.5 g,加入到上述溶液中,分散均匀后经高速高剪切乳化机以10 000 r·min-1剪切分散10 min;将上述非洛地平混悬液加入到介质研磨机中,并按照药物溶液体积与研磨介质体积比为1∶1加入直径为0.4 mm的氧化锆珠粒,设定研磨速度为2 500 r·min-1,研磨时间为4 h,即得到非洛地平纳米晶。
2.2 非洛地平纳米晶微丸的制备
以蔗糖丸芯为载体通过流化床层积上药工艺将非洛地平纳米晶负载到蔗糖丸芯表面。取新制备的非洛地平纳米晶100 mL,加入PVP K30 4 g搅拌至完全溶解,即得到非洛地平纳米晶载药溶液,备用;称取蔗糖丸芯400 g(丸芯直径为20~40目),置于流化床中,预热后进行丸芯载药;微丸层级上药工艺参数为:进风温度为45~50 ℃,物料温度为35~38 ℃,风机频率为20~25 Hz,喷液速率为2~4 mL·min-1,雾化压力为1.5~2.0 bar,工艺参数需根据实际情况进行调节,直至实验结束;将制备的非洛地平纳米晶微丸在40 ℃烘箱中干燥过夜,备用。
2.3 纳米晶微丸质量评价
2.3.1微丸层积上药前、后质量对比 取非洛地平纳米晶微丸,加入去离子水,轻轻振摇后直至微丸完全消散,溶液中无肉眼可见颗粒,取上述溶液测定粒径分布、PDI和Zeta电位,并与同一批非洛地平纳米晶的粒径分布、PDI和Zeta电位进行比较。每份样品测定3次,取平均值。结果见表1。

表1 非洛地平纳米晶微丸层积上药前后质量对比
结果显示,微丸层积上药前后其粒径、PDI和Zeta电位与载药前相比几乎无变化,说明微丸层积上药工艺不会对非洛地平纳米晶质量产生影响[13]。
2.3.2扫描电镜观察 取少量经去离子水适当稀释的非洛地平纳米晶铺展到锡箔纸表面,自然风干,使用导电胶带将样品黏附到样品台上,真空条件下采用30 mA电流对样品喷金,在扫描电镜下观察其微观形态,并拍摄照片,见图1。由图1可知,非洛地平纳米晶呈不规则状颗粒状,其粒径大部分在100~400 nm范围内分布。

图1 非洛地平纳米晶扫描电镜图
2.3.3差示扫描量热法(DSC) 使用DSC法对非洛地平原料药、稳定剂、非洛地平原料药与稳定剂的物理混合物和非洛地平纳米晶进行热分析,以评估非洛地平纳米晶中药物的存在形式[14]。精密称取上述样品各5~8 mg,分别置于铝锅中,密封,并在30 mL·min-1的氮气流下以5 ℃·min-1的升温速率将样品从25 ℃加热至200 ℃,同时以密封的空铝锅作为对照,结果见图2。
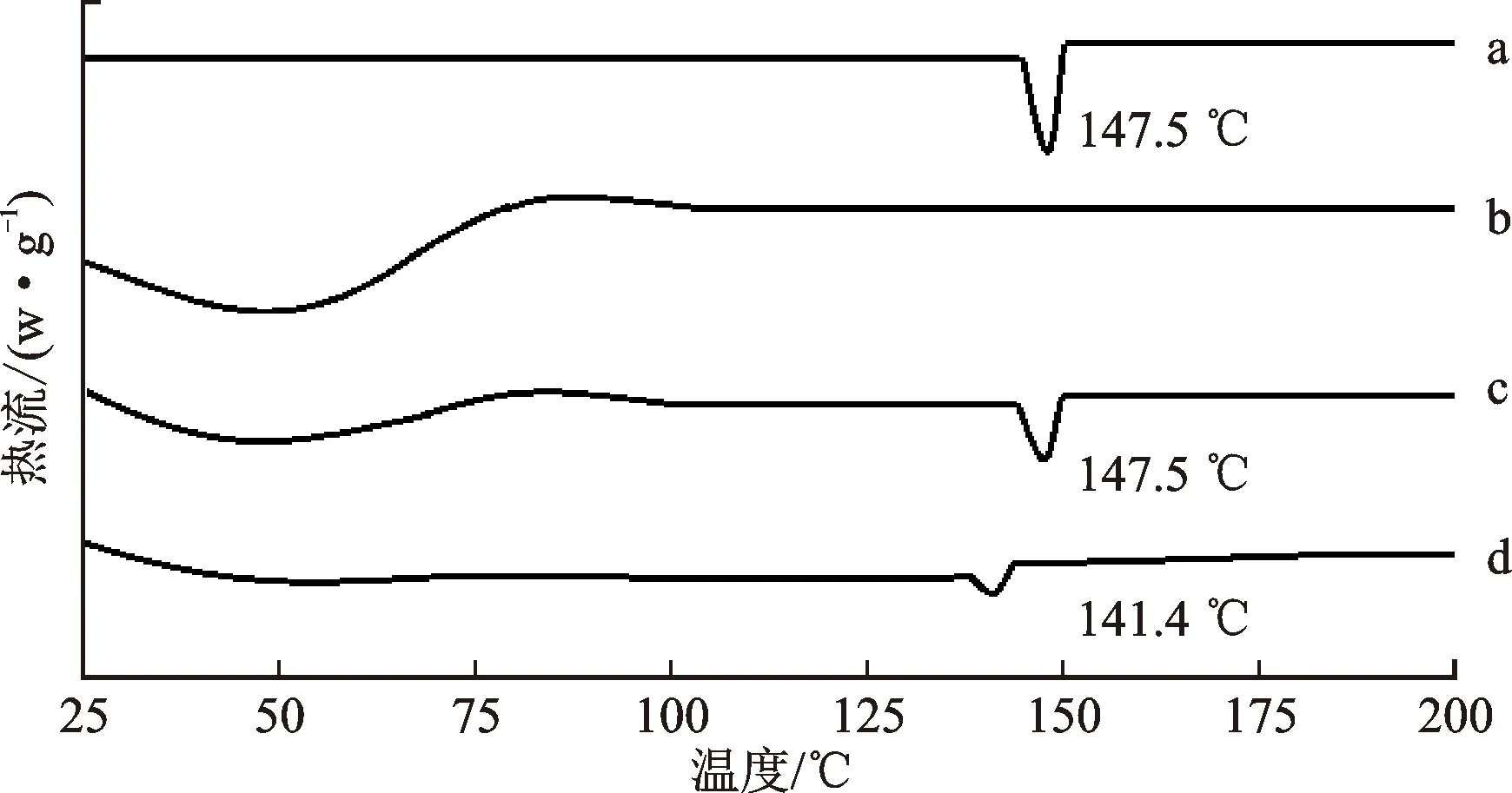
图2 原料药(a)、稳定剂(b)、物理混合物(c)和纳米晶(d)的DSC图
测定结果显示,非洛地平原料药和物理混合物均在147.5 ℃出现特征吸热峰,而非洛地平纳米晶在141.4 ℃出现了特征吸热峰,与原料药相比,纳米晶的特征吸热峰出现了轻微前移,熔点有所降低,这可能是由于非洛地平在研磨过程中降低了其内聚能,导致其熔点降低[15]。
2.3.4体外溶出度比较 通过体外溶出实验比较非洛地平纳米晶、纳米晶微丸和非洛地平片的体外药物溶出速率,参照《中华人民共和国药典》(以下简称《中国药典》)2020年版,搅拌桨转速为50 r·min-1,pH1.2盐酸溶液(吐温-80质量浓度为0.2 mg·mL-1)作为溶出介质,体积为500 mL,水浴温度为37 ℃±0.5 ℃,分别取非洛地平纳米晶、纳米晶微丸和非洛地平片(含药物量均为5 mg)加入到溶出杯中,分别在5、10、15、30、45、60 min取出溶出介质5 mL(同时补液),经0.1 μm微孔滤膜过滤,滤液经适当稀释后通过高效液相色谱(HPLC)法定量分析,结果见表2。

表2 非洛地平纳米晶、纳米晶微丸和非洛地平片的体外溶出度
结果显示,与非洛地平片相比,非洛地平纳米晶和纳米晶微丸中的药物溶出速度和程度均得到显著提高。
2.4 大鼠药动学研究
2.4.1色谱条件 色谱柱为Phenomenex C18柱(150 mm×4.6 mm,5 μm),保护柱为Phenomenex C18柱(4.0 mm×3.0 mm,5 μm),流动相为乙腈-水(65∶35),检测波长为254 nm,柱温为30 ℃,流速为1.0 mL·min-1,进样量为20 μL。
2.4.2血浆处理 用乙醚麻醉SD大鼠,使用毛细管经大鼠眼眶后神经丛采血,并收集到内壁涂有肝素的离心管中离心,分离血浆,取大鼠血浆100 μL,加入质量浓度为300 μg·mL-1的双氯芬酸钠水溶液10 μL作为内标,涡旋振荡30 s,加入乙腈190 μL,涡旋3 min,离心,沉淀出血浆蛋白,取上清液转移到尖底离心管中,氮气下挥干溶剂,残留物用100 μL流动相复溶,以10 000 r·min-1离心5 min,取上清液按照2.4.1项下色谱条件检测药物含量,计算药物质量浓度。
2.4.3标准曲线及方法学验证 配制不同质量浓度的非洛地平溶液,并分别精密移取20 μL加入到大鼠血浆100 μL中,再分别加入内标溶液10 μL,涡旋混合,配制质量浓度分别为0.1、0.5、1.0、5.0、10.0、50.0 μg·mL-1的非洛地平血浆样品,按照2.4.2项下方法处理血浆样品,采用2.4.1项下色谱条件进样分析,以主药峰面积(As)与内标物峰面积(Ai)之比作为纵坐标,以主药质量浓度(C)为横坐标,得到线性回归方程为:As/Ai=9.361C-0.216(r=0.998 7),线性关系良好。
另配制非洛地平质量浓度分别为0.1、5.0、50.0 μg·mL-1的血浆样品,各3份,加入内标溶液,涡旋混合,按照2.4.2项下方法处理血浆样品,采用2.4.2项下色谱条件进样分析,评价该方法的精密度和提取回收率。结果显示,低、中、高3个质量浓度非洛地平溶液的方法精密度RSD值分别为6.4%、4.9%、5.4%,提取回收率分别为95.7%、96.1%、98.9%,说明本方法重复性好,提取回收率高,可用于血浆样品分析。
2.4.4动物实验 取12只SD大鼠,体质量为(220±20) g,雌雄各半,实验前12 h内禁食不禁水。将大鼠随机分为2组,第一组大鼠灌胃给予非洛地平混悬液(分散介质为PVP K30溶液),第二组大鼠灌胃给予非洛地平纳米晶微丸,给药剂量均为30 mg·kg-1,在规定的时间点(0.083、0.167、0.25、0.5、0.75、1、2、4、8、12、24 h)通过眼眶后神经丛采血0.5 mL,并收集到肝素化离心管中,离心,分离血浆,于-18 ℃下冷冻保存,测定前将血样在室温环境下解冻,按照2.4.2项下方法处理血浆样品,采用2.4.1项下色谱条件进样分析,用3P87软件计算药动学参数,见表3,并绘制血药质量浓度时间曲线,见图3。

表3 非洛地平纳米晶微丸和非洛地平混悬液在大鼠体内的药动学参数
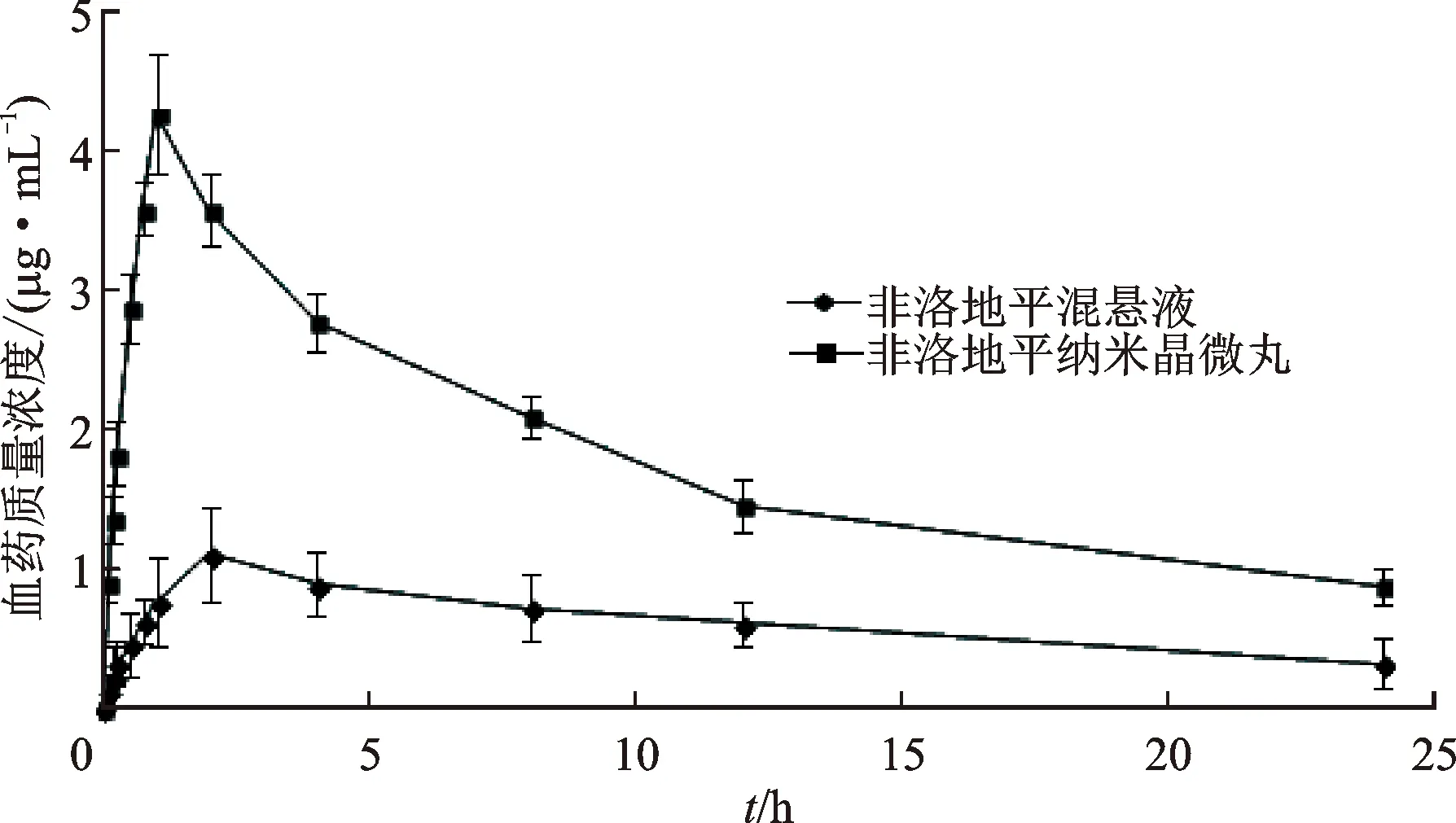
图3 非洛地平纳米晶微丸和非洛地平混悬液的平均血药质量浓度与时间曲线
大鼠体内药动学结果显示,与非洛地平混悬液相比,非洛地平纳米晶微丸Cmax显著提高,为非洛地平混悬液的3.70倍;纳米晶微丸的AUC(0~∞)是非洛地平混悬液的2.43倍,说明非洛地平纳米晶微丸可显著提高药物的口服生物利用度。
3 讨论
目前已有报道的纳米晶固体化方式主要包括喷雾干燥法、喷雾冷冻干燥法、冷冻干燥法和微丸层积上药法等[16]。其中,微丸层积上药法对设备、工艺要求较简单,且易于操作,重复性良好,已在纳米晶固体化的研究中获得广泛应用,因此本研究以蔗糖丸芯为载体采用流化床层积上药工艺将非洛地平纳米晶固化成纳米晶微丸。但在微丸层积上药过程中,非洛地平纳米晶会短暂地暴露在热环境中,稳定性降低,此外,随着固化的进行,稳定剂最终会连同纳米晶被固化在微丸表面,保护作用消失,这些因素都可能导致纳米晶体的不可逆聚集[17]。本研究通过实验研究证实,非洛地平纳米晶在层积上药后,其平均粒径、PDI、Zeta电位以及药物溶出速率与上药前相比几乎无变化,说明微丸层积上药工艺不会对非洛地平纳米晶质量产生影响。
