同时测定血浆血管紧张素Ⅰ、Ⅱ和醛固酮的液相色谱串联质谱法的建立与评价
2022-06-07于蕾胡滨吴洁李倩倩陈宝荣北京金域医学检验实验室有限公司实验诊断部北京000北京化工大学化学学院北京0009沃特世科技北京有限公司北京0076
于蕾,胡滨,吴洁,李倩倩,陈宝荣(.北京金域医学检验实验室有限公司实验诊断部,北京 000;.北京化工大学化学学院,北京 0009;.沃特世科技(北京)有限公司,北京 0076)
继发性高血压的精准诊断是高血压诊疗的难点。2020年王梦琳等[1]报道我国高血压专科患者中继发性高血压占39.26%。原发性醛固酮增多症(primary aldosteronism,PA)是最常见的继发性高血压疾病之一[2-3]。《原发性醛固酮增多症诊断治疗的专家共识(2020版)》推荐ARR为PA筛查的首选指标[2]。ARR包括醛固酮(aldosterone,Aldo)与血浆肾素活性的比值和醛固酮与血浆肾素浓度的比值两种形式。放射免疫分析法(RIA)测定的是肾素活性,即单位时间内血管紧张素原转化为血管紧张素Ⅰ的水平,间接反映血浆中肾素活性水平。化学发光法测定的是肾素浓度。根据RAAS血压调控机制和既往研究,血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)和Aldo是PA等继发性高血压筛查和鉴别诊断的主要实验室依据[4]。
既往AngⅠ和Aldo的检测方法包括RIA、化学发光法(CLIA)、高效液相色谱法等[4-6],而AngⅡ的检测方法主要是RIA[6]。由于免疫学方法测定上述激素存在非特异性干扰,van der Gugten等[7]建立了液相色谱串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)测定AngⅠ的方法,Meunier等[8]建立了LC-MS/MS测定血浆Aldo的方法。受技术发展的限制,直至2021年,Chen等[9]采用LC-MS/MS建立了同时检测肾素活性、AngⅡ和Aldo的方法。鉴于AngⅠ、AngⅡ和Aldo对PA鉴别诊断的重要价值,本实验室在充分研究AngⅠ、AngⅡ和Aldo分子结构与测量特性的基础上,建立了一种新的可同时检测上述3种重要血浆成分的LC-MS/MS方法,现介绍如下。
1 材料与方法
1.1 主要仪器与试剂 超高效液相色谱串联Xevo TQ-S质谱仪(美国Waters公司);AcquityTMpremier HSS T3色谱柱(100×2.1 mm,1.8μm,美国Waters公司);96孔固相萃取SPE板(Oasis MAXμElution SPE,美国Waters公司);Eppendorf手动移液器(德国Eppendorf公司)。
标准品为AngⅠ(纯度>99%,批号20202120-4,上海谱芬公司)、AngⅡ(纯度>99%,批号2020421-4,上海谱芬公司)、Aldo(纯度>99.1%,批号FN05141904,美国Cerilliant公司);内标品为AngⅠ-[13C6,15N](纯度≥95%,批号1756675,美国Anaspec公司)、AngⅡ-[13C6,15N](纯度≥95%,批号1955630,美国Anaspec公司)、Aldo-[2H7](纯度≥98%,批号PG1-2019-216A1,美国Isosciences公司)。甲醇、乙腈、甲酸、异丙醇均为HPLC级,购自德国Merck公司;氨水(优级纯,国药集团化学试剂公司)、水为一次蒸馏水;牛血清清蛋白(BSA)、磷酸盐缓冲液(PBS)、大豆胰蛋白酶抑制剂(SBTI)、苯甲基磺酰氟(PMSF)、乙二胺四乙酸(EDTA)、三羟甲基氨基甲烷(Tris-base)均购自美国Sigma-Aldrich公司。
1.2 BSA缓冲液和温育液配制
1.2.1 BSA缓冲液配制 精密称量0.1 g BSA加入10 mL 0.01 mol/L的PBS缓冲液中,配制成浓度为10 mg/mL的BSA缓冲液。
1.2.2 温育液配制 称取7.40 g EDTA、12.11 g Tris-base、0.063 g PMSF和0.01 mg SBTI,加入90 mL蒸馏水溶解,用乙酸调节pH为5.4~5.5。
1.3 标准曲线和内标液配制
1.3.1 标准曲线配制
1.3.1.1 单一标准品储备液配制 用十万分之一精密电子天平分别称取AngⅠ、AngⅡ和Aldo标准品各0.02 mg,移液器准确加入1 mL 20%乙腈溶解,配制浓度均为20μg/mL的单一标准品储备液。
1.3.1.2 混合标准品储备液配制 移取不同体积的单一标准品储备液,20%乙腈稀释得到AngⅠ、AngⅡ、Aldo浓度为10、0.1、1μg/mL的混合标准品储备液。
1.3.1.3 S1~S10标准曲线配制 用BSA缓冲液将混合标准品储备液倍比稀释至10个浓度,AngⅠ浓度为0、0.1、0.2、0.5、1、2、5、10、50、100 ng/mL;AngⅡ为0、0.001、0.002、0.005、0.010、0.020、0.050、0.100、0.500、1.000 ng/mL;Aldo为0、0.01、0.02、0.05、0.1、0.2、0.5、1.0、5.0、10.0 ng/mL。
1.3.2 内标液配制
1.3.2.1 单一内标储备液配制 称取AngⅠ-[13C6,15N]、AngⅡ-[13C6,15N]和AngⅡ-[13C6,15N]各0.01 mg,移液器取1 mL 20%乙腈溶解,配制浓度均为10μg/mL的单内标储备液。
1.3.2.2 混合内标储备液配制 移取不同体积的单内标储备液,20%乙腈稀释得到3种化合物对应内标浓度为50、20、500 ng/mL的混合内标储备液。1.3.2.3 内标工作液配制 用20%乙腈稀释混合内标储备液至AngⅠ-[13C6,15N]、AngⅡ-[13C6,15N]、Aldo-[13C6,15N]浓度为0.5、0.2、5 ng/mL的内标工作液。
1.4 样本前处理
1.4.1 预处理样本 分别取200μL待测样本,加入200μL温育液,在37℃温育3 h后加300μL内标工作液,得到预处理样本。
1.4.2 固相萃取 在96孔正压装置上,用200μL含1%甲酸的50%乙腈水溶液活化SPE板。取550 μL预处理样本至SPE板上,然后加200μL含1%氨水的10%甲醇洗涤杂质。接着将SPE板下方的废液板更换为96孔样品板,用40μL含1%甲酸的50%乙腈水溶液洗脱待测物并收集至样品板待测。
1.5 LC-MS/MS分析
1.5.1 色谱条件 色谱柱:AcquityTMpremier HSS T3;柱温:40℃;进样量:15μL;运行时间:5 min;流动相:A为0.1%甲酸水溶液,B为乙腈;流速0.4 mL/min的液相梯度见表1。
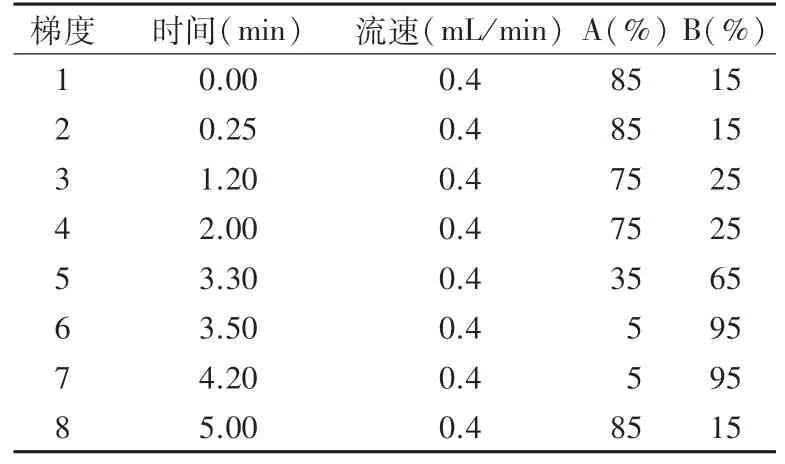
表1 流动相梯度
1.5.2 质谱条件 质谱分析采用电喷雾离子源(ESI);监测模式:多反应监测(MRM);毛细管电压:1.00 kV;离子源温度:50℃;去溶剂气温度:550℃;去溶剂气流速:1 100 L/h。AngⅠ、AngⅡ和Aldo的定量监测离子对质荷比(m/z)分别为:433.1>619.4、349.8>136.1、359.2>331.1,对应内标品定量离子对(m/z)分别为:435.4>625.5、352.1>136.2、367.3>339.2;碰撞电压:30 V。
1.6 方法学性能评价 根据《液相色谱-质谱临床应用建议》[10]对建立的方法进行性能评价。
1.6.1 线性 取10个浓度点的标准曲线S1~S10,按1.4样本前处理后,重复检测3次。使用多元回归方程评价线性,记录线性方程和相关系数(r)。各浓度点实测值与理论值偏差<15%,CV<15%且r>0.998,可用于样本定量。
1.6.2 检出限(LOD)和定量限(LOQ) LOD是指方法在规定的实验条件下所能检出分析物的最低浓度,而LOQ是方法能准确检测的最低浓度。选择AngⅠ、AngⅡ和Aldo浓度分别为0.1、0.001、0.01 ng/mL,0.2、0.002、0.02 ng/mL,0.5、0.005、0.05 ng/mL的3个低浓度水平样本进行测定,每个浓度水平的样本重复检测10次。信噪比>3的最低浓度为本法的LOD。若同时满足信噪比>10且连续进样CV<15%的最低浓度为本法的LOQ。
1.6.3 回收率 在正常人低值血浆中分别添加不同浓度的AngⅠ、AngⅡ和Aldo标准品,制备3个不同浓度水平的待测样本。其中,AngⅠ的浓度分别为5.0、20.0、50.0 ng/mL;AngⅡ的浓度分别为0.020、0.080、0.200 ng/mL;Aldo的浓度分别为0.10、0.40、1.00 ng/mL。在同一天内完成3个浓度样本、每个浓度样本重复6次的检测,并同时测定空白血浆浓度。每个样本按实测浓度/理论浓度×100%计算回收率。
1.6.4 实验室间比对 采用本法检测2021年国家卫生健康委临床检验中心室间质评样本202112、202114、202115的AngⅠ、AngⅡ和Aldo浓度。根据给定的质谱法靶值(多家实验室测定结果的稳健均值)判断本室测量结果的准确性。
1.6.5 精密度 根据《液相色谱-质谱临床应用建议》[10],测定低、中、高3个浓度水平样本进行精密度评估。每个浓度水平样本每天测量5次,连续测3天,计算同一批次内5个样本(批内)和3个批次(批间)的变异系数CV。建议CV应<15%。
1.6.6 基质效应 选取5人血浆和溶剂基质,前处理后分别添加低、高浓度标准品。其中,溶剂基质为20%乙腈,添加的AngⅠ、AngⅡ、Aldo低浓度标准品为5.0、0.050、0.50 ng/mL,高浓度为50.0、0.500、5.00 ng/mL。此外,向上述样本中均加入相同体积的内标工作液。经内标校正后,若血浆基质与溶剂基质的信号比值在85%~115%范围,可认为无明显基质效应。
1.6.7 携带污染 即评估高值样本对低值样本的影响。其中,高值样本AngⅠ、AngⅡ和Aldo浓度分别为:50.0、0.500、5.00 ng/mL,低值样本为:0.2、0.002、0.020 ng/mL。首先低值样本连续进样5次,然后高、低样本交替进样5次。计算连续进样和交替进样的低值样本的差值,应小于连续进样的3倍标准差(SD)。
1.6.8 冻融次数 样本多次冻融可能会影响实验结果,因此进行样本的反复冻融实验。选取4例临床样本,分别进行冻融1、2、3次实验,查看样本反复冻融对结果的影响。
1.6.9 参考区间验证 随机选择25名无血压增高的健康志愿者,男性11名,女性14名,年龄23~43岁。采集清晨空腹静脉血到EDTA-K2抗凝管中,并立即离心(25℃,10 min,离心力1 000×g),采用LC-MS/MS法检测各血浆样本中AngⅠ、AngⅡ和Aldo浓度。
2 结果
2.1 AngⅠ、AngⅡ和Aldo的代表色谱图 血浆中AngⅠ、AngⅡ和Aldo的色谱图见图1,该方法分析时间为5 min。AngⅠ、AngⅡ和Aldo能有效分离,峰型对称,保留时间分别为1.93、1.83和3.33 min。
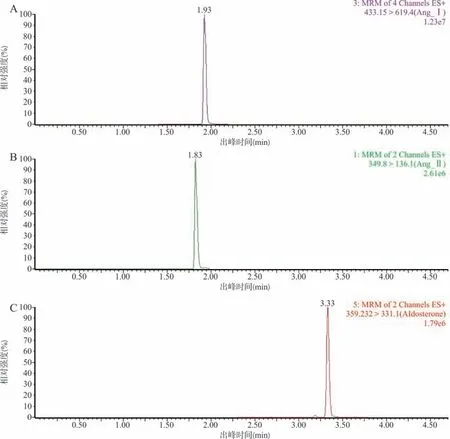
图1 AngⅠ、AngⅡ和Aldo色谱图
2.2 线性 将AngⅠ、AngⅡ及Aldo的10个浓度标准曲线点S1~S10采用本法检测,AngⅠ、AngⅡ和Aldo浓度范围分别为0.2~50.0 ng/mL、0.002~0.500 ng/mL、0.02~5.00 ng/mL时,各浓度点实测值与理论值偏差均<10%且CV<15%。AngⅠ、AngⅡ和Aldo的拟合线性方程为:y=0.803x+0.021、y=0.003x-0.001和y=0.003x(r=0.999,P<0.001),线性评价通过。
2.3 LOD和LOQ 样本中AngⅠ、AngⅡ和Aldo浓度为0.1、0.001、0.01 ng/mL时,信噪比均>3,该浓度为本法的LOD。而样本中AngⅠ、AngⅡ和Aldo浓度为0.2、0.002、0.02 ng/mL时,连续进样10次,信噪比均>20且同时满足连续进样CV为1.8%~9.8%,该浓度为本法的LOQ。
2.4 回收率 采用本法测定血基质空白、低、中、高浓度样本,去除空白样本浓度后,AngⅠ、AngⅡ、Aldo的加标回收率分别为91%~95%、98%~103%、91%~93%。加标回收率均在85%~115%之间,结果见表2。
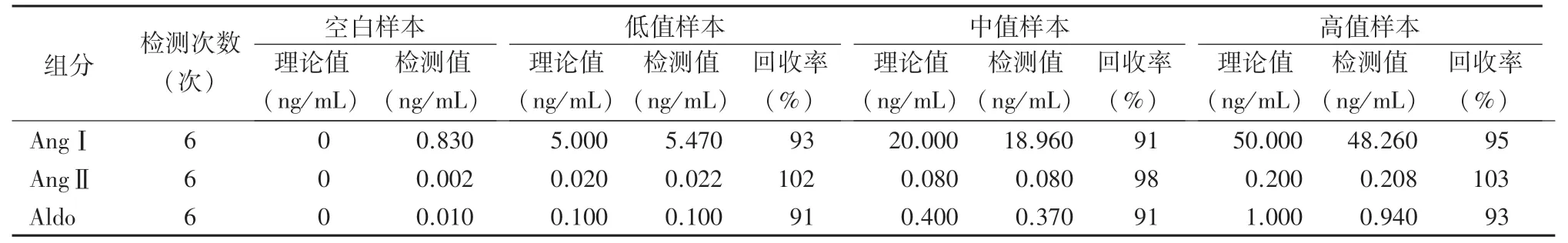
表2 AngⅠ、AngⅡ和Aldo的加标回收率
2.5 实验室间比对 采用本方法测定国家卫生健康委临床检验中心2021年室间质评3个样本202112、202114、202115,本方法AngⅠ、AngⅡ和Aldo检测值与靶值偏差为-9.7%~7.2%,检测结果全部在国家卫生健康委临床检验中心给定的等效范围内(见表3)。
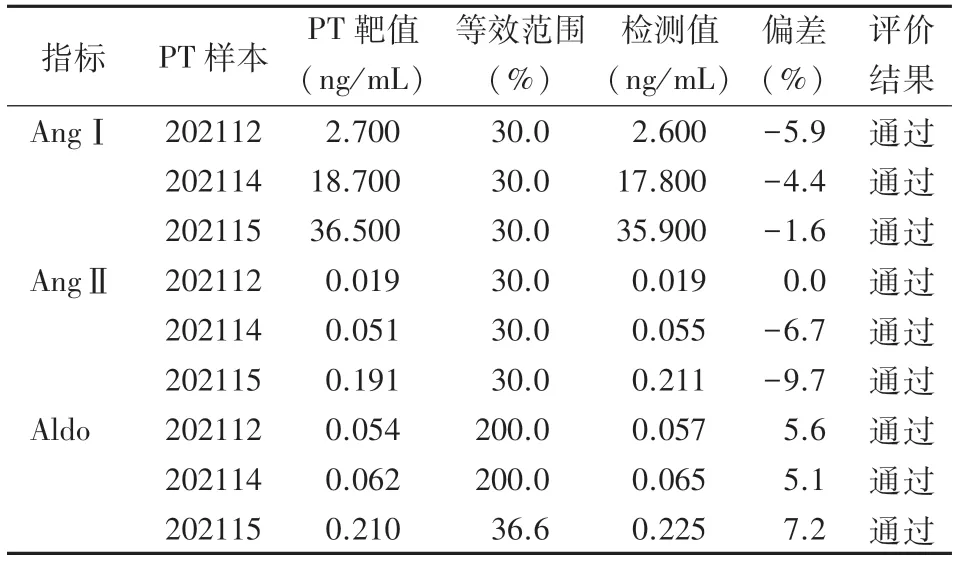
表3 实验室间比对结果
2.6 精密度 对低、中、高3个不同浓度的样本连续检测3 d、每天检测5个平行样本,结果见表4。AngⅠ、AngⅡ和Aldo的批内CV分别为1.4%~3.6%、2.2%~5.1%、2.4%~3.3%;批间CV分别为1.5%~4.6%、2.1%~4.4%、3.0%~5.2%,本法精密度良好。
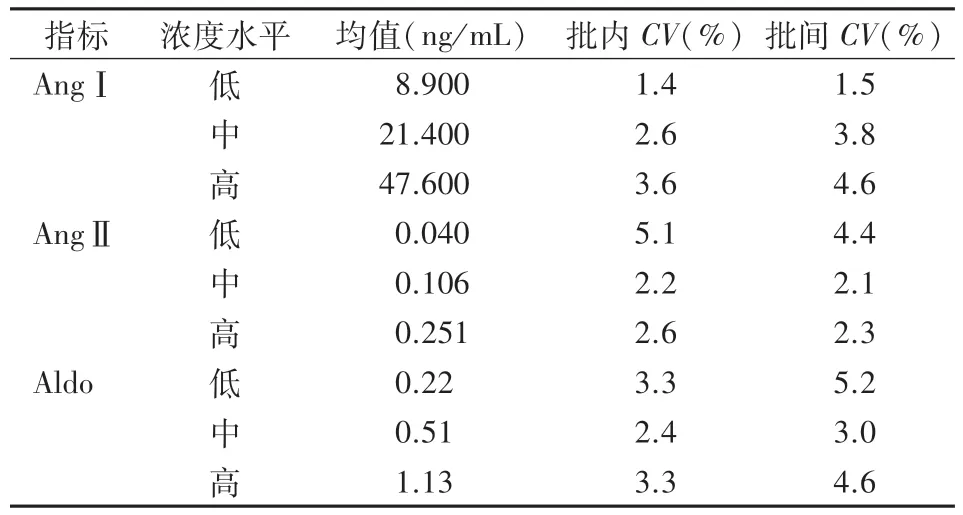
表4 AngⅠ、AngⅡ和Aldo的精密度
2.7 基质效应 通过内标校正后,5名研究对象血浆基质与溶剂基质的信号比值分别为85%~100%(AngⅠ)、90%~109%(AngⅡ)、106%~114%(Aldo),均在85%~115%范围。表明加入内标品后,可有效补偿基质增强或抑制,该方法无明显基质效应。
2.8 携带污染 AngⅠ低值样本连续进样和高、低值样本交替进样峰面积差值为173.2,小于连续进样的3SD(227.6)。因此,当AngⅠ样本浓度低于50 ng/mL时,携带污染可忽略。而AngⅡ和Aldo无携带污染。
2.9 样本冻融次数 进行样本反复冻融实验,以4例临床样本AngⅠ、AngⅡ和Aldo的浓度平均值随冻融次数的变化,评估反复冻融对检测结果的影响。对于AngⅠ和Aldo,样本冻融2次和3次,浓度变化均在1.5%以内,无明显差异。而AngⅡ,样本冻融2次变化较小;样本冻融3次,结果明显降低29.5%。因此,建议样本冻融次数不超过2次。
2.10 参考区间验证 对临床表观正常、无RAAS相关基础疾病的25名健康志愿者样本采用该方法进行检测,所有人均为坐位采血。检测结果如下:成人血浆中AngⅠ、AngⅡ、Aldo的浓度范围分别为1.4~11.8 ng/mL、0.003~0.016 ng/mL、0.02~0.20 ng/mL。肾素活性0.47~3.95 ng·mL-1·h-1,与徐雯等[11]建立的参考区间(0.25~5.12 ng·mL-1·h-1)一致。AngⅡ浓度与美国实验室Mayo Clinic参考区间0.005~0.040 ng/mL对应[12]。Aldo浓度也与Meunier等[8]测定范围(0.02~0.23 ng/mL)相符。
3 讨论
采用不同的测量原理、不同方法学测量RAAS的3个激素时,由于使用非同源测量方法常导致临床测量结果合理分析、正确使用难度大。因此,血浆AngⅠ、AngⅡ和Aldo同时检测一直是临床实验室的期望。受测量技术、仪器性能等的影响,既往一个方法一般仅能检测其中一项。首先,AngⅠ、AngⅡ和Aldo化学性质差异较大,AngⅠ和AngⅡ为生物大分子且电离后为多电荷正离子,而Aldo为小分子且电离后为负离子,要将3种物质完全分离并达到检测质量要求,对检测仪器性能要求很高;其次,AngⅡ在血浆中含量极低,约5~40 pg/mL,检测困难;此外,AngⅠ和AngⅡ均为分子量1 000以上的多肽类物质,极易与常规使用的C8色谱柱等发生吸附作用,因此在检测前需耗费大量的时间平衡色谱柱。本研究通过优选色谱柱、色谱条件和离子对筛选目标化合物,并采用正负离子切换模式进行检测,在有效分离3种化合物的同时实现样本中AngⅡ检测浓度低至2 pg/mL的准确测量。
与中山医院2021年建立的同时测定肾素活性、AngⅡ和Aldo的方法[9]比较,本研究采用TQ-S质谱仪,通过优化测量条件以及选用专为AngⅠ、AngⅡ等多肽大分子设计的AcquityTMpremier新型色谱柱,灵敏度显著提高。在血浆使用量仅200μL条件下,AngⅠ的LOQ 0.2 ng/mL(比较方法0.33 ng/mL)、AngⅡ的LOQ 0.002 ng/mL(比较方法0.015 ng/mL),能更好地满足临床检测需求。
RIA曾经作为肾素活性检测的“金标准”,可检测肾素的范围是0.2~6.0 ng·mL-1·h-1[13]。而本研究AngⅠ的线性范围为0.2~50.0 ng/mL,本方法可检测的肾素活性范围为0.07~16.7 ng·mL-1·h-1。对于AngⅡ和Aldo,CLIA可检测的线性范围均为0.01~1.00 ng/mL,而LC-MS/MS分别为0.002~0.500 ng/mL和0.02~5.00 ng/mL。对比可知,本研究建立的LC-MS/MS新方法不仅实现了AngⅠ、AngⅡ和Aldo的同时准确测量,也较传统方法的检测范围更宽、灵敏度更高。
本方法通过超高效液相分离技术有效分离待测物,通过同位素内标品和标准品进行校正,保证检测结果的准确性,方法加标回收率在89%~102%之间。检测国家卫生健康委临床检验中心实验室间质量评价样本,其结果表明本法与其他同类实验室测量结果一致性好。另外,采用本法测量了25名健康成人血浆中AngⅠ、AngⅡ、Aldo浓度,结果与文献[8,11-12]报道一致。鉴于本法测量原理可靠,其在测量性能方面已展现出的良好性能,未来是否能助力PA的实验室诊断的标准化,还有待进一步研究证实。
