miRNA-29c对大鼠心肌细胞增殖和凋亡的影响及机制研究*
2022-06-07沈楼怡
沈楼怡,桂 春
(广西医科大学第一附属医院,南宁 530021)
miRNA 是一类高度保守的内源基因编码的非编码单链RNA,在细胞内有多种重要的调节作用,与成熟mRNA结合、调节蛋白质的表达有关。众多研究表明,许多miRNA 在心血管系统中表达,与心脏疾病的发展密切相关,可调控心肌梗死、肥大或心律失常等疾病发生发展[1-2]。然而,miRNA-29c在心肌细胞中的研究却十分有限。笔者经前期生物信息学筛查发现,VEGF可能是miRNA-29c 的靶基因。本实验旨在以大鼠H9C2 心肌细胞为对象,研究miRNA-29c是否通过调控VEGF对H9C2细胞产生生物学行为的影响,分析miRNA-29c对心肌细胞的调控作用,以期为心血管疾病的治疗提供新的思路和治疗策略。
1 材料与方法
1.1 材料
1.1.1 细胞株 大鼠H9C2心肌细胞购自于上海中乔新舟生物科技有限公司。
1.1.2 实验试剂 胎牛血清(FBS)、高糖DMEM培养基购自于美国gibco 公司;逆转录试剂盒和PCR试剂盒购自日本TaKaRa 公司;miRNA-29c 模拟物(mimic)、阴性转染(NC)病毒购自上海吉凯基因有限公司;HRP 标记小鼠抗兔二抗购于美国Santa Cruz 公司;细胞计数试剂盒(CCK-8)购于大连美仑生物公司;兔抗大鼠多克隆GAPDH、VEGF、Bax、Bcl-2、caspase3抗体购自于沈阳万类生物科技公司。
1.2 方法
1.2.1 细胞培养 将大鼠H9C2心肌细胞株置于含10%胎牛血清的高糖DMEM完全培养基中培养,放入5%CO2饱和湿度的37 ℃培养箱培养,适时更换新鲜培养基及传代。
1.2.2 慢病毒转染细胞 将H9C2 心肌细胞分为:不作处理的空白对照(control)组、转染miRNA-29c模拟物的阳性转染(LV-miR-29c-mimic)组;转染空载病毒的阴性转染(LV-NC)组。转染方法:选取对数生长期的大鼠H9C2 心肌细胞,转染感染复数(MOI)为50 的miRNA-29c 模拟物(mimic)及阴性转染(NC)病毒,转染12 h 后更换新鲜培养基,继续培养48 h 后观察荧光情况,后续用含2µg/mL 嘌呤霉素的完全培养基培养及传代,形成混合克隆稳定株。
1.2.3 实时荧光定量聚合酶链式反应(RT-qPCR)法检测大鼠H9C2心肌细胞VEGF和miRNA-29c表达使用Trizol 试剂提取各组细胞总RNA,用Nano Drop 2000 检测总RNA 的纯度和浓度,逆转录及进行PCR扩增。以U6为内参,用2-ΔΔCT法计算miRNA-29c 相对表达水平,以GAPDH为内参,用2-ΔΔCT法计算VEGF相对表达水平。miRNA-29c引物序列:5’-GCCACCATTTGAAATCGGTTA-3’;VEGF引物序列,上游:5’-CGACAGAAGGGGAGCAGAA-3’,下游:5’-GCATTAGGGGCACACAGGA-3’。GAPDH引物序列,上游:5’-GGCACAGTCAAGGCTGAGAATG-3’,下游:5’-ATGGTGGTGAAGACGCCAGTA-3’。
1.2.4 CCK-8法检测miRNA-29c对大鼠H9C2心肌细胞增殖影响 取各组对数生长期的H9C2 细胞,每孔3 000个细胞接种于96孔板中。继续培养24 h、48 h及72 h,加入CCK-8溶液后用酶标仪在450 nm检测并记录吸光度(OD)值。
1.2.5 免疫荧光染色法检测细胞VEGF、Bax、Bcl-2、caspase3 荧光位置及强度 收集各组细胞,4%多聚甲醛固定后用0.1%Triton X-100 透化细胞,5%山羊血清蛋白封闭,加入一抗,4 ℃冰箱过夜,37 ℃二抗孵育1 h,DAPI染色,封片后于显微镜下观察并拍摄图片。细胞核为蓝色,目的表达为红色。
1.2.6 蛋白免疫印迹法(Western blotting)检测细胞VEGF、Bax、Bcl-2、caspase3 蛋白表达 收集细胞,加入细胞裂解液后提取细胞蛋白,测定总蛋白浓度后加入5×蛋白上样缓冲液后进行蛋白变性。蛋白样品用12.5%SDS-PAGE 凝胶电泳后转至PVDF 膜上,经封闭后,加入一抗vegf(1∶500)、GAPDH(1∶5 000)置于4 ℃冰箱孵育过夜,37 ℃HRP标记的二抗(1∶4 000)孵育1 h,ECL显色后,于成像分析系统中曝光及摄像。用Image J 软件分析蛋白条带灰度值。以目的条带与内参条带灰度值的比值作为蛋白表达水平的组间比较。
1.2.7 流式细胞仪检测各组细胞凋亡率 取各组对数生长期的H9C2 细胞,收集离心后弃上清,PBS冲洗细胞2~3次。加入Binding Buffer重悬细胞,用V-APC/7-AAD双染细胞,采用流式细胞仪检测细胞凋亡情况。细胞凋亡率=(早凋细胞数+晚凋细胞数)/总细胞数×100%。
1.3 统计学方法
采用SPSS 22.0 软件进行统计学分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,方差齐,组间两两比较采用LSD-t法;方差不齐,组间两两比较采用Dunnett’s T3法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞miRNA-29c的相对表达量水平
与control 组相比,LV-miR-29c mimic 组相对表达量升高(P<0.01),LV-NC 组则无显著差异(P>0.05),表明miR-29c mimic转染成功,见图1。

图1 3组细胞miRNA-29c的相对表达量水平
2.2 过表达miRNA-29c 对大鼠H9C2 心肌细胞中VEGF、Bax、Bcl-2、caspase3荧光表达的影响
细胞免疫荧光结果可显示VEGF、Bax、Bcl-2、caspase3在H9C2心肌细胞中的定位,主要于细胞质可见,与control组相比,LV-miR-29c mimic组VEGF及Bcl-2 表达减弱,Bax、caspase3 表达增强,LV-NC组无明显差异,见图2。
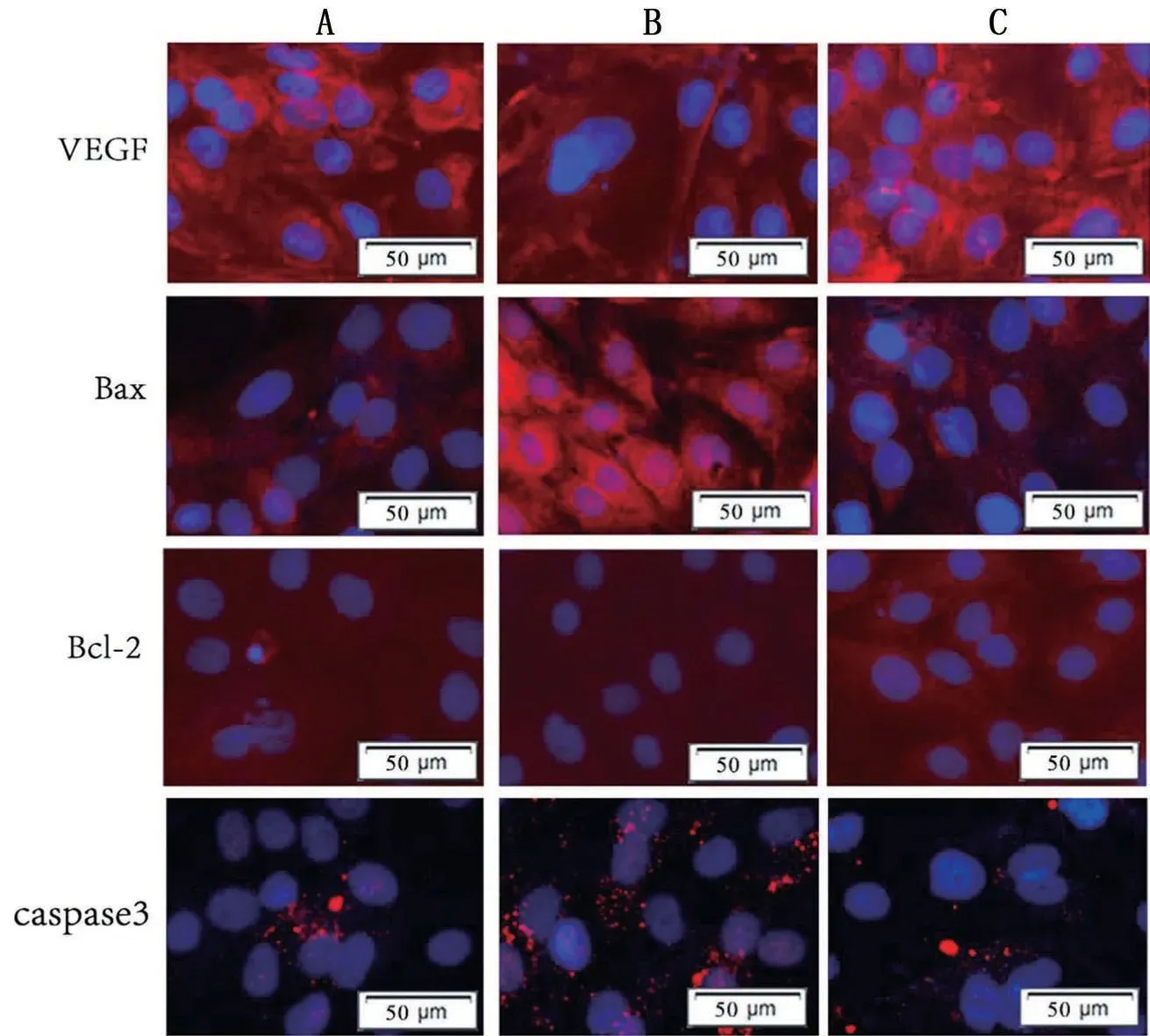
图2 各组大鼠H9C2心肌细胞免疫荧光图(×40)
2.3 过表达miRNA-29c 对大鼠H9C2 心肌细胞中VEGF mRNA表达影响
RT-qPCR 结果显示:与control组比较,LV-miR-29c mimic 组VEGFmRNA 表达量降低(P<0.01),LV-NC组则无显著差异(P>0.05),见图3。
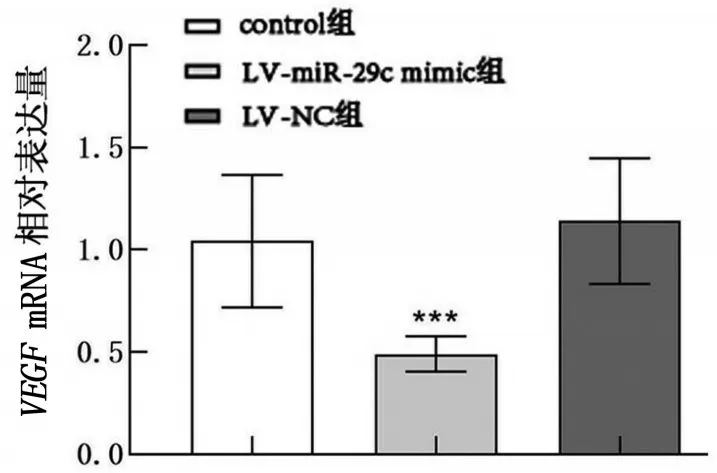
图3 VEGF mRNA的相对表达量
2.4 过表达miRNA-29c 对大鼠H9C2 心肌细胞增殖的影响
CCK-8 检测结果显示,培养24 h、48 h 及72 h后,LV-miR-29c mimic 组的H9C2 细胞增殖水平低于control组(P<0.01),见图4。

图4 CCK-8检测各组H9C2细胞增殖情况
2.5 过表达miRNA-29c 对大鼠H9C2 心肌细胞中VEGF、Bax、Bcl-2、caspase3蛋白表达的影响
与control 组比较,LV-miR-29c mimic组的VEGF、Bcl-2 蛋白表达量均降低(均P<0.05),Bax、caspase3蛋白表达量则升高(均P<0.01),LV-NC组则无显著差异(P>0.05),见图5。
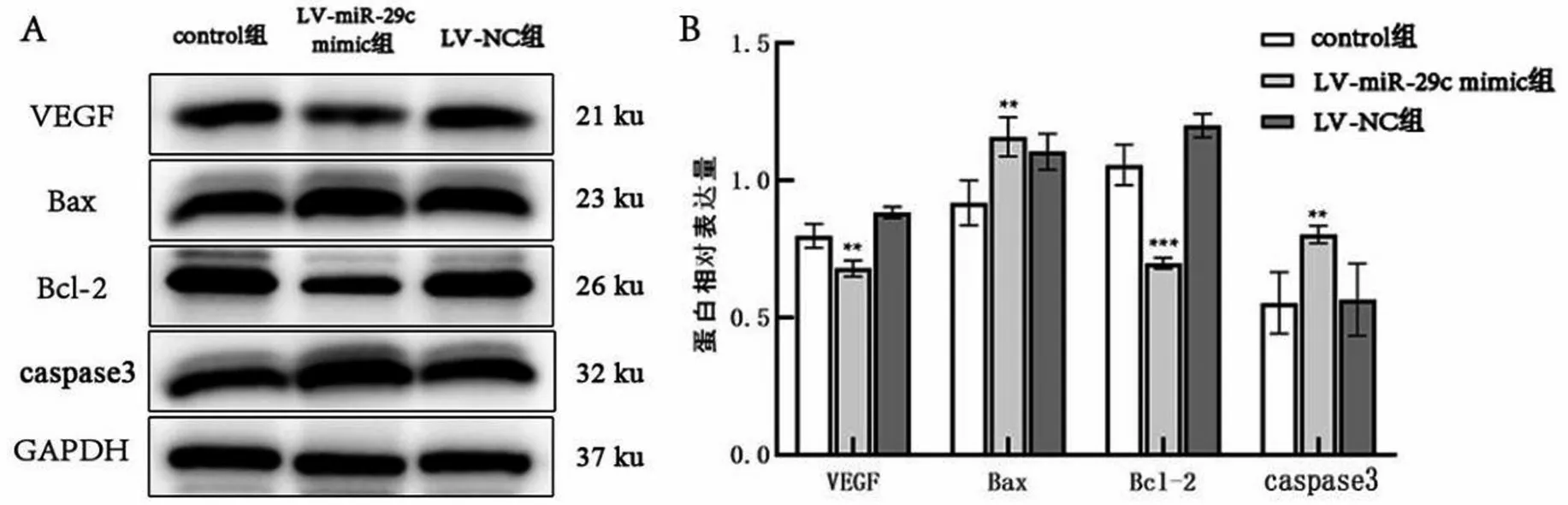
图5 Western blotting检测各组蛋白表达情况
2.6 过表达miRNA-29c 对大鼠H9C2 心肌细胞凋亡的影响
与control 组比较,LV-miR-29c mimic 组细胞凋亡率升高(均P<0.01),LV-NC 组无显著差异(P>0.05),见图6。
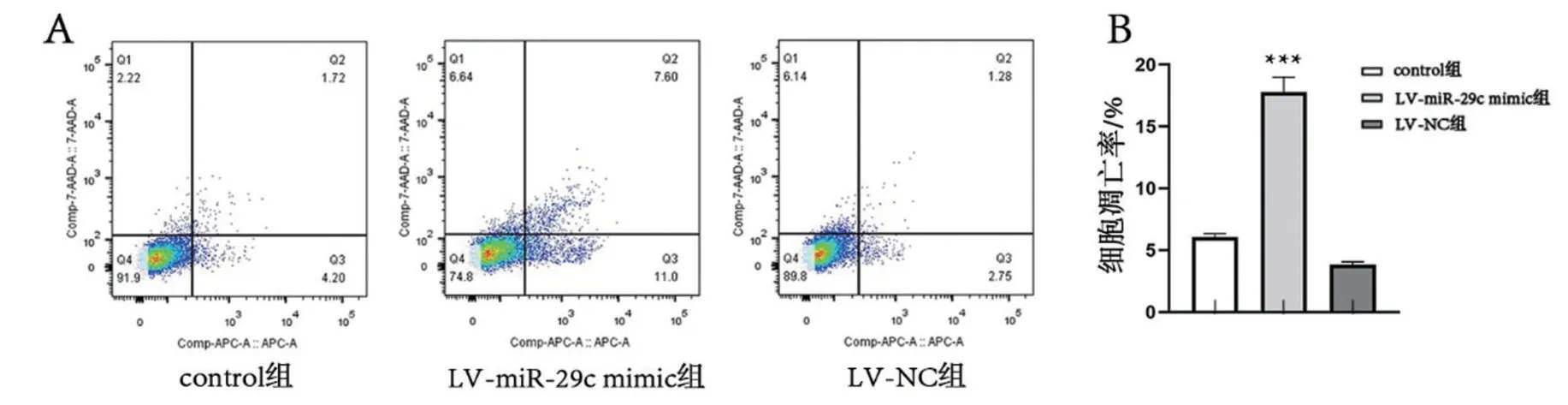
图6 流式细胞术检测各组细胞凋亡情况
3 讨论
MiRNA在真核生物中的存在是广泛的,在细胞生长发育过程中起到非常关键的作用,调节细胞的分化、增殖、自我更新、坏死以及凋亡[3-4]。在心血管疾病的发生发展过程中,miRNA 也发挥调控作用,包括血管生成[5]、心肌细胞凋亡[6]、心肌细胞与血管内皮细胞增殖与损伤[7]等多种生理病理过程。而miRNA-29c 在心脏方面也有一些研究表明,miRNA-29c 在CHD 患者中的表达会显著增加[8],miRNA-29c也是心功能不全发生的独立因素[9]。
本研究结果显示,大鼠H9C2 心肌细胞过表达miRNA-29c 后,细胞增殖速率显著降低,提示miRNA-29c 在大鼠H9C2 心肌细胞中可能具有抑制细胞增殖的作用。而多项研究证明,细胞凋亡是受多种凋亡基因调控的,Bcl 基因家族是调控细胞凋亡的众多基因之一[10],Bcl-2 和Bax 作用相反,Bcl-2 抑制细胞凋亡而Bax 促进细胞凋亡,两者与其他家族成员一起调控细胞凋亡的内在平衡[11]。本研究发现LV-miR-29c mimic 组细胞Bax 蛋白表达升高,Bcl-2蛋白表达降低,细胞凋亡率升高,表明miRNA-29c可能通过调控Bcl-2和Bax促进细胞凋亡。miRNA-29c的变化可能是一些缺血性心肌病细胞修复过程中细胞增殖受抑制而凋亡率升高的原因之一。
在确定miRNA-29c 能够改变细胞的生物学特征后,笔者试图确定这种作用的潜在机制。有研究发现,VEGF是参与血管生成的重要信号蛋白,是发育过程中血管生成和淋巴管生成的关键调节因子[12],也是心肌梗死后的血管生成反应的触发因子[13]。VEGF 能改善血管内皮细胞功能,促进血管再生的功效[14],并改善心肌功能恢复[15]。VEGFA调节肺癌的转移和侵袭的机制可能是通过PI3K/Akt途径参与调节[16]。VEGF-Notch 信号通路对再生障碍性贫血患者骨髓MSC 增殖和凋亡也具有调控作用[17]。VEGF水平的改变也会影响软骨细胞增殖及凋亡的变化[18]。根据本实验结果,过表达miRNA-29c 后,VEGFmRNA 及其蛋白水平显著降低,免疫荧光实验结果也一致,提示miRNA-29c 可能与VEGF 表达水平相关。TargetScan 生物信息学软件预测显示miRNA-29c与VEGF有特异性互补序列,推测VEGF可能是miRNA-29c 的靶基因。Zhan等[19]的研究也发现两者有特异性结合,提示miRNA-29c 可能与VEGF的3’UTR 区域直接结合,进而负性调控VEGF表达水平。这可能是miRNA-29c影响细胞增殖凋亡的途径之一。
综上所述,miRNA-29c 过表达可抑制H9C2 细胞增殖、促进其凋亡,其机制可能涉及miRNA-29c对靶基因VEGF的调控。这为临床诊断心肌相关疾病提供了新的检测思路和实验依据,但由于其中可能涉及多基因多通路的共同调节,miRNA-29c 与VEGF相互作用的具体机制及参与其中的其他信号仍待进一步研究。
