高寒地区自然堆肥过程中可培养细菌的分离和鉴定
2022-06-06黄彩霞王志慧刘炳炎潘宇睦芦光新
黄彩霞,高 卓,李 浩,王志慧,刘炳炎,潘宇睦,芦光新
(青海大学农牧学院,青海 西宁 810016)
近年来,随着我国农业集约化的快速发展,每年产生大量的农业有机废弃物[1],这些废弃物中产量最大的是畜禽粪便及农作物秸秆[2]。高温好氧堆肥是畜禽粪便无害化处理和肥料化利用的重要途径[3],已被广泛应用在固体废弃物的处理中[4-5]。我国油菜种植面积大,秸秆资源丰富,然而很大一部分秸秆未被合理利用[6]。油菜秸秆C/N较高,不适宜单独堆肥,与猪粪混合堆肥,加入调理剂调节为适合堆肥发酵的C/N[7]。C/N对堆肥中微生物的正常活动和有机肥的品质有重要影响,因此,合适的C/N对堆肥发酵过程的进行有重要的意义[8-9]。
堆肥过程的本质是一种由群落结构复杂多样的微生物相互作用而形成的复杂、动态的生化过程,其中微生物对基质的转化和分解发挥着重要作用[10-11]。因此,研究微生物群落组成对了解堆肥过程至关重要。在堆肥过程中,细菌是分解有机物和产热的主要微生物种群,也是整个堆肥过程中最普遍、数量最多的微生物。有研究者认为,堆肥过程中不同阶段细菌的种类和数量相差很大,且不同的细菌主导不同的阶段[2,12]。李昌宁等[13]和王建才等[14]利用高通量测序技术研究了猪粪与秸秆堆肥中细菌群落的变化特征,发现不同温度阶段细菌的相对丰度和优势门、属都不同。张喆[15]从土和牛粪样品中以涂布平板分离法筛选并鉴定出耐冷细菌,能快速启动堆肥升温。可见,用高通量测序技术研究堆肥过程中细菌群落变化特征是较为常见的方法,另外,在堆肥过程可培养细菌的研究中对功能菌筛选鉴定的研究较多,对整个堆肥发酵过程中全部可培养细菌的研究鲜少报道,特别是针对高寒地区自然堆肥发酵过程中全部可培养细菌菌落特征变化的研究甚少。鉴于此,本研究以高寒地区的油菜秸秆与猪粪为主要原料,研究其在自然堆制过程中可培养细菌的数量和种类变化,旨在为当地农作物秸秆的高效利用提供理论依据。
1 材料与方法
1.1 试验材料
油菜秸秆由青海省互助土族自治县昱青投资开发有限公司提供,新鲜猪粪由青海泰和宛生物有限公司提供。
1.2 培养基配制
LB培养基制备:蛋白胨10 g,氯化钠5 g,牛肉膏粉3 g,琼脂15 g,蒸馏水1 000 mL,pH 7.0~7.2,121 ℃、0.1MPa灭菌30 min,备用。
1.3 堆肥方法
堆肥试验在青海大学农林科学实验站进行,采用户外堆制方式,堆体为底部直径1 m、高0.7 m的圆锥形。油菜秸秆切成3~5 cm的碎片,将猪粪与秸秆按3∶1的质量混合,用麸皮调节C/N为25%左右,含水量控制在50%~70%。堆肥前,先在地面上铺一层塑料,将猪粪、秸秆混匀,然后成堆,再用塑料布遮雨,便于翻堆。
1.4 测温方法
堆肥时间为2020年6月1日至7月20日。每天上午9:00、下午16:00用TP300温度计从堆体中上部分(堆体距地面垂直距离60 cm左右处)的不同方向测温5次,取上午和下午温度的平均值作为当日的堆体温度。试验中温度可划分为四个阶段:由堆肥初期的常温上升至50 ℃为升温阶段,温度持续在50~70 ℃为高温阶段,随后从高温逐渐下降至40 ℃为降温阶段,温度继续下降至稳定为腐熟阶段。
1.5 采样时间及方法
自堆肥开始后的第1、4、8、12、17、21、25、29、34、38、42、51天进行取样,方法如下:在离地面40~50 cm处,从3个方向的不同纵切面上进行取样,取样深度为20~30 cm。样品混匀后分成2份:1份用于细菌数量测定(样品暂时保存于4 ℃冰箱,在24 h内进行试验),另1份用于测定其他指标。
1.6 可培养细菌的分离及纯化
采用稀释平板涂布法进行细菌的分离。具体方法为取1 g新鲜样品放入装有99 mL灭菌水的三角瓶(已灭菌)中,封口。在25 ℃、120 r/min条件下振荡30 min,用已灭菌的纱布过滤得到滤液,并依次稀释至10-6,取10-4、10-5、10-6均匀涂布于固体LB培养基上,35 ℃培养24 h。根据菌落形态初步统计固体LB培养基中所有细菌的菌落数,乘以水样的稀释倍数即为细菌总数。采用平板划线分离法在固体LB培养基上将不同的菌落进行纯化,纯化后的细菌接种到斜面固体LB培养基上,35 ℃培养,保存。优势菌按照农泽梅等[16]的方法进行确定。
1.7 可培养细菌分子鉴定
(1)菌株基因组DNA的提取。用接种环蘸取经纯化的菌落放入液体LB培养基中,35 ℃、120 r/min条件下振荡,至培养基由澄清变为浑浊,制备的菌液用于提取细菌的DNA。采用Ezup柱式细菌基因组DNA提取试剂盒(编号:B518255-0050)提取菌株DNA,用16S rDNA的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGACTTAACCCCAATCGC-3′)进行扩增。PCR扩增条件:模板DNA 1 μL,上、下游引物各2 μL(浓度10 μmol/L),2X SanTaq PCR Mix 25 μL,ddH2O 20 μL;反应程序:94 ℃、5 min;94 ℃、1 min,57 ℃、1 min,72 ℃、1.5 min,30 个循环;72 ℃、15 min。扩增产物用1%琼脂糖凝胶进行电泳,将PCR产物送至生工生物工程(上海)股份有限公司测序。
(2)细菌16S rDNA序列分析。将测序所得的序列用Contig Express软件做序列拼接,在NCBI网站上进行比对,下载同源性高的序列及模式菌株的序列,选用MEGA 7.0软件上的Clustal W功能进行序列比对,用邻接法(NJ)构建系统发育树,bootstrap值设为1 000。
1.8 数据分析
采用Excel 2019对数据进行整理,采用SPSS 26进行数据统计分析,试验数据以平均值±标准误差表示,采用单因素ANOVA检验对试验结果进行差异显著性分析。
2 结果与分析
2.1 堆制过程温度的变化
由图1可知,随着堆肥时间的延长,堆体温度整体趋势表现为先升高后不断下降并趋于稳定。1~2 d为升温阶段,该阶段随着堆肥时间延长,温度不断上升,第2天温度升至51.5 ℃。3~27 d为高温阶段,其中3~10 d为55 ℃以上的高温持续期;在发酵第8天温度达到最高,为68.0 ℃;第11天温度降低至55 ℃以下;第16天温度又升高至55 ℃以上,并维持了11 d,但此阶段最高温度(66.4 ℃)低于第8天的温度(68.0 ℃)。28~40 d为降温阶段,温度降低至55 ℃以下,在40~55 ℃维持了12 d。41~47 d为腐熟阶段,温度降低至40 ℃以下,并逐渐稳定。在猪粪与秸秆的自然堆制发酵过程中,堆肥温度达50~55 ℃超过5 d,符合GB 7959—2012《粪便无害化卫生要求》[17]。

图1 堆制过程中温度的变化
2.2 堆制过程可培养细菌物种数和菌落数的变化
由表1可看出,随着堆肥时间的延长,细菌物种数先减少后增加再减少并趋于稳定,细菌菌落数先增加后逐渐减少。升温阶段中,堆肥第1天的样品中细菌物种数11种、菌落数6.30×107CFU/g。高温阶段中,第4天细菌菌落数迅速升高,为23.16×107CFU/g,且显著高于其他时间段(P<0.05),之后堆体中细菌菌落数逐渐减少(第12天除外)。降温阶段和腐熟阶段中,随着堆肥时间的延长,细菌菌落数逐渐趋于稳定,但在第51天细菌菌落数增加,为2.08×107CFU/g。整个堆肥过程中,第1天和第8天细菌物种数最多,第4天细菌菌落数最多。第8天后,随着堆肥时间的延长,物种数逐渐减少并趋于稳定。由此可知,随着堆肥时间及温度的变化,堆体细菌菌落数和物种数逐渐减少。
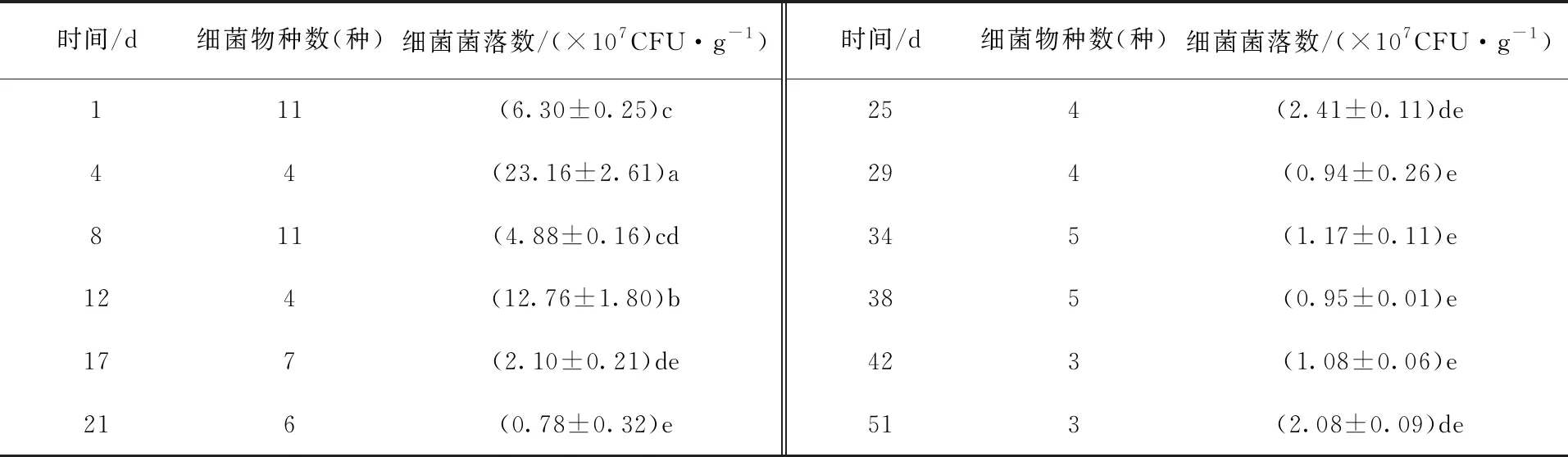
表1 堆制过程中细菌物种数和细菌菌落数
2.3 堆制过程可培养细菌的序列分析
在堆体发酵过程中,共筛出细菌菌株30株,有9株菌株的16S rDNA PCR扩增结果无法用于测序和鉴定微生物所属种类,因此对21株细菌进行了测序。菌株的序列分析结果如表2所示,可以看出除菌株DF200828和DF200104的相似度低于98%外,其余菌株与参比菌株的相似度和完整性高达98%及以上。

表2 菌株BLAST结果
2.4 堆制过程可培养细菌的群落特征分析
在堆体发酵过程中,共筛出细菌菌株30株,分离频率高于20%的菌株如表3所示,可以看出分离频率较高(50%及以上)和相对多度较高(10%以上)的菌株均是Stenotrophomonassp.、Bacillusvelezensis、Salmonellaenterica,其中Bacillusvelezensis的相对多度占42.31%,是所有可培养细菌中的最大优势菌;Stenotrophomonassp.为第二大优势菌,占20.76 %;Salmonellaenterica为第三大优势菌,占13.84%;其余菌株均为非优势菌。

表3 堆肥中细菌的分离频率及相对多度
2.5 堆制过程优势菌菌落形态特征及革兰氏染色鉴定
在油菜秸秆与猪粪自然堆肥发酵过程中,共筛出可培养细菌菌株30株,其中编号为DF200114、DF200102、DF200107的3株菌为可培养细菌中的优势菌。DF200114的菌株菌落细小,呈土黄色,较透明,有光泽,易于培养基脱离,革兰氏染色为阴性的杆状细菌(图2a);DF200102的菌株菌落光滑、细小,稍透明,呈浅黄色,较湿润,易挑起,革兰氏染色为阳性的杆状细菌(图2b);DF200107的菌株菌落边缘稍透明,较湿润,淡黄色,革兰氏染色为阴性的杆状细菌(图2c)。

图2 优势细菌菌株菌落形态特征照片和革兰氏染色镜检结果(×1 000)
2.6 系统发育树的构建及分析
对测序得到的21个菌株进行系统发育树的构建,从图3可以看出,这21个菌株隶属于8个属,分别为Bacillus、Lysinibacillus、Sphingobacterium、Comamonas、Stenotrophomonas、Acinetobacter、Salmonella、Escherichia。本研究中编号为DF200523的菌株与Genbank中编号为Bacillussp.strain 201705CJKOP-15的菌株单独聚为1枝,两者的亲缘关系非常近,支持率达100%,初步鉴定为芽孢杆菌属;DF200827、DF201033、DF201036也鉴定为芽孢杆菌属。其中,DF200114鉴定为贝莱斯芽孢杆菌,DF201035为解淀粉芽孢杆菌,DF200312为枯草芽孢杆菌,DF200418、DF200524为副地衣芽孢杆菌。DF200217鉴定为克氏单胞菌,DF200519为不动杆菌,DF200107为伤寒沙门氏菌。DF200104、DF200105、DF200115鉴定为大肠杆菌属。
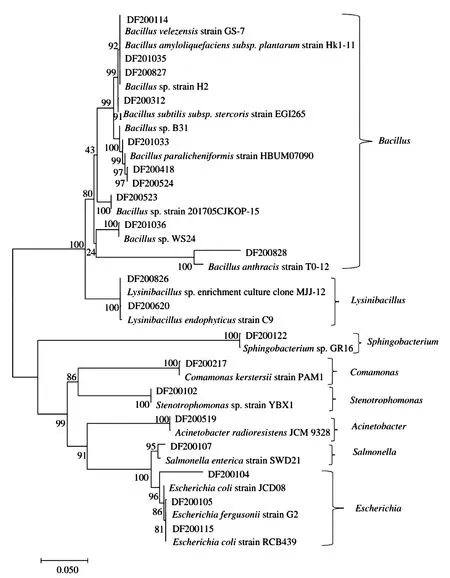
图3 系统发育树
3 讨论与结论
堆肥过程是一个由微生物主导的生物学过程。在堆肥发酵过程中,堆体温度的上升是微生物代谢产热积累的结果,反映了微生物代谢强度和堆肥物质转化速度[18],细菌是整个堆肥过程中最普遍、数量最多的微生物。本研究在高寒地区油菜秸秆与猪粪自然堆肥发酵过程中得出,发酵初期可培养细菌物种数有11种、菌落数为6.30×107CFU/g,之后温度由第2天的51.5 ℃升高到第4天的66.1 ℃,可培养细菌菌落数迅速增加,这与王瑶等[19]研究发现在猪粪堆肥试验中堆体内可培养细菌菌落数随着堆体温度升高而迅速增加的结果一致。升温阶段中嗜温性微生物利用可溶性和易降解性有机物作为营养和能量来源,迅速增殖;高温时,随着堆肥时间延长,温度不断升高,粪便中的大多数病原微生物被杀灭,堆体中可培养细菌菌落数下降明显;第28天后,堆肥进入降温期,温度逐渐降低并趋于稳定,细菌种群结构基本保持稳定,可培养细菌菌落数也逐渐趋于稳定。这与王瑶等[19]在猪粪堆肥研究中发现,可培养细菌菌落数随着堆肥时间延长和温度变化先增加后减少的结果一致;与刘有胜等[20]在城市餐厨垃圾堆肥研究中发现堆肥升温期细菌种群丰富,高温期减少,降温期基本保持稳定的结果一致。在整个自然堆肥发酵过程中,可培养细菌的菌落数与温度有相关性,可培养细菌菌落数随着温度的升高而增加,随着温度的降低而减少,这与敖静等[21]在鸡粪堆肥研究中发现,可培养细菌菌落数的变化趋势与堆体温度变化趋势相近的研究结果一致。由此可见,在高寒地区自然堆肥发酵过程中,可培养细菌菌落数与堆体温度之间的相关关系和其他地区相一致。
本文在油菜秸秆与猪粪自然堆肥过程中得到,芽孢杆菌属的菌株优势度最高,这与李敬波[22]在大连地区牛粪堆肥试验中得出的研究结果相一致。芽孢杆菌能够生成很厚的孢子壁,可以抵抗高温,极易成为中高温阶段的优势菌。本研究中芽孢杆菌属的贝莱斯芽孢杆菌的优势度最高,达到了42.31%。李玥等[23]从鸡粪堆肥中筛选出了贝莱斯芽孢杆菌,李晓宇等[24]在大连地区从牛粪、玉米秸秆和牛屠宰废弃物的堆肥中也筛选出此菌,本研究也表明贝莱斯芽孢杆菌容易从高寒地区堆肥中分离得到。此外,寡养单胞菌属优势度也较高,相对多度达到了20.76%,目前,此菌从植物根际、污水、污泥等环境中分离出得较多,从猪粪堆肥中筛选出的还未见报道。
综上可知,在高寒地区油菜秸秆与猪粪自然堆肥过程中,随着温度的升高,可培养细菌菌落数增加;在降温阶段,可培养细菌菌落数减少,物种数也减少并趋于稳定。同时,共分离筛选出可培养细菌菌株30株,对21株菌株进行鉴定,系统发育树结果显示此21株菌株隶属于8个属,其中菌株Bacillusvelezensis、Stenotrophomonassp.、Salmonellaenterica为堆肥发酵过程中的优势菌。
