藜麦穗腐病病原鉴定及其生物学特性
2022-06-06尉天春姜晓东赵晓军张春来李新凤
尉天春, 薛 婧, 姜晓东, 赵晓军, 张春来, 冯 铸, 李新凤
(1.山西农业大学植物保护学院,山西 太谷 030801;2.山西农业大学农学院,山西 太谷 030801;3.山西省农业种子总站,山西 太原 030006)
藜麦(ChenopodiumquinoaWilld.)是能够满足人类营养需求的单体植物,含有丰富的蛋白质以及多种维生素、矿物质和生物活性物质[1-3],且具有很强的抗逆性[4-6].藜麦自20世纪80年代引进我国以后,种植面积不断增大,但由于耕作管理粗放、连作及缺乏地方生态适应性品种等问题,病害频发,直接影响了藜麦的产量和品质,严重威胁和阻碍了藜麦产业的发展,已成为目前藜麦生产上亟待解决的一个问题[7].我国已报道的藜麦病害有霜霉病[8]、叶斑病[9-12]、茎枯病等[13-14].笔者于2019—2020年调查山西省藜麦病害的过程中,发现一种由枝孢属(Cladosporium)引起的穗腐病,该病害在山西省各藜麦大田种植基地的发生率为5%~30%,在温室内的发病率达到了30%~50%.目前,国内外尚未见有关枝孢属引起的藜麦穗腐病的报道.本研究对该穗腐病的病原菌进行鉴定,并测定碳源、氮源、温度和pH值对该病菌生长的影响,旨在为进一步研究藜麦穗腐病的发生机制及制定综合防治措施提供理论基础.
1 材料与方法
1.1 材料
1.1.1 供试菌株 从具有典型藜麦穗腐病症状的病穗上分离、纯化后获得的随机代表性菌株LMSF-1.
1.1.2 供试植株 灰藜2号健康植株,是由原平市稼祺藜麦种植基地提供的盆栽品种.
1.1.3 供试培养基 马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA):去皮马铃薯200 g,葡萄糖20 g,琼脂15 g,水1 000 mL.查氏培养基:NaNO32 g,KH2PO41 g,KCl 1 g,MgSO41 g,FeSO40.02 g,蔗糖30 g,琼脂粉15 g,水1 000 mL[15].
1.2 方法
1.2.1 病害调查与病原菌的分离、纯化 分别于2019年8和12月在山西省忻州市宁武县藜麦大田种植基地和原平市藜麦大棚种植基地调查藜麦穗腐病,观察、记录其症状特点.选取青白藜、青黑藜和青红藜3个品种的地块,在每个地块采用五点取样法,每点随机取20株,计算发病率,并采集具有典型藜麦穗腐病症状的病穗,带回实验室用于病原菌的分离.在超净工作台上,用无菌接菌针自病穗上直接挑取少量孢子,置于备好的无菌水中,制成孢子悬浮液,浓度以在40倍光学显微镜(OLYMPUS BX51)下每个视野可观察到0~3个孢子为宜,用稀释涂布平板法获得纯化后的单孢菌株[15],然后将其编号并保存在PDA斜面上,置于4 ℃冰箱中待用.
1.2.2 室内离体致病性测定 在藜麦(灰藜2号)灌浆期,取健康生长的麦穗,于无菌条件下,用体积分数为75%的酒精进行表面消毒1 min后,无菌水冲洗干净,再用无菌滤纸吸干表面水分,置于预先备好的铺有双层无菌滤纸的大培养皿中.随机选取纯化后的单孢菌株LMSF-1,经活化[16]后,挑取少量菌体接种在麦穗上,置于25 ℃光照培养箱中进行保湿培养,逐日观察发病情况.试验重复3次,每次重复接种3株麦穗,以不接种菌体的健康麦穗为对照.待发病后,再次分离、纯化病原菌,并判断其种类是否与原接种菌株一致.
1.2.3 藜麦穗腐病病原菌鉴定 (1)形态学鉴定:将活化的单孢菌株接种在PDA培养基上,25 ℃恒温培养5 d,观察菌落的形态、颜色、质地等性状.用插片培养法[17]获得菌株的临时玻片:用接菌针挑取少量菌体接种在PDA平板上,在距离接种点0.5 cm处斜插一无菌盖玻片,然后将平板置于25 ℃恒温培养箱中,培养4 d后,取出长有供试菌株的盖玻片,将其制成临时玻片,置于显微镜(OLYMPUS BX51)下观察并记录其菌丝形态、产孢结构、孢子形成方式等特点.参考文献[18-20],确定藜麦穗腐病病原菌的形态学分类地位.
(2)分子生物学鉴定:将病原菌在PDA培养基中培养5 d后,刮取菌丝,利用CTAB法[21]提取基因组DNA.参考Braun et al[22]的方法,分别用rDNA内转录间隔区(internal transcribed spacer, ITS)序列通用引物ITS1和ITS4、翻译延长因子编码基因(translation elongation factor 1-α, TEF1-α)引物对TEF1-728F和TEF1-986R,以及微丝肌动蛋白编码基因(actin gene, ACT)引物对ACT-512F和ACT-783R,进行PCR扩增.引物序列见表1,由上海生工生物工程有限公司合成.PCR反应体系25 μL:DNA模板1 μL,上、下游引物各0.5 μL,2×MasterMix 12.5 μL,无菌水10.5 μL[16].PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,退火30 s(退火温度:ITS 58 ℃,TEF1-α 55 ℃,ACT 61 ℃),72 ℃延伸30 s,循环35次;72 ℃延伸10 min.产物经1.5%(质量分数)琼脂糖凝胶电泳检测后,送至上海生工生物工程有限公司测序.

表1 供试引物序列Table 1 Primer sequences used in the study
使用DNAStarⅡ软件对测序结果进行拼接校对后,提交到GenBank数据库(https://www.ncbi.nlm.nih.gov/).经Blastn比对后,下载同源性高的22个枝孢属菌株的基因序列,进行系统发育分析.用ClustalX 2.1软件对各菌株相应的基因序列进行多重序列比对后,在GeneDoc-[Gene1]中选择序列保守区,利用Sequence Matrix软件合并各菌株相应的ACT、TEF1-α及rDNA-ITS基因序列,用JModeltest-2.1.6软件选择最优化的核苷酸替换模型并计算相关参数,最后用Mrbayes 3.2.7软件构建ACT-TEF1-α-ITS联合基因的贝叶斯树.以Alternariaalternata的ACT-TEF-ITS联合基因为外群(outgroup),建立4个马尔可夫链,以随机树为起始树,共运行5 000 000代,每100代抽样1次.舍弃25%老化样本后,根据剩余的样本构建一致树,并计算后验概率(posterior probability).
1.2.4 病原菌生物学特性测定 (1)碳源对藜麦穗腐病菌生长的影响:以PDA培养基为基础培养基,分别用等量的蔗糖、乳糖、淀粉、麦芽糖、甘露醇5种碳源代替葡萄糖.用无菌接菌针在培养3 d的病原菌菌落边缘挑取少量菌体,分别接种于6种碳源培养基平板上,于25 ℃恒温培养箱中培养7 d后,测量并记录菌落直径大小.每个处理重复3次.
(2)氮源对藜麦穗腐病菌生长的影响:以查氏培养基为基础培养基,分别用等量的牛肉膏、蛋白胨、酵母膏、尿素、草酸铵5种氮源代替NaNO3.接种培养及测量方法同(1).
(3)温度对藜麦穗腐病菌生长的影响:用无菌接菌针在培养3 d的病原菌菌落边缘挑取少量菌体,接种于PDA培养基平板上,分别于10、15、20、25、30 ℃恒温培养箱中培养,培养3、5、7 d后测量并记录菌落直径大小,计算生长速率.每个处理重复3次.
(4)pH值对藜麦穗腐病菌生长的影响:用1 mol·L-1HCl和1 mol·L-1NaOH溶液分别将PDA培养基的pH值调节至4、5、6、7、8、9、10、11.接种培养(培养温度25 ℃)及测量方法同(3).
2 结果与分析
2.1 病害调查与病原菌分离、纯化结果
调查发现,青白藜、青黑藜和青红藜3个品种在宁武县种植基地的发病率(21.82%~26.11%)均低于在原平市大棚种植基地的发病率(36.00%~40.64%)(表2).该病害的田间症状:先在穗部个别颖壳上出现橄榄绿色点状霉层,之后颜色逐渐加深,变为褐色到黑褐色;随着病情发展,受害颖壳逐渐增多,受害面积逐渐加大,严重时蔓延至全穗,造成麦穗枯死及籽粒干瘪、霉烂;湿度大时,病原菌还会侵染紧临穗部的幼嫩茎秆,病部产生明显的黑绿色至黑褐色霉层(图1).

表2 山西省宁武县、原平市藜麦种植基地穗腐病发病率Table 2 Incidence rate of ear rot on C.quinoa planting bases in Ningwu County and Yuanping City, Shanxi Province

A.初期症状;B.后期症状;C.罹病茎秆症状.图1 藜麦穗腐病田间症状Fig.1 Symptoms of ear rot in C.quinoa field
从两个藜麦种植基地的病样上共分离、纯化得到11个单孢菌株,通过观察其培养性状和显微形态特征发现,各菌株形态特点一致,初步判断为同一种真菌.
2.2 室内离体致病性
随着时间的推移,藜麦穗部接种点处橄榄绿色点状霉层逐渐扩大,到第5天时,接种点周围受害小穗已扩展成片,而空白对照无发病症状(图2).从发病藜麦穗部挑取少量菌体,单孢纯化后,经形态学与分子生物学方法鉴定表明,其与原接种菌株相同.根据柯赫氏法则判定,接种菌株LMSF-1为藜麦穗腐病的致病菌.

A.接种5 d后的症状表现;B.空白对照.图2 分离菌LMSF-1对藜麦穗的致病性Fig.2 Pathogenicity of isolated strain LMSF-1 to quinoa panicle in vitro
2.3 藜麦穗腐病病原菌的鉴定
2.3.1 形态学鉴定结果 菌落呈圆形平铺于PDA培养基上,正面粉末状,橄榄绿色,中心有褶皱凹陷(图3A);菌落背面暗绿色,培养基有裂纹(图3B).菌丝有隔,浅褐色(图3C);分生孢子梗多侧生于菌丝,直立,单生,大小为(51.50~127.63) μm×(2.91~5.35) μm(图3D);枝孢有0~1个隔膜,多为2~3个孢痕,大小为(6.51~15.73) μm×(2.40~4.47) μm(图3E、3F);分生孢子为单胞,无色透明,呈椭圆状或棒状,两端钝圆,大小为(2.76~5.42) μm×(1.78~3.88) μm(图3G、3H).经与文献[18-20]比对,初步将该病原菌鉴定为枝状枝孢(Cladosporiumcladosporioides).
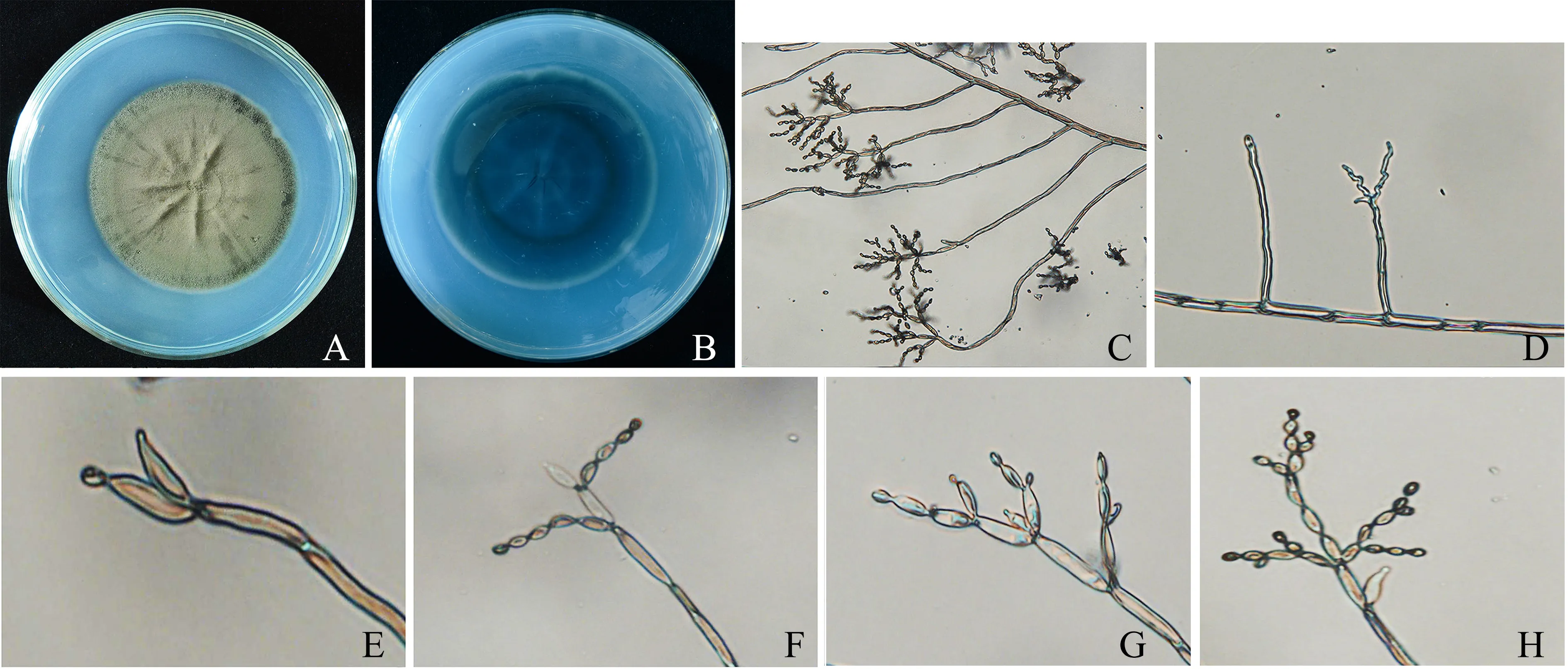
A.菌落正面;B.菌落背面;C.菌丝与分生孢子梗(20×);D、E、F.分生孢子梗与枝孢(40×);G、H.分生孢子及分生孢子链(40×).图3 菌株LMSF-1的形态特征Fig.3 Morphological characteristics of strain LMSF-1
2.3.2 分子生物学鉴定结果 菌株LMSF-1经ACT、TEF1-α和rDNA-ITS基因序列引物扩增后,分别得到长度为285、313和554 bp的基因片段(GenBank登录号为MW 560123、MW 560124和MZ 674407),电泳检测结果均为清晰的单一条带(图4).Blastn比对结果显示,菌株LMSF-1的ACT、TEF1-α及rDNA-ITS基因序列与C.cladosporioides(菌株CPC 11120的3个基因登录号分别为HM 148504、HM 148258、HM 148017;菌株CPC 12214的3个基因登录号分别为HM 148515、HM 148269、HM 148028;菌株CPC 14018的3个基因登录号分别为HM 148527、HM 148281、HM 148040)的一致度达到99.13%~100%.根据JModeltest软件的赤池信息准则(Akaike Information Criteria, AIC)标准,建树序列最适合的核苷酸替换模型为TIM2+G,位点间变异速率rates=invgamma.该模型构建的多基因联合序列贝叶斯系统发育树(图5)显示,同种枝孢菌以较高的后验概率(>0.98)优先相聚成簇,共形成8个大簇,且每种聚为一簇,分别为C.pseudocladosporioides、C.cladosporioidess.lat.Lineage 1、C.cladosporioides、C.globisporum、C.cladosporioidess.lat.Lineage 2、C.delicatulume、C.cladosporioidess.lat.Lineage 4和C.cladosporioidess.lat.Lineage 3.菌株LMSF-1先与菌株AcMt6相聚后(后验概率0.82),再与菌株CPC 11120、CPC 12214及CPC 14018聚为一簇(后验概率为1),均为C.cladosporioides.

M.DNA marker;1.rDNA-ITS序列;2.TEF1-α序列;3.ACT序列.图4 菌株LMSF-1的PCR扩增图Fig.4 PCR amplification products of strain LMSF-1
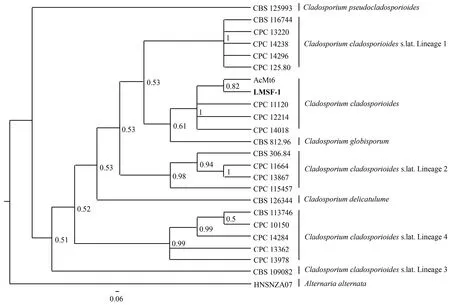
分支节点上的数值为后验概率.图5 菌株LMSF-1及其近缘种的TEF1-α、ACT、rDNA-ITS联合基因系统发育树Fig.5 Phylogenetic tree of strain LMSF-1 and its related strains based on combined sequences of ACT, TEF1-α and rDNA-ITS
综合形态学与分子生物学的鉴定结果,确定山西省藜麦穗腐病的病原菌为枝状枝孢.
2.4 藜麦穗腐病病原菌的生物学特性
2.4.1 碳源对藜麦穗腐病菌生长的影响 由图6A可知:供试菌株在PDA培养基上生长最快,培养7 d后菌落直径为3.58 cm,与其他碳源培养基差异显著(P<0.05);在甘露醇、蔗糖、麦芽糖培养基上的菌落直径次之,分别为3.03、2.82和2.67 cm;在乳糖和淀粉培养基上生长相对较慢,且二者差异不显著(P>0.05),培养7 d后菌落直径分别为2.43和2.42 cm.
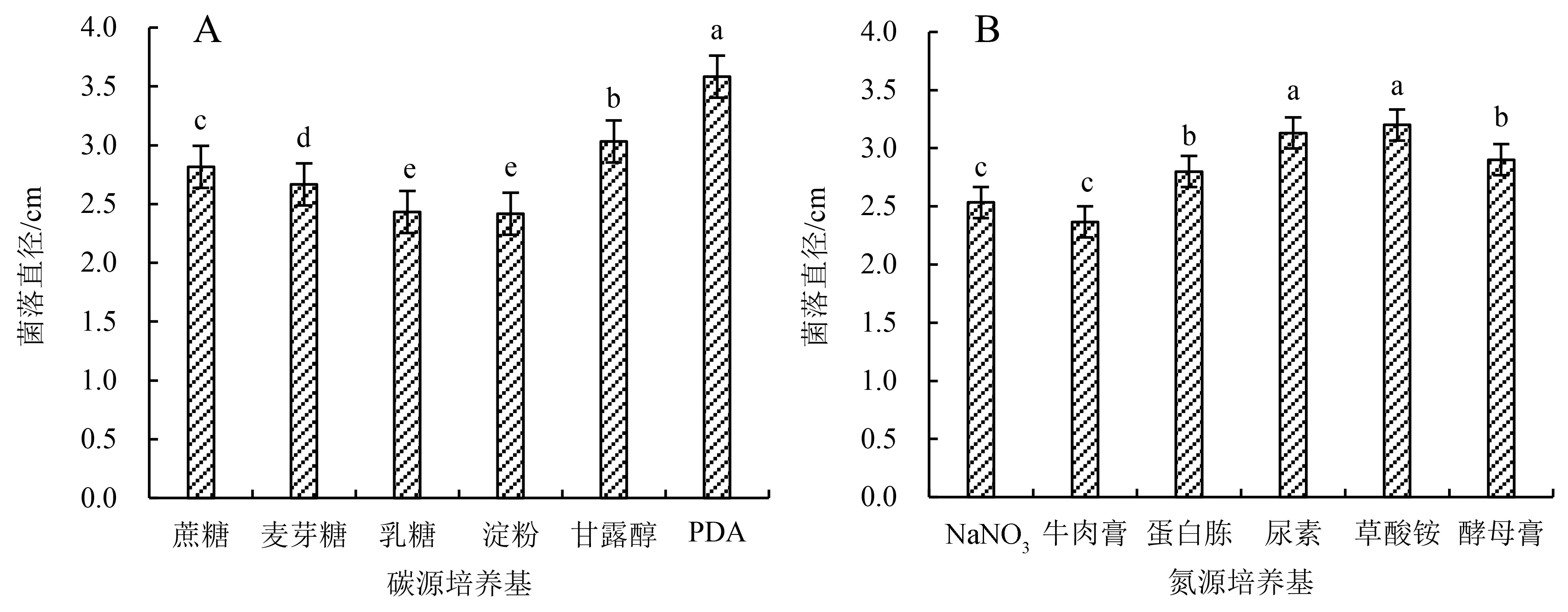
柱上不同小写字母表示在0.05水平上差异显著,相同字母表示差异不显著.图6 菌株LMSF-1在不同碳源、氮源培养基上培养7 d的菌落直径Fig.6 Colony diameter of strain LMSF-1 cultured on medium made with different carbon and nitrogen sources for 7 d
2.4.2 氮源对藜麦穗腐病菌生长的影响 由图6B可知:供试菌株在草酸铵和尿素培养基上生长相对较快,培养7 d后菌落直径分别为3.20和3.13 cm,与其他培养基差异显著(P<0.05);在酵母膏和蛋白胨培养基上的菌落直径次之,分别为2.90和2.80 cm;在NaNO3和牛肉膏培养基上生长较慢,培养7 d后菌落直径分别为2.53和2.37 cm.
2.4.3 温度对藜麦穗腐病菌生长的影响 由图7A可知,供试菌株在10~30 ℃之间生长速率随着温度的升高呈先升高后下降的趋势.温度为25 ℃时,生长速率达到最大.同时,菌株在不同时间的生长速率存在差异,培养第5天时生长最快.

图7 温度、pH值对菌株LMSF-1生长的影响Fig.7 Effects of temperature and pH on the growth of strain LMSF-1
2.4.4 pH值对藜麦穗腐病菌生长的影响 由图7B可知,供试菌株在pH值4~11均可生长,随着pH值增大,生长速率呈先升高后下降的趋势.pH值为7时,生长速率达到最大.同时,菌株在不同时间的生长速率存在差异,培养第5天时生长最快.
3 讨论
本研究以与供试菌株同源性高的的近缘种基因序列[包括C.delicatulume、C.pseudocladosporioides、C.globisporum、C.cladosporioides(Lineage1、Lineage2、Lineage3、Lineage4)]为参考序列[20,23]进行了TEF1-α、ACT及rDNA-ITS基因序列分析,并结合形态特征观察,明确了山西藜麦穗腐病病原菌为Cladosporium中的枝状枝孢.
枝状枝孢(C.cladosporioides)属于兼性寄生菌,在全球广泛分布[20,23-24].该菌可以存活于腐败的植物材料中或以继发感染的方式存活于活体植物上;土壤、空气、食物或其他材料中也可分离到该菌[20,22,25].Kalaria et al[26]发现,C.cladosporioides可引起印度南古吉拉特地区高粱穗霉病;Yerevna et al[25]报道,C.cladosporioides能侵染番茄叶片造成叶斑病;焦瑞莲等[24]发现,C.cladosporioides、C.velox和C.limoniforme能侵染新疆棉花导致僵铃与裂铃,其中,C.cladosporioides为优势菌.目前尚未见有关该菌种引起藜麦病害的报道.本研究首次发现,在藜麦灌浆期后,C.cladosporioides可侵染藜麦穗引起穗腐病.
调查表明,相同藜麦品种在温室的发病率明显高于大田,且温室内植株病部病菌体更加浓密.在大田内,种植密度大、氮肥重的地块发病较为严重,植株生长郁闭的田块中央发病率又重于地边.田间湿度大时,在病部会产生肉眼可见的菌块;在温室内甚至可以在幼嫩茎秆上形成成堆的分生孢子及菌丝体.可见,湿度对该病害的发生程度有重要影响.因此,在生产中要注重合理布局品种、科学规划种植模式、加强水肥管理等,同时做好田间病害预测预防工作,科学防控,以避免和减少该病害的危害.此外,本研究表明:枝状枝孢在以葡萄糖为碳源和草酸铵为氮源的培养基上生长相对较快,最适生长温度为25 ℃,最适生长pH值为7.由枝状枝孢引起的藜麦穗腐病发生在藜麦灌浆期后,此时种植基地日温在26 ℃以下,与本试验所测得的菌株生长适宜温度基本相符.有关该菌发生的碳源、氮源及pH值条件是否与种植基地病害实际发生情况一致还有待进一步研究.
