1型糖尿病食蟹猴左心室心肌组织超微结构变化
2022-06-06滕夏虹邹春林杜可晨曹津津
滕夏虹,陈 帅,邹春林,杜可晨,曹津津,宋 琼
糖尿病性心肌病(diabetic cardiomyopathy,DCM)是一种独立的、特异的心肌疾病,也是糖尿病致死的主要原因之一。青少年糖尿病患者发生心血管并发症如急性心肌梗死的平均年龄在14.6岁[1]。有研究[2]表明,1型糖尿病(type 1 diabetes mellitus,T1DM)青少年患者更容易出现严重的心肌损伤,并且男性心肌顺应性低于女性。目前关于T1DM引起心肌组织超微结构改变的研究较少。由于非人灵长类动物在解剖结构、遗传、生理和病理等方面与人类近似,能较好地模拟人类疾病发生发展的过程。该研究拟通过建立T1DM食蟹猴模型,初步探索长期高血糖条件下心肌组织超微结构的变化。
1 材料与方法
1.1 材料
1.1.1实验动物及分组 选用6只3岁雄性食蟹猴(广西玮美生物科技有限责任公司提供[编号:SCXK桂2007-0002]),并饲养于广西南宁灵康赛诺科生物科技有限公司的灵长类实验室[编号:SYXK桂2004-0003],随机分为2组:①模型组(T1DM组):通过静脉注射链脲佐菌素(streptozotocin,STZ)诱导构建T1DM食蟹猴模型,其编号分别是M1、M2、M3;②对照组:正常食蟹猴, 其编号分别是C1、C2、C3。在实验操作中按3R原则给予实验动物人道主义关怀,严格按照国际实验动物评估和认可管理委员会规定和要求对实验动物进行日常的饲养和管理,实验中所有涉及动物的实验方案均得到了广西南宁灵康赛诺科生物科技有限公司实验动物关怀与使用伦理委员会的批准(编号:W00013)。
1.1.2仪器与试剂 乐康全2型血糖仪和优越血糖试纸购自罗氏诊断产品上海有限公司;胰岛素笔式数显注射笔(诺和笔)购自诺和诺德(天津)生物技术有限公司;精蛋白生物合成人胰岛素注射液(诺和灵50R胰岛素笔芯)购自诺和诺德(中国)制药有限公司;H-7650型透射电子显微镜购自日本日立公司;UC7型超薄切片机购自德国徕卡公司。STZ购自Sigma-Aldrich上海贸易有限公司;柠檬酸和柠檬酸钠购自北京益利精细化学品有限公司;0.9%氯化钠注射液购自购自安徽丰原药业股份有限公司;硫酸阿托品注射液购自上海禾丰制药有限公司;盐酸氯胺酮注射液购自江苏恒瑞医药股份有限公司。
1.2 方法
1.2.1T1DM食蟹猴模型的诱导 模型组3只雄性食蟹猴禁食12~15 h后,予以10 mg/kg氯胺酮和0.04 mg/kg阿托品麻醉后,静脉注射STZ 68 mg/kg (用0.1 mmol/L、pH 4.5柠檬酸缓冲液和0.9%氯化钠注射液配成5 mg/ml浓度);对照组静脉注射等体积的溶剂混合液。静脉注射STZ后第1周每天监测空腹和非空腹血糖,自第2周开始每周2次监测空腹和非空腹血糖,当模型组动物血糖升高至11.1 mmol/L以上,需使用皮下注射胰岛素维持代谢稳定及长期存活。
1.2.2T1DM食蟹猴模型皮下注射胰岛素的原则 T1DM模型组动物在每天早上喂食前测量空腹血糖。当血糖小于11.1 mmol/L范围内时,无需进行胰岛素皮下注射;当血糖在11.1~16.6 mmol/L范围内时,需要皮下注射1~2 U胰岛素;当血糖在16.6~22.2 mmol/L范围内时,需要皮下注射2~4 U胰岛素;当血糖大于22.2 mmol/L,需要皮下注射4~6 U胰岛素。注射胰岛素后随时观察动物活动行为和监测血糖,防止因胰岛素过量而导致低血糖性休克,并控制血糖在11.1 mmol/L以上。
1.3 组织制备和检测指标
1.3.1电镜标本制备和观察 T1DM食蟹猴模型造模成功4年后,对T1DM模型组和对照组实验动物进行安乐死,迅速取材,取左心室前壁心肌组织并切成体积大约为1 mm×1 mm×1 mm的组织块,用3%戊二醛4 ℃固定过夜,1%锇酸室温固定1 h,逐级乙醇-丙酮脱水,用Epon 812环氧树脂包埋、聚合,利用徕卡UC7超薄切片机切成70 nm超薄切片,经2%醋酸双氧铀染色和6%柠檬酸铅染色双重染色后,于日立H-7650透射电子显微镜(电压80 kV,放大倍率在5 000~70 000倍之间)观察,在透射电子显微镜下,观测左心室心肌组织超微结构,选择反差效果好、无污染及损坏的部位,随机选取视野进行拍照采集图片。
1.3.2左心室心肌细胞线粒体和心肌微血管内皮细胞体视学分析 采用Image-Pro Plus 6.0软件(美国Media Cybernetics公司),测定左心室心肌细胞线粒体数目、周长和面积,测定左心室心肌微血管内皮细胞中吞饮小泡的数目、内皮细胞基膜厚度。根据Delesse原理,二维图像上两种结构截面的比等于它们在空间结构的体积比,从而计算出线粒体的体积密度、表面积密度、表面积体积比、相对数量和相对电子密度。体积密度:反映细胞质内线粒体在单位体积细胞质的相对体积;表面积密度:反映单位体积细胞质中的线粒体膜表面积;表面积体积比:线粒体表面积与线粒体体积的比值,反映线粒体形态。相对数量:单位体积细胞质中线粒体或单位内皮细胞胞质内吞饮小泡的数量。相对电子密度:单位线粒体面积内相对电子密度。
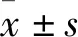
2 结果
2.1 构建T1DM食蟹猴模型T1DM模型组编号M1~M3食蟹猴空腹血糖变化如图1所示,注射STZ后10 d开始T1DM模型组食蟹猴的空腹血糖大于11.1 mmol/L,提示T1DM 食蟹猴模型构建成功。
图1 T1DM食蟹猴模型组空腹血糖A:注射STZ前;B:注射STZ后10 d;C:注射STZ后1年;D:注射STZ后2年;E:注射STZ后3年;F:注射STZ后4年
2.2 对照组左心室心肌细胞的超微结构心肌细胞排列整齐,胞质充满大量平行排列的肌原纤维,I带、A带、H带与Z线、M线均形成明暗相间的肌节结构(图2A、B);相邻细胞间闰盘呈阶梯状,结构完整、清晰、连续(图2C);胞质较丰富,内含各种细胞器,内质网结构正常,可见丰富的线粒体和糖原,可见少量脂滴;心肌细胞内线粒体丰富,体积较大为椭圆形或长杆状,呈线性网状排列在肌原纤维之间,线粒体核膜完整,线粒体嵴结构清晰,基质密度及结构正常,线粒体周围有糖原分布(图2A、D);心肌细胞核和核仁显示良好,细胞核内物质分布较均匀,未见核裂解及固缩现象(图2E);心肌细胞肌原纤维横断面、粗细肌丝呈六角点阵排列(图2F)。微血管内皮细胞呈扁平状,细胞核完整,细胞器较少。
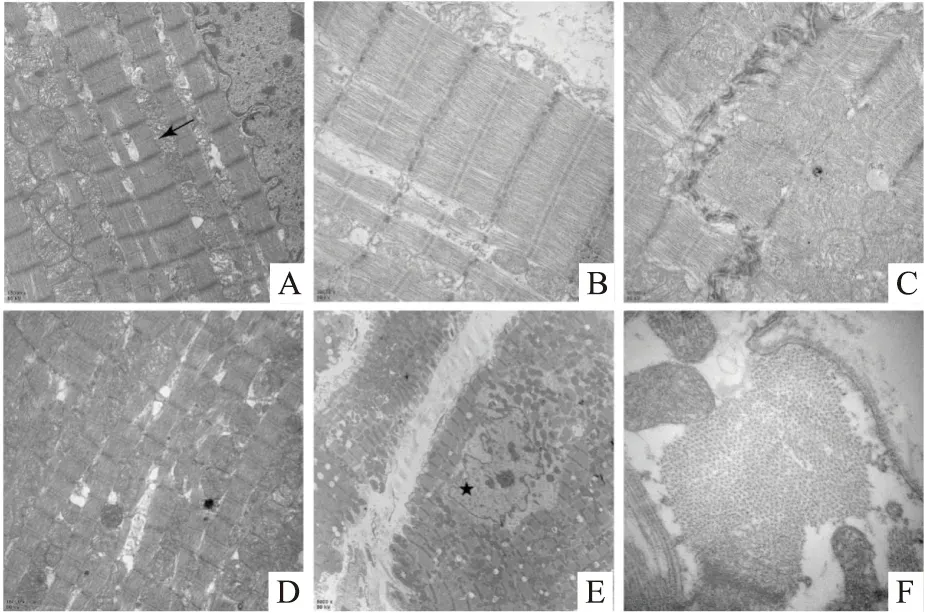
图2 正常对照组食蟹猴左心室心肌超微结构A:胞质内肌原纤维 ×15 000;箭头所示为平行排列的肌原纤维;B:明暗相间的肌节结构 ×30 000;C:闰盘连续,结构完整 ×30 000;D:线粒体丰富,线粒体嵴结构清晰 ×15 000;E:心肌细胞核及核仁显示良好 ×5 000;星形所示为心肌细胞细胞核;F:粗细肌丝呈六角点阵排列 ×70 000
2.3 T1DM模型组左心室心肌细胞的超微结构心肌细胞肌丝束断裂凝聚,肌原纤维排列紊乱,局部溶解断裂、分离,Z线、M线模糊断续,肌节结构模糊,肌浆网扩张(图3A、B);闰盘不连续、扭曲、模糊,闰盘处细胞连接不完整,闰盘间隙增宽,中间连接增宽,闰盘处的肌原纤维溶解断裂(图3C);胞质内含细胞器较少,内质网、高尔基体肿胀变形,脂滴数量增多(图3E、I);肌原纤维排列紊乱,呈短片状,胞质疏松、水肿、T管扩张,细胞间质胶原纤维增多(图3F、G);肌原纤维间线粒体分布不均匀,可见局部堆积大量大小不等、形态各异的线粒体,线粒体嵴变形、扭曲,局部线粒体基质溶解消失,形成空泡区,细胞膜下线粒体部分呈髓鞘样变(图3A、B、D、E);心肌细胞核核膜皱缩变形,细胞核边位,染色体固缩,呈多块聚边,核膜表面凹凸不平(图3G);心肌细胞横断面粗、细肌丝比例及分布异常(图3H)。
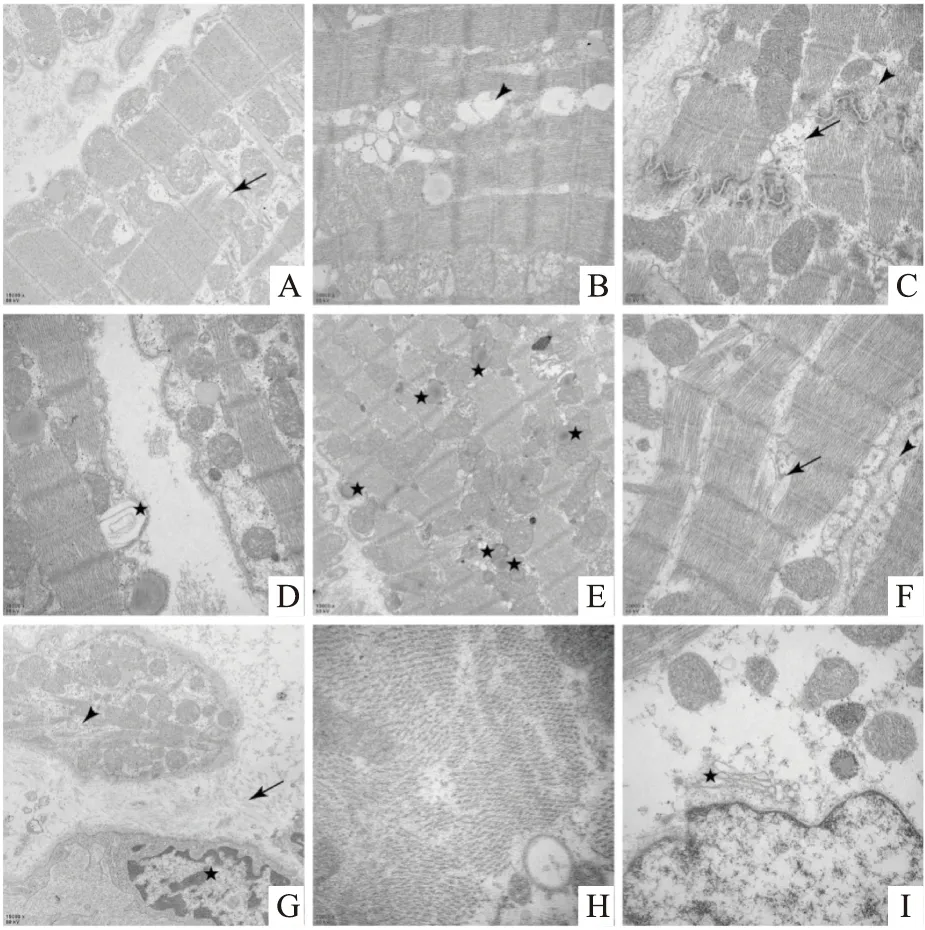
图3 1型糖尿病模型组食蟹猴左心室心肌超微结构A:肌原纤维局部溶解断裂 ×15 000;箭:断裂的肌原纤维;B:Z线、M线模糊断续,局部线粒体溶解消失 ×30 000;箭头:溶解的线粒体;C:闰盘断裂、间隙增宽,闰盘处肌原纤维溶解断裂 ×30 000;箭:闰盘断裂处;箭头:断裂的肌原纤维;D: 线粒体部分呈髓鞘样变 ×30 000;星:髓鞘样变的线粒体;E:脂滴数量增多 ×15 000;星:脂滴;F:肌原纤维局部溶解断裂,T管扩张 ×30 000;箭:断裂的肌原纤维;箭头:扩张的T管;G:心肌细胞核核膜皱缩变形,肌原纤维排列紊乱,胶原纤维增多 ×30 000;星:细胞核;箭头:肌原纤维;箭:胶原纤维;H: 粗、细肌丝比例及分布异常 ×70 000;I:内质网肿胀变形 ×40 000;星:内质网
2.4 T1DM模型组与对照组左心室心肌细胞线粒体体视学比较通过观察心肌细胞线粒体超微结构并进行体视学定量分析,结果显示,与对照组相比,T1DM模型组左心室心肌细胞细胞质内线粒体数量减少(t=3.76,P<0.01),见图4A;单位线粒体面积内相对电子密度下降(t=5.61,P<0.000 1),见图4B;线粒体体积密度下降(t=4.53,P<0.001),见图4C;线粒体表面积密度下降(t=2.24,P<0.05),见图4D;线粒体表面积体积比、线粒体平均面积差异无统计学意义(图4E、F)。
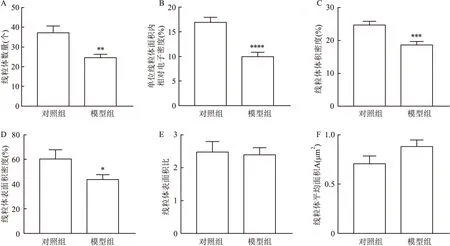
图4 食蟹猴左心室心肌细胞线粒体体视学观察A:细胞质内线粒体数量;B:单位线粒体面积内相对电子密度;C:线粒体体积密度;D:线粒体表面积密度;E: 线粒体表面积体积比;F:线粒体平均面积;与对照组比较:*P<0.05,**P<0.01,***P<0.001,****P<0.000 1
2.5 T1DM模型组与对照组左心室心肌微血管内皮细胞超微结构体视学比较为了解心肌微循环状态对心肌细胞的氧、营养和代谢产物的交换及能量和信息传输等方面影响,通过观察心肌微血管内皮细胞的超微结构并进行定量分析,与对照组相比,T1DM模型组单位内皮细胞胞质内吞饮小泡数量减少(t=11.47,P<0.000 1),见图5B、C;基底膜厚度增加(t=23.06,P<0.000 1),见图5D。
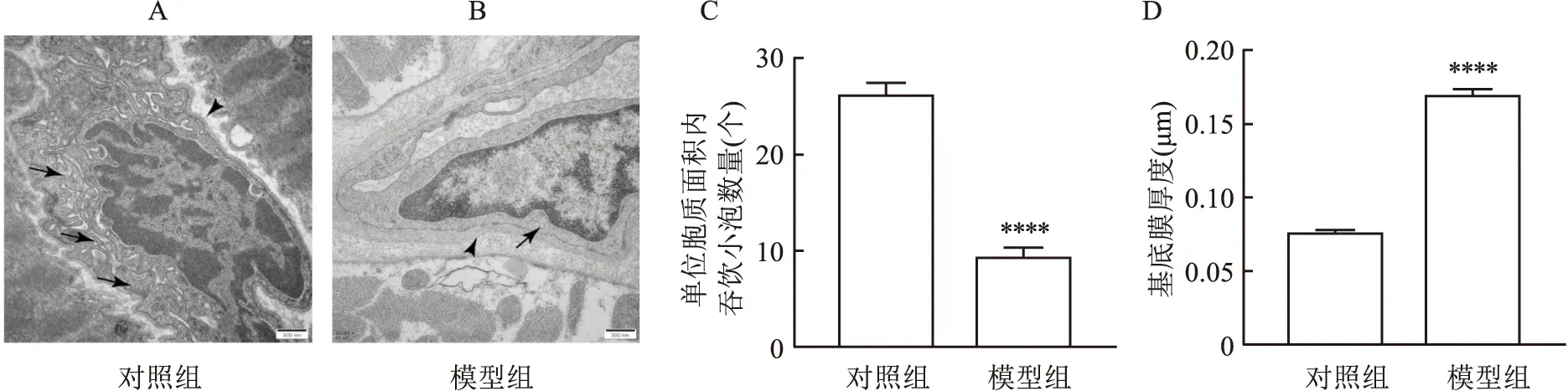
图5 食蟹猴左心室心肌微血管内皮细胞体视学观察A: 对照组心肌微血管内皮细胞 ×30 000;箭所示为吞饮小泡;箭头所示为基底膜;B: 模型组心肌微血管内皮细胞 ×30 000;箭所示为吞饮小泡;箭头所示为基底膜;C:模型组单位内皮细胞胞质内吞饮小泡数量减少;D:模型组内皮细胞基底膜厚度增加;与对照组比较:****P<0.000 1
3 讨论
糖尿病是由多种因素所引起持续性血糖偏高,从而导致糖、脂肪、蛋白质代谢紊乱,进而导致多系统、多器官损伤,尤其是对神经系统、心脏、肾脏、视网膜及血管的影响[3-5]。糖尿病所致心肌病变的发病机理尚不明确,目前研究[6]表明其病理机制包括氧化应激、炎症反应、线粒体结构功能改变、细胞凋亡与自噬、肾素-血管紧张素-醛固酮系统的异常激活等。目前有关T1DM患者的心肌组织超微结构的变化,以及T1DM动物模型所致心肌组织超微结构变化的研究较少。Sugawara et al[7]报道1例心功能不全的T1DM患者心肌细胞胞质中有大量脂滴。Dallak et al[8]研究显示,STZ诱导建立的T1DM大鼠模型,其左心室心肌细胞的超微结构发生变化:核染色质异常,肌原纤维断裂扭曲,肌丝广泛分离,脂滴显著增多;线粒体肿胀、线粒体嵴减少,部分呈空泡状,闰盘断裂错位,肌节变短,并且肌节、线粒体损伤的比例升高。但由于大鼠等啮齿类动物的遗传学、病理学和生理学与人类相差较远,从这些动物模型得出的结论并不完全适用于人类疾病,非人灵长类动物与人类亲缘关系更加接近,其作为动物模型以研究人类疾病的结果更加准确。本研究对T1DM食蟹猴模型的研究结果显示左心室心肌细胞中存在大量脂滴,课题组前期研究[9]表明T1DM食蟹猴脂代谢异常,提示脂代谢异常可能是引起心肌细胞损伤的原因之一。此外,本研究通过对左心室心肌细胞线粒体体视学结构进行定量分析,结果显示线粒体数量减少,线粒体相对电子密度、体积密度、表面积密度下降,更为具体地反映线粒体损伤情况。线粒体为脂肪酸和葡萄糖代谢的核心细胞器,通过氧化呼吸链实现氢的电子传递,经氧化磷酸化生成ATP[10],线粒体结构和功能受损导致心肌细胞ATP供给不足,影响心脏舒缩功能[11]。
目前关于糖尿病引起的心肌微血管内皮细胞损伤的研究较少。Radosinska et al[12]研究表明,在自发型2型糖尿病大鼠模型中,心肌微血管内皮细胞吞饮小泡减少;Schneider et al[13]研究表明,在自发型糖尿病大鼠模型中,心肌微血管内皮细胞的基底膜增厚;并且上述两项研究均未做定量分析。本研究通过对左心室心肌微血管内皮细胞的超微结构体视学定量分析,首次报道诱导型T1DM食蟹猴模型左心室心肌微血管内皮细胞损伤特征为吞饮小泡数量减少和基底膜增厚。其可能原因:一方面,脂代谢异常导致极低密度脂蛋白在体内大量蓄积,引起肿瘤坏死因子α表达升高,促进氧化应激反应,导致糖基化终末产物在微血管内膜、心肌细胞胞质沉积,引起微血管内皮细胞损伤和心肌纤维化[14];另一方面,高血糖促进血管内皮细胞氧化应激反应,经糖异生途径,导致糖基化终末产物积累,通过激活蛋白激酶C,进而引起内皮细胞损伤[3]。
