基于超高效液相色谱-质谱联用的代谢组学技术对人纤维肉瘤HT1080细胞铁死亡代谢特征的分析
2022-06-05吴珑婕杨文杰田咏梅
吴珑婕,韩 培,郝 蕴,王 佳,杨文杰,田咏梅
1)郑州大学公共卫生学院卫生化学教研室 郑州 450001 2)郑州大学公共卫生学院精准营养创新中心 郑州 450001 3)四川省医学科学院·四川省人民医院检验科 成都 610072
铁死亡是新发现的细胞死亡方式,其发生依赖于细胞中铁离子蓄积和脂质过氧化[1]。铁死亡在细胞形态、基因表达、蛋白表达和代谢等方面的变化可以将其区别于其他类型的细胞死亡,如凋亡、坏死和自噬等。铁死亡与人类健康息息相关:一方面铁死亡调节细胞死亡的能力使其成为一种极有潜力的抗癌策略;另一方面,铁死亡也存在于多种疾病的发生发展过程中,包括缺血再灌注损伤、神经退行性疾病和中风等[2-3]。铁死亡的发生受相关基因调控,代谢物发生多种变化[4]。
RSL3是铁死亡经典的诱导剂之一,它是谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)抑制剂,可直接与GPX4结合使其失活,诱导致死性脂质过氧化物积累,从而引发铁死亡。铁抑素1(ferrostatin-1,Fer-1)是一种有效的铁死亡抑制剂,能够防止RSL3诱导的脂质过氧化物蓄积,抑制细胞铁死亡。目前,RSL3和Fer-1已被国内外许多学者用于铁死亡诱导及抑制的相关研究[5-8]。
代谢组学是生物学研究中重要的组学技术之一[9]。基于液相色谱-质谱联用技术的代谢组学由于灵敏度高、通用性强和不需化学衍生化等优点,已成为筛选生物标志物和揭示药物作用机制的重要工具。细胞代谢组学可以提供细胞瞬时代谢图谱,有助于了解特定干预条件下细胞的整体代谢情况[10]。本研究分析了人纤维肉瘤细胞HT1080铁死亡代谢特征,以期为铁死亡的发生机制提供新线索。
1 材料与方法
1.1 主要试剂与仪器HT1080细胞由郑州大学公共卫生学院精准营养创新中心赠送。RSL3、Fer-1购自美国Sigma-Aldrich公司。CCK-8试剂盒购自日本同仁化学研究所。DMEM高糖和DMEM高糖无酚红培养基购自以色列Biological Industries公司。胎牛血清购自美国Gibco公司。DMSO、青链霉素双抗购自北京索莱宝科技有限公司。超高效液相色谱-四极杆飞行时间质谱仪(ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-QTOF MS)和ACQUITY UPLC HSS T3色谱柱(2.1 mm×150 mm,1.8 μm)购自美国Waters公司。
1.2 RSL3染毒条件的筛选HT1080细胞用完全培养基(含有青链霉素双抗和体积分数10%胎牛血清的DMEM高糖培养基)于37 ℃、体积分数5% CO2培养箱中培养,每2天传代1次。细胞活性测定采用CCK-8法。将细胞以104个/孔接种于96孔板中,过夜贴壁后弃去培养基,加入含终浓度为0.125、0.250、0.500、1.000、2.000 μmol/L RSL3的完全培养基,分别染毒6、12、24 h后弃去培养基,每孔加入10 μL的CCK-8试剂及200 μL完全培养基孵育 1~4 h,用酶标仪测定450 nm处的吸光度(A)值,计算细胞存活率。细胞存活率=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%,其中空白孔为不含细胞和药物的培养基,对照孔为含细胞、不含药物的培养基,每组设3个平行样。
1.3 细胞分组取处于对数生长期、状态良好的细胞接种于直径10 cm的培养皿,加含体积分数1%胎牛血清的DMEM细胞培养基,过夜贴壁生长后分为3组:铁死亡诱导组加入终浓度为1.000 μmol/L的RSL3;铁死亡抑制组同时加入终浓度为1.000 μmol/L的RSL3和终浓度为0.500 μmol/L的Fer-1;溶剂对照组加入DMSO;均干预6 h。每组设8个重复,其中1皿用于细胞计数;剩余7皿用于提取细胞内液,进行代谢组学分析。
1.4 细胞内液的提取取药物干预6 h后的3组细胞,弃去培养基,PBS清洗3次,加入2 mL体积分数25%的冷甲醇溶液,抑制代谢反应,用细胞刮刀收集细胞并重悬于2 mL冷甲醇溶液中,液氮速冻,-80 ℃冰箱储存。取出冻存细胞,4 ℃水融溶3 min,涡旋混匀,重复4次后于-20 ℃静置 0.5 h,取出后4 ℃、14 000 r/min离心15 min。取全部上清均匀分装到两个EP管中,分别用于正离子模式和负离子模式检测。氮气吹干溶剂后用800 μL体积分数50%的乙腈溶液复溶,4 ℃、14 000 r/min离心 15 min,取600 μL上清液用于分析。
1.5 代谢组学检测采用UPLC-QTOF MS和ACQUITY UPLC-HSS T3色谱柱进行分析。
正离子模式。柱温40 ℃。流动相A:含体积分数0.1%甲酸的纯水,流动相B:含体积分数0.1%甲酸的乙腈,梯度洗脱条件见表1。样品室温度为10 ℃,毛细管电压3.2 kV,脱溶剂气温度500 ℃,源温度120 ℃。脱溶剂气流速为800 L/h,锥孔气流速为50 L/h。扫描范围为50~1 000 m/z,扫描时间为0.2 s。进样量为2 μL。
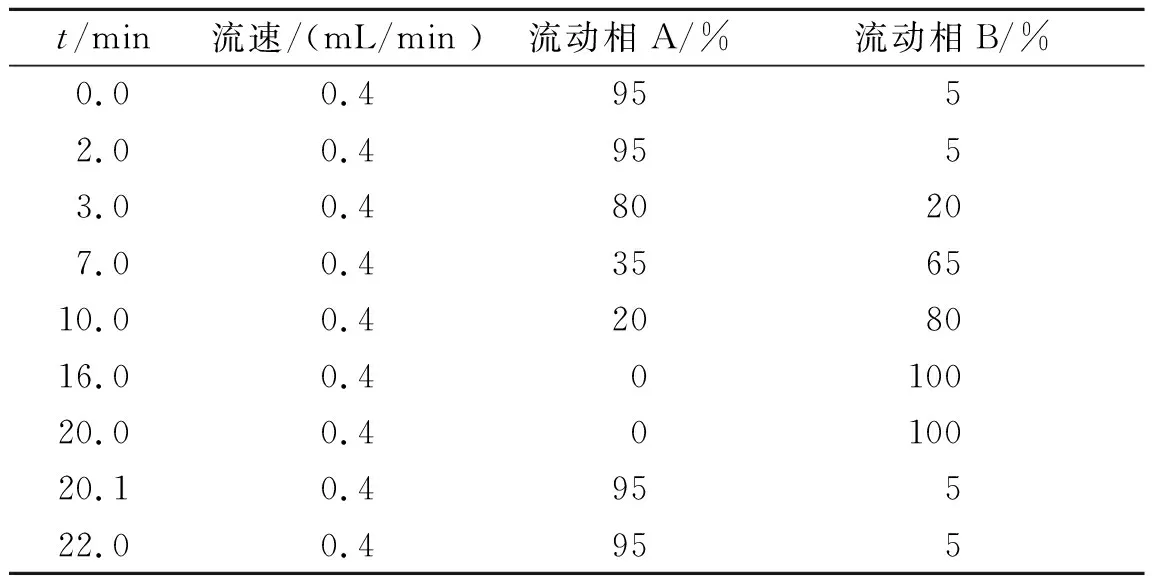
表1 细胞内液梯度洗脱条件
负离子模式。柱温40 ℃。流动相 A:纯水加入体积分数0.1%的氨水,使溶液呈碱性(pH 8.5~9.5)。流动相 B:体积分数95%的乙腈(LC-MS级),加入体积分数5%的流动相A。流动相梯度洗脱条件同正离子模式。
1.6 代谢组学数据处理将UPLC-QTOF MS产生的总离子流色谱图(TIC)导入Progensis QI 2.0进行去噪、峰强度提取等数据预处理,再将峰强度数据导入MetaboAnalyst 5.0网站(https://www.metaboanalyst),根据细胞数量标准化后进行分析。采用无监督模型的主成分分析(principal component analysis,PCA)对各组分布情况进行可视化观察;采用有监督模型的偏最小二乘法判别分析增强组间分离并筛选差异代谢物;采用正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)进行组间分析,模型质量用R2Y和Q2两个参数进行评估,其中R2Y表示模型解释能力,Q2表示模型预测能力。热图用于进行差异代谢物的筛选。根据变量重要性投影值(variable importance in the projection,VIP)>1,变化倍数(fold change,FC)>1.5,P<0.05筛选差异代谢物。采用人类代谢组数据库HMDB(https://hmdb.ca/)对差异代谢物进行鉴定。代谢通路采用Pathways analysis模块进行分析。
1.7 统计学处理采用SPSS 20.0进行分析,细胞存活率的比较采用5×3析因设计的方差分析。检验水准α=0.05。
2 结果
2.1 RSL3染毒条件的筛选结果见表2。选择1.000 μmol/L的RSL3作用6 h进行下一步实验。

表2 不同浓度RSL3染毒不同时间后HT1080细胞存活率比较(n=3)
2.2 溶剂对照组、铁死亡诱导组和铁死亡抑制组典型的TIC见图1。3组正离子模式下细胞内液代谢物TIC均存在差异(图1)。正离子模式下得到640个m/z,负离子模式下得到250个m/z。
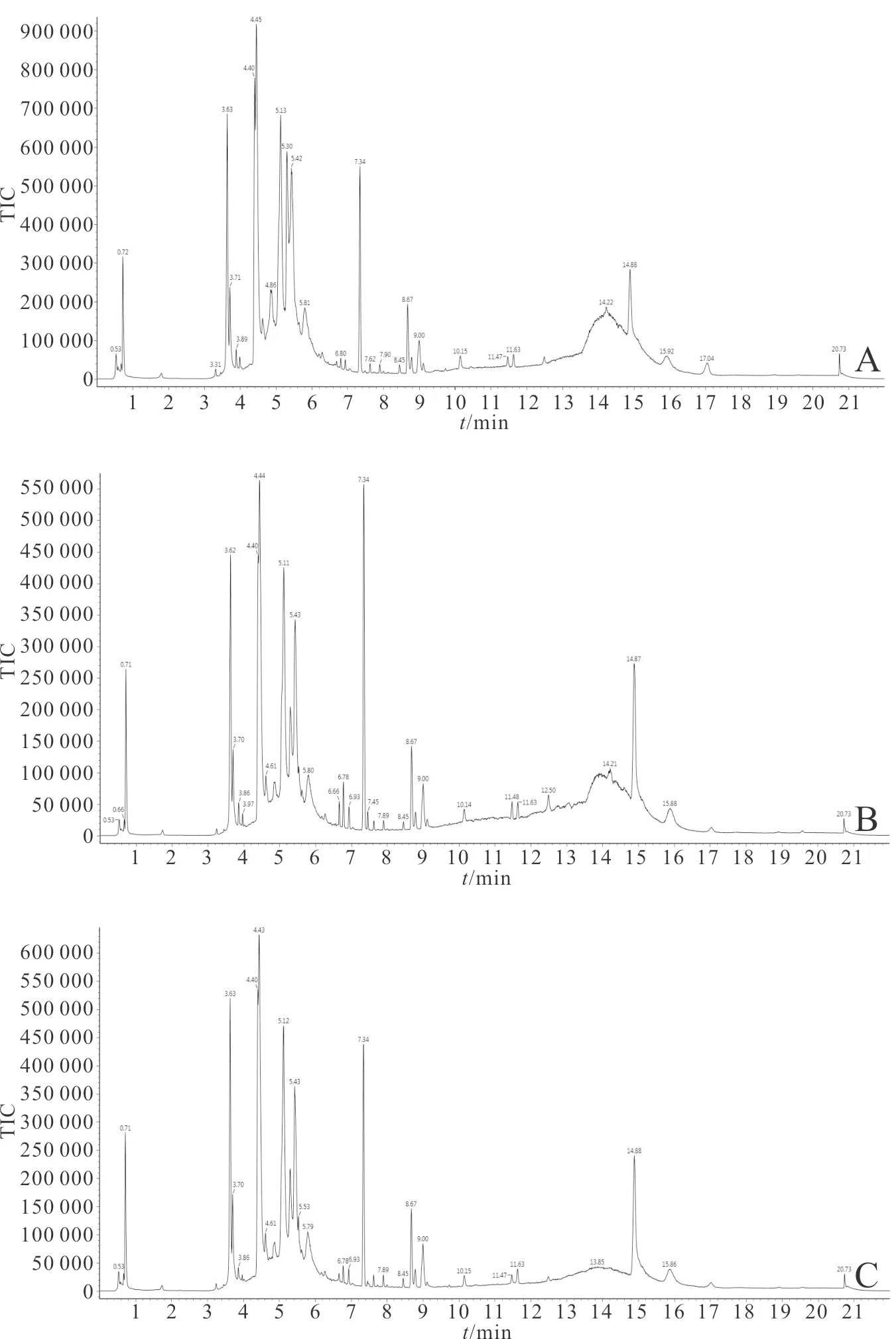
A:溶剂对照组;B:铁死亡诱导组;C:铁死亡抑制组
2.3 OPLS-DA模型分析得分图见图2。铁死亡诱导组和溶剂对照组、铁死亡诱导组和铁死亡抑制组数据判别分析结果显示两对数据两种模式下均表现为聚类分离,铁死亡诱导组和溶剂对照组,铁死亡诱导组和铁死亡抑制组细胞的代谢谱均发生了明显改变。铁死亡诱导组和溶剂对照组正离子模式下R2Y=0.829,Q2=0.758;负离子模式下R2Y=0.788,Q2=0.713;铁死亡诱导组和铁死亡抑制组正离子模式下R2Y=0.743,Q2=0.675;负离子模式下R2Y=0.774,Q2=0.725,模型拟合较好,解释率和预测能力都较高。

A、C:正离子模式;B、D:负离子模式
2.4 潜在生物标志物的筛选聚类热图分析结果见图3,最后共筛选出来60个差异代谢物。筛选出的差异代谢物在铁死亡诱导组变化显著,并且在铁死亡抑制组中这些变化逆转。取60个差异代谢物中上调和下调变化最明显的各5个代谢物,得到代表性铁死亡差异代谢物,主要包括脂质和类脂质分子、有机氧化合物、有机酸及其衍生物、苯类等几大类(表3)。

图3 铁死亡相关差异代谢物聚类热图分析

表3 代表性铁死亡相关差异代谢物
2.5 代谢通路分析将铁死亡诱导组与溶剂对照组的差异代谢物进行代谢通路分析,结果见图4。差异代谢物主要集中在甘油磷脂代谢、鞘脂类代谢、谷胱甘肽代谢等通路,其中圆点颜色越深说明代谢差异性越显著,圆圈越大代表对代谢通路的重要性越大。

图4 铁死亡诱导组与溶剂对照组细胞内液差异代谢通路分析
3 讨论
铁死亡作为一种新型的程序性细胞死亡方式,已被证明与多种疾病的病理生理过程密切相关[11]。因此,探究铁死亡机制,为调控疾病发生发展过程中的铁死亡具有重要意义。本研究用UPLC-QTOF MS技术对铁死亡诱导组、铁死亡抑制组和溶剂对照组进行了非靶向代谢组学分析,筛选出60个铁死亡相关差异代谢物,并发现甘油磷脂代谢、谷胱甘肽代谢、鞘脂类代谢等代谢通路与铁死亡密切相关。
7-酮基胆固醇是细胞在氧化应激条件下胆固醇非酶促氧化的产物,被认为是氧化应激的生物标志物[12]。本研究结果显示7-酮基胆固醇在铁死亡诱导组上调高达95倍。而氧化应激是铁死亡的重要表现之一,7-酮基胆固醇大幅升高可能提示铁死亡发生过程中存在胆固醇非酶促氧化,但仍有待于进一步探究。此外,有文献[13]报道7-酮基胆固醇在尼曼匹克病C1型患者血浆中显著升高,是其新兴的生物标志物。尼曼匹克病主要致病原因是与清除细胞中的胆固醇和脂质相关的基因发生突变。而该疾病中发生的脂质蓄积是铁死亡的特征之一,这提示尼曼匹克病C1型可能有铁死亡的参与。也有研究[14]表明铁死亡是神经退行性疾病潜在机制之一,而7-酮胆固醇是参与改变神经元脂质代谢的主要毒性成分之一,可导致炎症和神经细胞损伤并可诱导氧化应激、影响细胞膜通透性。以上结果提示7-酮胆固醇与铁死亡的发生密切相关,是一种有潜力的铁死亡生物标志物。
维生素D被证明具有抗氧化作用[15]。本研究结果显示维生素D3在铁死亡诱导组上调55倍。由于本研究选择的是铁死亡发生早期的细胞内液,以上结果提示铁死亡早期细胞针对氧化应激的反馈作用可能导致维生素D3上调,但具体机制仍有待于进一步探究。
植烷酸是过氧化物酶体中α氧化的活化剂[16],对细胞脂质代谢有重要作用。研究[17]表明植烷酸处理后的卵母细胞GSH水平显著增加,同时ROS水平显著降低,表明植烷酸对细胞过氧化物酶体的抗氧化防御有积极影响。而铁死亡发生过程中伴随着ROS上升和GSH下降。本研究结果表明铁死亡诱导组的植烷酸水平显著降低,提示细胞发生铁死亡可能与植烷酸水平降低导致的抗氧化防御系统被破坏有关。
脂质是细胞膜的结构成分,对细胞的增殖、分化、代谢调节等都有重要作用。脂质过氧化物的积累是铁死亡的重要特征[18]。以往研究[19]表明,脂质代谢在铁死亡发展过程中起着非常重要的作用,这与本研究发现的甘油磷脂代谢通路和鞘脂类代谢通路两个脂质代谢通路在铁死亡发生过程中具有重要意义相一致。
总之,本研究以HT1080细胞为研究对象,筛选出60个铁死亡相关差异代谢物,并发现甘油磷脂代谢、谷胱甘肽代谢、鞘脂类代谢与铁死亡密切相关,为进一步探讨铁死亡机制提供线索。
