云南短头熊蜂的繁育特性研究
2022-06-03秦加敏丁桂玲黄家兴宋文菲
秦加敏,丁桂玲,黄家兴,苏 睿,杨 爽,宋文菲,梁 铖*
(1. 云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101;2. 中国农业科学院蜜蜂研究所,农业农村部授粉昆虫生物学重点开放实验室,北京 100093)
熊蜂是重要的传粉昆虫,繁育熊蜂为农作物授粉,是生产绿色农产品的配套技术,可以降低劳动成本,减少外源植物激素的应用。随着设施农业和熊蜂商品化的发展,熊蜂对温室作物的授粉服务变得越来越重要,需求量日益增加(Velthuis and van Doorn, 2006; Yoon and Lee, 2014)。全球约有260种熊蜂(Cameron and Sadd, 2020),而被驯化推广应用的只是其中少数几种,包括欧洲的地熊蜂Bombusterrestris,中国的兰州熊蜂B.lantschouensis和密林熊蜂B.patagiatus,美国的B.impatiens(黄家兴和安建东, 2018; Campbelletal., 2019)。全球熊蜂资源丰富,可生产应用的物种较少,其原因主要与熊蜂的繁育特性有关。目前,欧洲的地熊蜂是全球范围内商业化应用最多的授粉熊蜂(Velthuis and van Doorn, 2006)。研究表明,地熊蜂在日本、澳大利亚、新西兰、以色列、智利等多个国家已经造成了生物入侵,与本土熊蜂竞争食物和栖息场所,甚至同本土熊蜂杂交,导致不孕和子代退化(谢正华和唐亚, 2009; Tsuchidaetal., 2019)。中国研究发现,地熊蜂能够干扰本土熊蜂正常交尾,具有较高的生殖干扰风险(袁晓龙等, 2018)。鉴于此,挖掘本土熊蜂资源,繁育农业授粉蜂群至关重要。
熊蜂属Bombus内除拟熊蜂亚属Psithyrus物种外均为初级社会性昆虫,大多数熊蜂一年发生一代。早春,蜂王出蛰采集食物,卵巢发育后选址筑巢,产第1批卵并独自哺育,第1批工蜂出房后协助蜂王培育后代,外出采集食物,蜂王留在巢内专职产卵。夏末,蜂群快速壮大,培育子代雄性蜂和蜂王,子代蜂王交尾后进入滞育状态,持续6~9个月,老蜂王、工蜂和雄性蜂陆续死亡,蜂群自然解体消亡(Alford, 1969; Beekman and Stratum, 2000)。熊蜂广泛分布于欧洲、亚洲和美洲大陆,甚至在北极圈以南88 km的地方也有分布(Williams, 1998),不同的熊蜂种间繁育特性差异较大,中国本土红光熊蜂B.ignitus、密林熊蜂、火红熊蜂B.pyrosoma、重黄熊蜂B.picipes和兰州熊蜂在人工饲养条件下,产卵蜂王率高,工蜂数量都在110头以上,雄性蜂数量在160头以上,子代蜂王数量在30头以上,易于人工驯养;而朝鲜熊蜂B.koreanus、斯熊蜂B.sichelii、黑尾熊蜂B.melanurus及富丽熊蜂B.opulentus的产卵蜂王率和成群率低(安建东等, 2010)。同一物种因地理分布的不同繁育特性也存在差异。安纳托利亚地区的地熊蜂在室内饲养,平均每群只产生蜂王27.8头,工蜂131.5头,雄性蜂332头(Yeninar and Kaftanoglu, 1997);而中国新疆西部地区捕获的地熊蜂室内饲养,每群平均产生蜂王151头,工蜂296头,雄蜂450头(Zhangetal., 2018)。因此,开展熊蜂的繁育特性研究对于挖掘本土熊蜂资源和开发新的农业授粉蜂种是极为重要的。
短头熊蜂B.breviceps隶属于阿熊蜂亚属Alpigenobombus,主要分布在中国南方及东南亚地区(Williamsetal., 2009; Naeemetal., 2019),通过体色模式变化分析表明中国西南山地是该物种的多样性中心(Williams, 2007; Williamsetal., 2009)。云南省自然地理环境复杂多样,气候独特,熊蜂物种资源丰富,在所记录的35种熊蜂中,短头熊蜂地理分布跨越多个气候带和生物地理区划,为众多野生植物和农作物的重要传粉者,是境内优势熊蜂种(梁铖等, 2018)。近年来,短头熊蜂被成功繁育,其群势强,是一种新的具有较大农业授粉应用潜能的本土传粉蜂资源(Liangetal., 2020)。但不同地理分布的短头熊蜂的繁育特性是否存在差异,目前还不清楚。因此,本研究收集云南不同地区的短头熊蜂蜂王进行人工饲养,比较分析其繁育特性,旨在为本土熊蜂资源的繁育技术集成和推广提供参考,对我国熊蜂种质资源保护和开发应用具有重要意义。
1 材料与方法
1.1 实验材料
于2019年3-4月在云南屏边、个旧和昆明3个地区抓捕出蛰约7 d的野生短头熊蜂蜂王,用GPS记录地理位置信息,采集信息见表1。
1.2 数据收集
将捕获的蜂王放入同一间饲养室,室内温度29± 1℃,相对湿度60%±5%,每隔一天饲喂一次50%蔗糖溶液(w/w)和新鲜花粉团,每次饲喂时观察并记录蜂群以下几项发育指标。
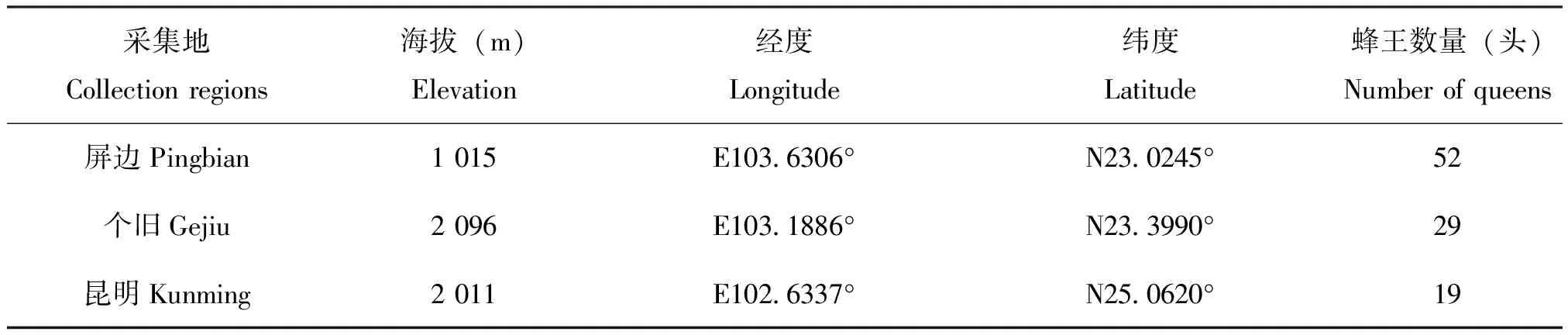
表1 云南省不同地区短头熊蜂蜂王的数量
产卵前期:从开始饲养蜂王到见到第1个卵包的间隔天数;工蜂发育历期:主要记录第1批工蜂卵、幼虫、蛹的发育时间;卵期:从见卵包到卵包明显变大,蜡被内可见小幼虫时的间隔天数;幼虫期:小幼虫时到大幼虫吐丝做茧时的天数;蛹期:从吐丝做茧的次日到工蜂出房时的间隔天数;始见工蜂时间,从开始饲养到第1头工蜂出房的间隔天数;产卵蜂王率:产卵蜂王占试验蜂王的比例;蜂群可应用率:工蜂数量50~60头并且蜂王健康、产卵正常的蜂群占试验蜂王总数的比例(Gureletal., 2012)。工蜂、雄性蜂和子代蜂王的数量:每个蜂群最终羽化出房的工蜂、雄性蜂和子代蜂王的数量。
1.3 数据分析
2 结果与分析
2.1 蜂王产卵前期和工蜂发育期
熊蜂是完全变态昆虫,个体发育经历卵、幼虫、蛹和成虫四个阶段。数据分析显示,在相同的饲养条件下,3个不同地区短头熊蜂第1批出房工蜂的卵期、幼虫期和蛹期差异不显著(P>0.05);屏边地区的蜂王产卵前期时间最长(15.2±13.1 d),显著高于个旧地区(9.6±4.9 d)和昆明地区(8.9±3.7 d)(P<0.05),个旧和昆明两地区短头熊蜂蜂王产卵前期差异不显著(P>0.05)(表2)。
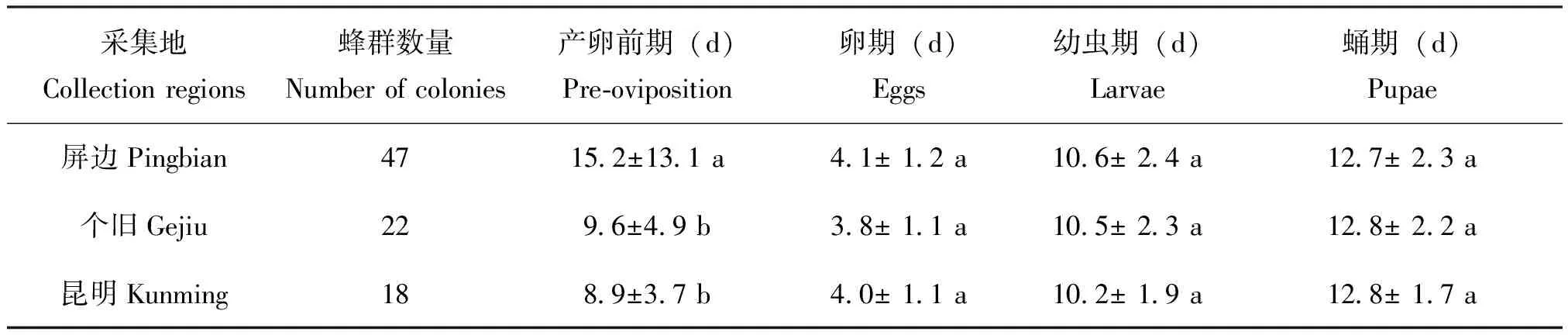
表2 云南省不同地区短头熊蜂第1批工蜂发育历期
2.2 蜂群生长特性
在相同饲养条件下,屏边地区的短头熊蜂蜂王组建的蜂群始见工蜂历时最长(43.7±14.0 d),显著高于个旧地区(36.7±5.9 d)和昆明地区(36.0±5.9 d)(P<0.05),蜂群工蜂数量达到6头、30头和60头的历时最长,显著高于个旧和昆明两个地区(P<0.05)。个旧和昆明两个地区短头熊蜂蜂群始见工蜂时间及工蜂数量达到6头、30头和60头历时差异不显著(P>0.05)(表3)。

表3 云南省不同地区短头熊蜂蜂群生长特性比较
2.3 产卵蜂王率和蜂群可应用率
在相同的饲养条件下,昆明地区的短头熊蜂产卵蜂王率为94.7%,依次高于屏边地区(90.4%)和个旧地区(75.9%)。三地的短头熊蜂蜂群可应用率均超过60%,从高到低依次是昆明地区84.2%,个旧地区72.4%,屏边地区63.5%(图1)。
2.4 群势
在相同的饲养条件下,昆明地区的短头熊蜂蜂群工蜂数量最少(313±88头),显著低于屏边地区(426±185头)和个旧地区(462±137头)(P<0.05),但子代蜂王数量(50±31头)显著高于屏边地区(31±23头)和个旧地区(28±22头)(P<0.05),雄性蜂数量(670±185头)也显著高于屏边地区(464±245头)(P<0.05),但与个旧地区(564±299头)相比差异不显著(P>0.05),3个地区短头熊蜂的群势(三型蜂数量之和)差异不显著(P>0.05)(表4)。

图1 云南省不同地区短头熊蜂产卵蜂王率和蜂群可应用率Fig.1 Egg laying rate and the saleable colony production rate of Bombus breviceps from different regions of Yunnan

表4 云南省不同地区短头熊蜂的群势
3 结论与讨论
短头熊蜂是云南境内的优势蜂种,其群势大,分布广,说明其有较强环境适应性(Liangetal., 2020)。本实验采集的蜂王均来自云南境内,但在相同的饲养条件下蜂王产卵前期、蜂群发育历期、三型蜂数量等方面存在显著性差异,可能与采样地点的生境差异有关。3个采样地点,在自然地理、气候和生物区划方面是不同的。昆明位于云南北部,屏边和个旧位于南部,南北纬度相隔约2度,气候方面昆明属于北亚热带,个旧属于中亚热带,屏边属于南亚热带(段旭等, 2011),云南熊蜂地理区划中个旧和屏边属于同一小区,与昆明不同,也就是说个旧、屏边与昆明熊蜂物种组成不相似(梁铖等, 2018),其次在云南植物地理区划方面,也属于不同的小区(Lietal., 2015),存在不同的蜜粉源植物。昆明地区的工蜂数量最少,明显少于屏边和个旧地区,这可能是南、北两地不同的气候环境引起短头熊蜂的生物学特性的变化。
蜂王的产卵前期对人工饲养的效率产生影响,是评价饲养技术和蜂种特性重要的指标。屏边地区短头熊蜂蜂王产卵前期和始见工蜂时间均最长,其次是个旧,昆明地区最短,除了生物学特性的差异,也可能与当地熊蜂蜂王本身的健康状况有关。本研究短头熊蜂蜂王产卵前期和始见工蜂时间比欧洲地熊蜂Bombusterrestris蜂王产卵前期(6.9~11.2 d)和始见工蜂时间(27.3~34.2 d)略长(Imranetal., 2017),在繁育可应用蜂群上可能需要更长的时间。此外,无病虫害的蜂王产卵前期较短,蜂群的成群率高,有病虫害的蜂王往往推迟产卵,蜂群的成群率低(Imhoof and Schmid, 1999)。泰国北部的短头熊蜂被熊蜂微孢子虫Nosemabombi和东方蜜蜂微孢子虫Nosemaceranae感染(Sinpooetal., 2019),同属东南亚的云南短头熊蜂是否被感染而导致蜂王产卵前期不同,还有待进一步研究。尽管屏边地区的蜂王产卵前期时间显著高于昆明和个旧两个地区,但并不影响蜂群的整体群势。
熊蜂的进化程度比较低,对环境变化的调控能力差,其发育状况受环境因素的影响很大(Gurel and Gosterit, 2008),相同的饲养条件下 3个不同地区的短头熊蜂工蜂个体发育的卵期、幼虫期、蛹期均没有显著性差异。然而,在人工饲养条件下,开箱检查和饲喂食物可能影响蜂王对卵和幼虫的保温作用,进而影响卵的孵化和幼虫发育,工蜂的发育期与自然界是否相似,有待进一步研究。
在相同的饲养条件下,短头熊蜂产卵蜂王率从高到低依次为昆明、屏边和个旧,昆明和个旧两地的蜂群可应用率皆高于屏边,昆明地区所有成群的蜂群均能达到市场可应用要求(Gureletal., 2012)。尽管昆明地区的工蜂数量明显少于个旧和屏边,蜂王数量明显高于个旧和屏边两个地区,但3个地区蜂群的群势没有显著差异。与其它人工饲养的熊蜂相比,3个地区短头熊蜂工蜂数量均高于欧洲地熊蜂及我国北方的密林熊蜂、红光熊蜂和兰州熊蜂(Zhangetal., 2018)。昆明地区短头熊蜂工蜂数量与美国的B.impatiens相近,但子代蜂王和雄性蜂数量较多(Cnaanietal., 2002)。云南3个地区的短头熊蜂在群势上都具有明显优势,在为花朵数量多的作物授粉可能更占优势。但产生子代蜂王的数量与欧洲地熊蜂及我国北方的本土熊蜂相比还有差距,在种群扩大方面还需加强优良蜂王培育技术研究。
总之,云南不同地区短头熊蜂的人工繁育特性存在差异,可能存在南、北两个类群,但这还需要进一步开展生物学特性和系统发育生物学研究。云南短头熊蜂群势强,易于人工繁育,具有重要的授粉利用价值,本研究结果可为云南短头熊蜂的繁育技术集成和推广提供参考,进而为云南设施花卉、水果、蔬菜、坚果及中药材等产业提供授粉服务,助力云南高原特色现代农业高质量发展。
