中华蜜蜂OBP19的克隆与时空表达分析
2022-06-03马秀梅杜亚丽刘晋佳姚慧敏张宇昊马卫华姜玉锁
马秀梅,杜亚丽,刘晋佳,姚慧敏,张宇昊,马卫华,姜玉锁*
(1. 山西农业大学动物科学学院,山西太谷 030801;2. 山西省农业科学院园艺研究所,太原 030031)
蜜蜂作为自然界主要的授粉者,是人类不可或缺的优良生物资源(陈瑜和马春森, 2010),它作为一种重要的社会性昆虫,主要依赖其灵敏的嗅觉系统来识别并区分外界环境中的各种化学信号(杜亚丽等, 2019)。通过嗅觉感知外界环境中的花香物质、信息素和其它气味挥发物等各种气味物质来搜寻食物来源、躲避敌害、产卵和交配等一系列生命活动(Fanetal., 2011)。气味分子与受体蛋白特异性结合,并将气味复合物转运到相应受体使昆虫的嗅觉受体精确识别并区分不同气味复合物完成整个嗅觉过程均离不开气味结合蛋白家族的参与(陈艺杰等, 2020)。
OBPs是一类低分子量可溶性蛋白(Pelosi, 1994),一般由130~150个氨基酸组成,呈酸性,承担外界环境与气味受体(olfactory receptors, ORs)之间互相连接的任务(Zhou, 2010; Liuetal., 2018)。当昆虫触角表面的感器微孔中有气味分子渗入,这些气味分子就会被OBPs结合,形成气味结合蛋白-气味分子复合体,然后这些复合体会通过感器淋巴液,激活感器树突膜上的ORs,引起嗅觉神经元的兴奋(Britoetal., 2016)。OBPs还可以通过结合疏水性化学信息素作为载体,将其传递给嗅觉受体或感觉神经元膜蛋白发挥作用(Marchetal., 2014; Gongetal., 2015)。
蜜蜂OBPs的种类可分为触角特异性结合蛋白、普通气味结合蛋白和信息素结合蛋白(张升祥等, 2010)。也有根据保守半胱氨酸Cys的模式将OBPs分为Classical OBPs、Minus-C OBPs、Plus-C OBPs、Dimer OBPs和Atypical OBPs。通过半胱氨酸位点的数量大致把OBPs氨基酸序列中含有6个保守Cys位点,有3个二硫键的归为Classical OBPs。把含有4或5个保守Cys位点,仅含有2个二硫键的归为Minus-C OBPs。含有至少2~3个额外的Cys,并且在第6个Cys之后有存在1个保守的脯氨酸位点的归为Plus-C OBPs(Liuetal., 2017)。将具有由2个典型的Cys基序聚合在一起特征的归为Dimer OBPs(Campaninietal., 2016; Yangetal., 2019)。OBPs有较为典型的N端区域,而C端区域较长且特征不明显的归为Atypical OBPs(Malinietal., 2013; 杜亚丽等, 2020)。大量研究表明,OBPs的主要功能包括: 选择性结合气味分子及信号转导; 协助气味分子的运送;降解和清除气味分子及有毒物质;以及使受到气味分子刺激后的受体迅速失活,避免嗅觉神经元因持续的刺激而过度兴奋(Yangetal., 2018; 杜亚丽等,2019)。
研究表明OBPs除了在昆虫的气味感知和传递中起着重要作用,很可能还发挥其他生理功能(Guoetal., 2020)。研究发现OBPs不仅在触角等嗅觉器官中表达,还在口器、足和翅等味觉器官中表达,这说明OBPs在行使嗅觉功能的同时也可能参与对呈味物质的识别过程(谷少华, 2013; 杨叶青等, 2017),如中华蜜蜂足中特异性高表达的AcerOBP15在采集花蜜和花粉时参与味觉识别过程(Duetal., 2021)。也有相关研究发现OBPs在中肠和腺体等其它非嗅觉器官中广泛表达,推测它们不仅只参与嗅觉感知功能,还有可能参与其他生理功能(Picimbonetal., 2001; Gongetal., 2007; Danietal., 2011; Liuetal., 2014)。
中华蜜蜂(Apisceranaceran,简称中蜂)作为我国的独有蜂种,广泛活动在我国山林地区,因其嗅觉灵敏、抗病抗逆能力强、采集性优良及善于利用零星分散蜜粉源等优点,在这些地区发挥着不可替代的作用(苏松坤等, 2005; 王凤鹤等, 2007; Zhaoetal., 2014; 陈艺杰等, 2020)。目前有关中华蜜蜂OBPs的研究相对匮乏,鉴于OBPs在中蜂生理功能上具有重要意义,本研究通过克隆获得中蜂的AcerOBP19的ORF序列,对该蛋白进行生物信息学分析并预测其蛋白结构,明确在不同发育阶段该基因在触角、足、口器、毒腺和中肠的表达水平,以期为蜜蜂的嗅觉识别机制的研究及气味结合蛋白在味觉功能上的深入探究提供理论依据。
1 材料和方法
1.1 实验材料
1.1.1实验样本
试验用样本由山西农业大学动物科技学院实验蜂场提供,所有样品采集时间为2020年6-7月。
样本的采集:从健康无疾病、无自然分蜂倾向、群势强的中蜂巢中取出两张整齐的封盖子脾放于人工培养箱恒温培养(培养温度35±0.2℃,相对湿度50%~70%),当蜜蜂出房后在其背部用无味无毒的油漆进行标记,待油漆干后放回原蜂巢,采样时期为成蜂1、5、10、15、20、25日龄,组织为触角、足、口器、中肠和毒腺。100头工蜂的组织混合样作为一个生物学重复。克隆样本的采集:随机抓取一日龄工蜂3头。当样品采集后放入研钵中研磨,随后将粉末倒入装有1 mL TRIzol的离心管中,震荡混匀后-80℃保存备用。
1.1.2主要试剂
TRIzol RNA分离试剂购自赛默飞世尔科技有限公司(中国);荧光定量试剂盒SYBR©Premix Ex TaqTM II (Tli RNaseH Plus)、反转录试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser (perfect real time)、Trans5α和克隆载体pMDTM19-T等购自TaKaRa宝生物工程有限公司(大连);2×M5 HiPer plus HiFi PCR mix (with bye dye)购自聚合美生物科技有限公司(北京);D2000 DNA Ladder、50×TAE Buffer、固相RNase清除剂、DNase/RNase-free water、异丙醇、氯仿和购自索莱宝科技有限公司(北京);DNA Gel/PCR Purification Miniprep Kit凝胶回收试剂盒购自杭州倍沃医学科技有限公司。
1.1.3供试仪器
HWS0358人工智能气候培养箱(江南仪器厂,中国宁波),DYCP-31DN琼脂糖水平电泳仪(六一,中国北京),Forma 700超低温冰箱(Thermo,美国),SIM-F124制冰机(Sanyo,日本),5430R台式高速离心机(Eppendorf,德国),ND-1000核酸蛋白仪(NanoDrop,美国),荧光定量PCR仪(Bio-Rad,美国)。
1.2 实验方法
1.2.1总RNA的提取和cDNA的合成
根据TRIzol试剂说明书提取1.1.1中收集的不同发育时期成蜂各组织的总RNA,用核酸浓度测定仪测定浓度。用1 μg总RNA为模板进行反转录,将合成的cDNA测定浓度后置于-20℃保存。
1.2.2引物设计
通过课题组前期所获得的序列,设计扩增目的基因cDNA序列的引物。用克隆获得的序列和内参基因Arp1(GenBank登录号:NM_ 001185145.1)的ORF序列,设计用于qRT-PCR的特异性引物。引物由生工生物工程股份有限公司(上海)合成,引物信息见表1。
1.2.3OBP19基因的克隆
以1.2.1保存的中蜂cDNA为模板对AcerOBP19基因进行PCR扩增,反应体系(10 μL)如下:2×M5 HiPer plus Taq HiFi PCR mix(with blue dye) 5 μL,上游引物(10 μM)、下游引物(10 μM),各0.3 μL,cDNA模板1.0 μL(<1 μg),RNase Free dH2O 3.4 μL。最优反应程序为:95℃预变性4 min;35个循环:95℃变性 26 s,58℃退火26 s,72℃延伸16 s;72℃终延伸5 min;4℃ ∞。以Marker DL 2000作为参照,将PCR产物经2%琼脂糖凝胶电泳后,在紫外凝胶成像系统中检测目的条带。检测后将扩增产物回收纯化,连接至pMDTM19-T载体,将载体转化到Trans5α感受态细胞,通过蓝白斑筛选,挑出单一饱满的白色菌落放入LB液体培养基中进行扩大培养。菌液PCR鉴定后,把阳性克隆产物送华大基因科技有限公司(北京)进行测序。

表1 试验所用引物
1.2.4OBP19基因的序列分析
利用在线软件ORF Finder(http://www. ncbi.nlm.nih.gov/gorf/gorf.html)查找序列的开放阅读框,用EditSeq预测其编码的氨基酸序列。氨基酸序列的同源性通过NCBI中的Protein BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)工具进行分析;从GenBank数据库中下载与其同源性较高的昆虫OBPs序列,使用MEGA-X软件构建系统发育树,选择邻接法Neighbor-Joining(Bootrap为1 000次)。蛋白生物信息学分析参考杜亚丽等(2016)。
1.2.5荧光定量PCR检测
以各日龄的组织cDNA(浓度稀释到200 ng/μL)为模板,使用SYBR©Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒进行荧光定量PCR,每个样品进行3次技术重复。反应体系为10 μL:SYBR©Premix Ex TaqTMⅡ 5 μL,上游引物0.4 μL,下游引物0.4 μL,cDNA 1 μL,ddH2O 3.2 μL;反应程序:95℃预变性30 s,接着进行45个循环:95℃ 30 s,60℃ 34 s。测定溶解曲线的反应条件为:以0.5℃的温度从60℃到95℃。
1.2.6数据处理与分析
以15日龄中蜂触角的表达量为基准,根据荧光曲线的Ct值,用2-△ △ Ct法进行数据分析,显著性差异用SPSS 22.0软件中的单因素方差分析(ANOVA)。结果以平均数±标准误(Mean±SE)表示,通过GraphPad Prism 9.0软件进行图形分析。
2 结果与分析
2.1 基因的克隆与测序
根据设计的特异性引物,以中蜂cDNA为模板对AcerOBP19基因进行PCR扩增,电泳图显示扩增的目的片段和预测的长度(420 bp)一致(图1)。

图1 AcerOBP19基因PCR产物电泳图Fig.1 Electrophoresis of the PCR products of AcerOBP19 gene注:M,DNA分子量Marker;1,PCR产物。Note: M, DNA Marker; 1, PCR product.
2.2 基因的序列分析
在NCBI中将测序所得序列进行Blastn比对,结果显示与西方蜜蜂AmelOBP19(GenBank登录号:NM_ 001040209)的核苷酸序列相似性为83.58%。AcerOBP19基因的ORF序列长为 420 bp,编码139个氨基酸,其序列(图2)中含有4个保守的半胱氨酸位点,属于Mins-C亚家族。

图2 AcerOBP19 cDNA核苷酸序列及其推导的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of AcerOBP19 cDNA注:大写字母为开放阅读框ORF;起始密码子和终止密码子用斜体标识,信号肽序列用下划线标注,保守半胱氨酸位点用黑色方框标注。Note: ORF was described by uppercase letters; Initiation codon was indicated by italic, sequence of signal peptide was underlined, conserved cysteine sites were labeled by black box.
2.3 生物信息学分析
2.3.1蛋白的基本理化性质
使用在线软件ProtParam预测AcerOBP19理化性质(表2)。该蛋白分子量为16.11 kDa,为小分子蛋白;理论等电点pI为4.47,为酸性蛋白;不稳定系数为23.02(<40),较稳定;总平均系数为-0.375,为亲水性蛋白;脂溶系数为82.66(<90),为水溶性蛋白。
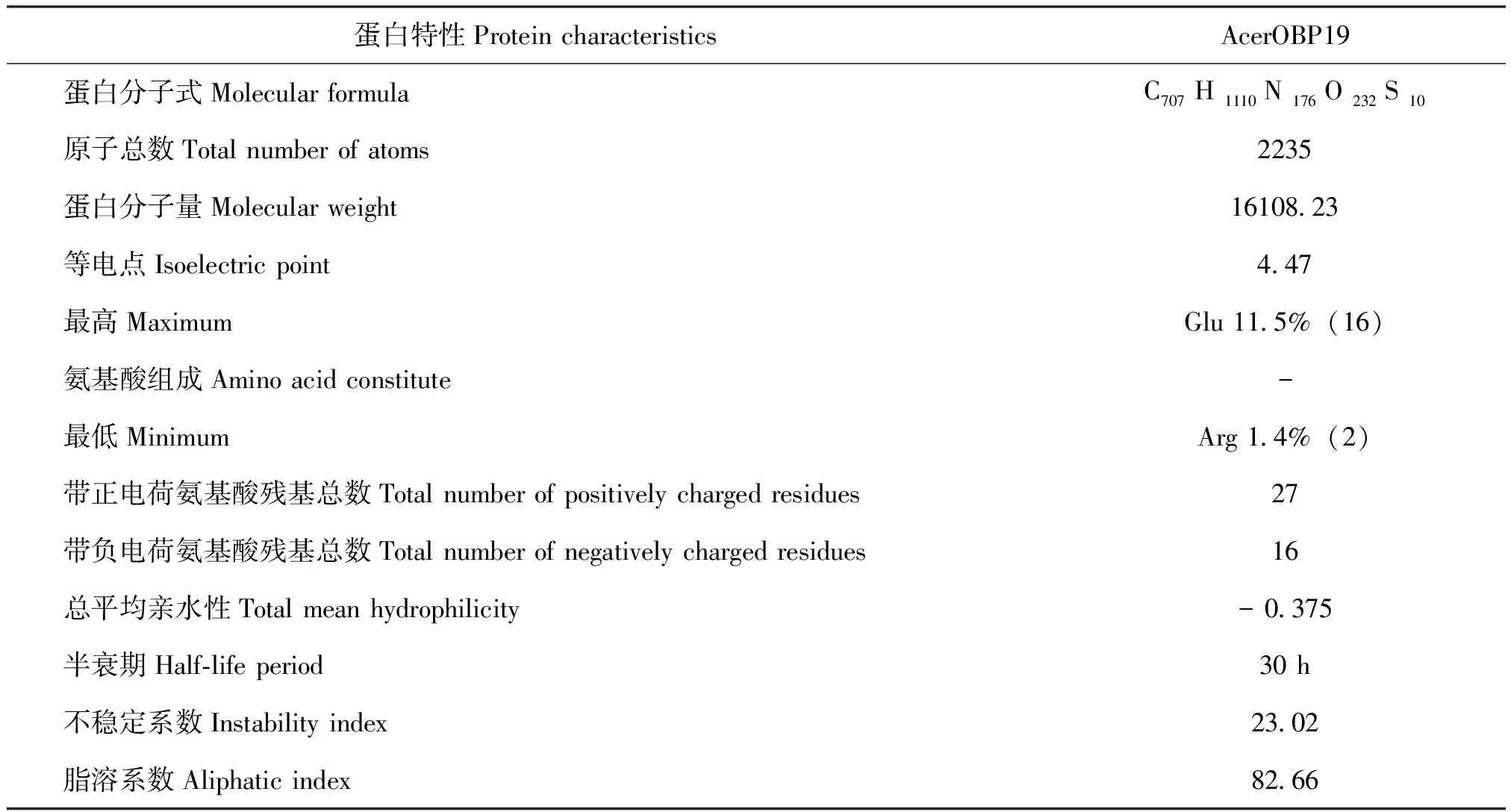
表2 AcerOBP19蛋白的理化性质
2.3.2信号肽预测
信号肽位于分泌蛋白的N端,一般将其作为判断蛋白质是否为分泌蛋白的一个主要依据。将本试验所得到的AcerOBP19的氨基酸序列用SignalP-4.1进行信号肽的预测,结果表明(图3)该蛋白的第1~16位氨基酸为其信号肽序列,其剪切位点在第16和第17位氨基酸之间,故推测AcerOBP19为分泌蛋白。

图3 AcerOBP19信号肽的预测Fig.3 Predicted results for singal peptide in AcerOBP19
2.3.3跨膜结构预测
在TMHMM-2.0软件上对AcerOBP19进行跨膜结构的预测,预测的期望跨膜螺旋数为0,表明该蛋白不是跨膜蛋白(图4)。
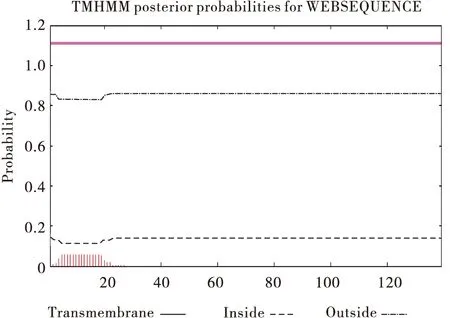
图4 AcerOBP19跨膜结构预测Fig.4 Prediction of transmembrane structure of AcerOBP19
2.3.4保守结构区域与功能结构域的分析
使用NCBI Conserved Domains对AcerOBP19的保守结构域进行分析,它具有PBP-GOBP superfamily家族的保守结构域,其保守结构区域位于第17~130位氨基酸之间,E-value为2.73e-08。AcerOBP19存在一个PhBP功能结构域,位于第132~139位氨基酸之间,E-value为0.00598(图5)。
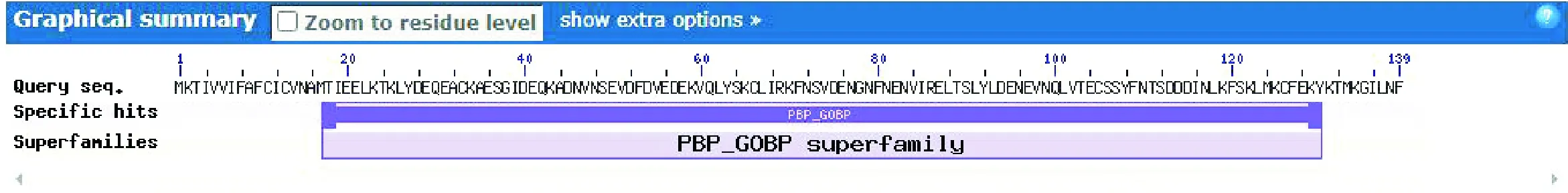
图5 AcerOBP19保守结构域Fig. 5 Functional structure domain of AcerOBP19
2.3.5疏水性分析
AcerOBP19氨基酸序列的疏水性通过Hphob./Kyte & Doolittle方法进行分析(图6),该序列中,最高Score值在第8位氨基酸为3.533,第79位最低为-2.456,总平均亲水性为-0.375。这说明AcerOBP19为亲水性蛋白。
2.3.6亚细胞定位分析
AcerOBP19蛋白亚细胞定位在PSORTⅡ分析,结果表明(表3)该蛋白主要出现在分泌途径上,结合LOCTREE 2.0分析的结果,该蛋白主要分布在胞外区(GO:0005576),说明该蛋白属于分泌型蛋白。

图6 AcerOBP19的氨基酸序列疏水性分析Fig.6 Predicted hydrophobicity profiles for amino acid sequences of AcerOBP19
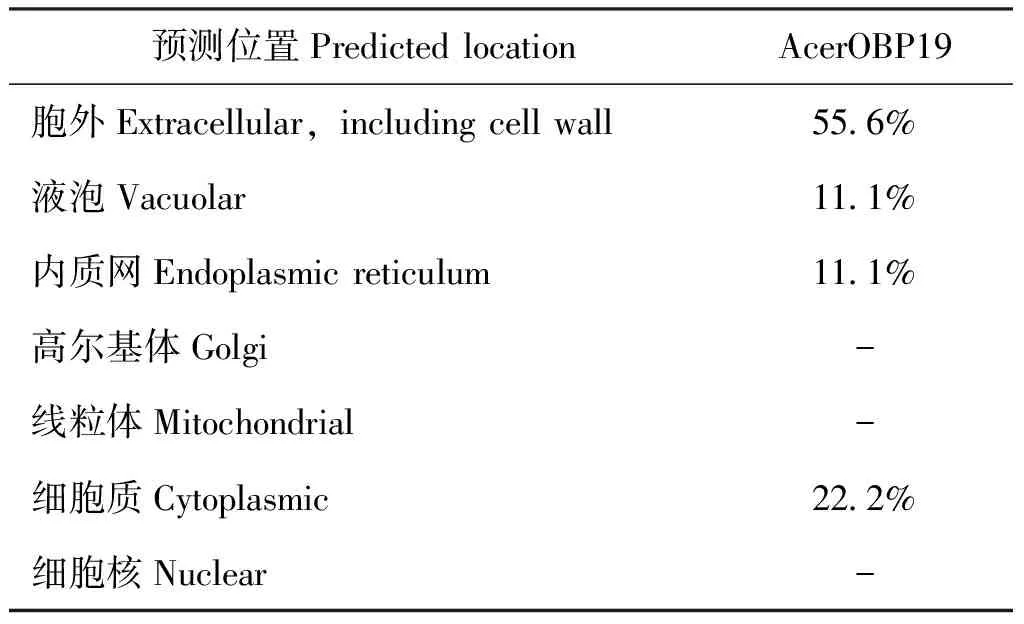
表3 AcerOBP19的亚细胞定位分析
2.3.7高级结构预测
以西方蜜蜂气味结合蛋白ApismelliferaOBP14(PDB登录号:3s0g.1.A)为模板对AcerOBP19进行3D结构的预测(图7),结果表明该蛋白与AmelOBP14的结构相似度达49.58%,含有6个α螺旋和2对二硫键,二硫键分别是Cys33-Cys66和Cys105-Cys126。
2.3.8系统进化树分析
在NCBI数据库中将获得的氨基酸序列进行Blastp分析,选取与AcerOBP19同源性高的昆虫OBPs氨基酸序列在MEGA-X软件上构建系统进化树(图8),采用邻位法Neighborjoining进行1 000次重复。从图中可以看出,AcerOBP19与大蜜蜂ApisdorsataOBPs、小蜜蜂ApisfloreaOBPs和西方蜜蜂ApismeliferaOBPs的氨基酸序列一致性较高,表明它们之间在进化关系上更加同源。

图7 AcerOBP19的3D结构预测模型Fig.7 Three-dimensional prediction structure of AcerOBP19

图8 基于昆虫OBPs与AcerOBP19的氨基酸序列构建的的系统进化树(邻接法)Fig.8 Phylogenetic tree of the amino acid sequences of insect OBPs and AcerOBP19 based on aminoacid sequence with Neighbor-joining method
2.4 AcerOBP19基因mRNA水平表达分析
以15日龄工蜂触角的AcerOBP19基因表达量为基准,通过qRT-PCR技术分析AcerOBP19在中蜂不同时期各组织中mRNA的表达水平,结果发现。AcerOBP19在中蜂不同发育时期的触角、口器、足、毒腺中均有不同程度的表达,在中肠中呈微量表达(图9)。
AcerOBP19在1、5、10、20和25日龄中华蜜蜂足中的表达量极显著高于其它组织(P<0.01),15日龄中华蜜蜂触角中的表达量极显著高于其它组织(P<0.01)。在不同的发育阶段,在足中1日龄时相对表达量最高,5日龄时呈下降趋势,10日龄时又呈上升趋势,15日龄时又下降为最低相对表达量,整体呈先减后增“波浪”式趋势;在口器中1、5和10日龄的相对表达量呈缓慢下降趋势,15日龄时骤增,20日龄和25日龄时又呈下降趋势,整体呈先降,中间增,后又趋于下降模式;在触角中1至5日龄时的相对表达量呈下降趋势,5至15日龄时呈上升趋势,20日龄时呈下降趋势,25日龄时又缓慢上升;在毒腺中相对表达量整体呈先降后升的“波浪”式趋势,10日龄时相对表达量最高,25日龄时最低。

图9 AcerOBP19在中蜂不同发育时期各组织中的相对表达量Fig.9 Expression of AcerOBP19 in different developmental stages and tissues of Apis cerana cerana注:An,触角;P,毒腺;Mo,口器;L,足;Mi,中肠;1 d~25 d:成年工蜂的日龄。不同大写字母表示成蜂相同时期不同组织之间的表达量差异极显著(P<0.01)。Note: An, Antenna; P, Poison gland; Mo, Mouthparts; L, Legs; Mi, Midgut; 1 d~25 d: Days-old of adult worker bees. Different uppercase letters showed extremely significant differences in the expression in different tissues of the same stage (P<0.01).
3 结论与讨论
蜜蜂嗅觉系统及其灵敏,不仅对蜜蜂的各种生物行为发挥作用,还对维持蜂群内部稳定起着重要作用(Carey and Carlson, 2011; Zhaoetal., 2015)。本试验克隆获得了AcerOBP19的完整ORF序列,其长420 bp,编码139个氨基酸,预测分子量介于13~17 kDa,含有4个保守的半胱氨酸位点,属于Mins-C亚家族,与之前研究一致(吴少英等, 2005)。信号肽是位于分泌蛋白的N端,且N端部位具有具有15~35个氨基酸的短肽链,一般将其作为判断蛋白质是否为分泌蛋白的一个主要依据(彭佳师等, 2011)。AcerOBP19蛋白的第1~16位氨基酸为其信号肽序列,其剪切位点在第16和17位氨基酸之间,亚细胞定位也主要在分泌途径上,因此说明AcerOBP19蛋白为分泌型蛋白。进化树结果显示AcerOBP19与大蜜蜂OBPs、小蜜蜂OBPs和西方蜜蜂OBPs的氨基酸序列一致性较高,表明它们之间在进化关系上更加同源,且AcerOBP19具有PBP-GOBP superfamily家族的保守结构域,说明AcerOBP19符合气味结合蛋白家族的特征,可能在嗅觉系统中承担着气味的识别和转运的任务。
昆虫OBPs广泛存在于其各个组织中,这与它复杂的生物学功能密切联系(Hulletal., 2014)。起初有研究表明昆虫OBPs在触角中特异性地表达,如家蚕Bombyxmori的Bmor OBPs、亚洲玉米螟Ostriniafurnacalis的Ofur PBP3、小菜蛾Plutellaxylostella的Pxyl PBP1、水稻二化螟Chilosuppressalis的Csup OBP2(张治科等, 2017)。随后,越来越多的研究发现,一些OBPs也在昆虫的头、胸、腹、足、翅、下颚须、喙、口器、性腺、精囊、气门等其它组织部位中表达(Lietal., 2008; Vogeletal., 2010; Huaetal., 2012; 陈玲等, 2013; 魏丹等, 2013; Zhuetal., 2013; 吉挺等, 2014; 秦赠等, 2014; 宋月芹等, 2014; 赵雪等, 2014)。组织表达谱分析发现,AcerOBP19在中蜂的触角、足、口器、毒腺和中肠中都有表达,这与上述研究相符。昆虫的足上分布着许多与味觉相关的感受器,而气味结合蛋白在味觉器官中高表达,可能与昆虫摄食和营养吸收等功能有关(Sanchez-Graciaetal., 2009)。在本次试验中除15日龄外,AcerOBP19在其它日龄时足中的相对表达量极显著于其它组织,由此可以推测,AcerOBP19除了在中蜂嗅觉调控机制中发挥作用,也与感知蜜粉源植物的非挥发性物质等味觉功能相关联,如在采集花粉花蜜时参与味觉识别过程,与AcerOBP15一致(Duetal., 2021)。在15日龄时,AcerOBP19在触角中的表达量极显著高于其它组织,与杜亚丽等人研究结果相同(Duetal., 2019)。通过比较分析AcerOBP19在触角、足和口器中的相对表达量可知,AcerOBP19在足中的表达量1日龄时达到峰值,远远高于在触角中的表达,这可能是由于作为新生蜂其嗅觉系统尚未完全发育成熟,推测AcerOBP19在味觉器官中的高表达可能与新生蜂在巢中哺育幼虫酿制蜂蜜等味觉及其它功能相联系。AcerOBP19在触角中的表达量在15日龄时达到峰值,此时AcerOBP19在足与口器中的表达量都低于触角,这可能是15日龄为中华蜜蜂从内勤蜂向外勤蜂转变的过渡阶段而发生了改变,详细原因还需进一步论证。AcerOBP19在口器中的表达量在10日龄时达到峰值,众所周知,蜜蜂的味觉器与味觉神经相连,对糖浆等物质的浓度有很高的识别能力,结合在足中的表达模式,对此现象可以做出推测,AcerOBP19基因在糖浆和花蜜浓度的识别过程中有可能发挥了一定的作用,可能参与了中蜂的采集过程。
虽然许多OBPs是化学感觉特异性的,但有些OBPs可能具有更一般的生理作用(Gongetal., 2009)。为了验证在此结果上的推测,本课题组将会继续进行表达纯化其蛋白,通过荧光竞争结合等实验明确该气味结合蛋白的结合谱,在蛋白水平上进一步检测该基因在嗅觉与味觉器官中的表达与定位情况等后续试验。
