棘孢木霉特性及其对两种草坪病原菌的生防作用
2022-06-02董纯辛牛启尘尹淑霞刘若萱古丽米娅艾尼娃唐若怡
董纯辛,崔 艺,牛启尘,尹淑霞,刘若萱,古丽米娅·艾尼娃,唐若怡
(北京林业大学草业与草原学院,北京100083)
草坪是城市绿地的重要组成部分,在城市生态系统中发挥着不可替代的作用。病害管理是草坪养护管理的关键。草坪病害种类繁多,其中褐斑病、币斑病是冷季型草坪高发病害。草坪褐斑病是一种危害极为严重的世界性草坪病害,主要由立枯丝核菌(Rhizoctoniasolani)引起。立枯丝核菌寄主广泛,能侵染所有已知草坪草,传染迅速、发病反复,严重时形成大面积秃斑,极大地破坏草坪景观[1-2]。草坪币斑病由草坪币斑病菌(Clarireediamonteithiana)引起,分布广泛,我国20余省区均有不同程度的币斑病发生和流行的相关报道[3-4]。目前草坪病害防治仍以化学防治为主,杀菌剂的大量使用不仅会引起环境污染,而且容易使病原菌产生抗药性,进而加大病害的防治难度[5]。
木霉(Trichodermaspp.)是重要的植物病害生防真菌,对土传真菌性病害防治效果显著[6],可防治由多种病原微生物引起的植物病害[6-8]。木霉生防途径可大致分为四类,即竞争作用、重寄生作用、诱抗作用和促生作用[9-10]。目前国内外研究主要集中于从农耕土壤中分离得到的木霉及其对作物病害的防治效果[11-12],而关于木霉防治草坪病害的研究鲜有报道,包含草坪在内的草地生态系统中的木霉种质也有待开发。
为探究从草坪根际土壤中分离得到的棘孢木霉(T.asperellum)菌株152-42对草坪褐斑病、币斑病的防治效果,分析木霉对草坪病害病原菌的拮抗特点,本研究以立枯丝核菌和草坪币斑病菌为拮抗材料,通过平板对抗试验和叶片侵染试验,检测棘孢木霉菌株152-42对草坪病害的防治效果,分析其对2种病原菌的拮抗机理。同时,为评价棘孢木霉菌株152-42应用效果的广泛性和稳定性[13],本研究通过平板试验检测棘孢木霉152-42的温度耐受范围和耐盐碱能力,分析其环境适应力,为开发草坪病害木霉生防菌剂提供依据。
1 材料与方法
1.1 供试材料
立枯丝核菌和草坪币斑病菌来自北京林业大学草地保护实验室保存的病原菌样本,其中供试立枯丝核菌分离自草地早熟禾,草坪币斑病菌分离自匍匐翦股颖;棘孢木霉152-42分离自北京林业大学草坪试验基地中草地早熟禾‘午夜’(PoapratensisL. var. ‘Midnight’)草坪的根际土壤;供试植物为草地早熟禾‘优美’(PoapratensisL. var. ‘Euromyth’)和匍匐翦股颖‘Penn-A4’(AgrostisstoloniferaL. var. ‘Penn-A4’);供试培养基为PDA(Potato Dextrose Agar)培养基和PDB(Potato Dextrose Broth)培养液。
木霉孢子悬浮液制备:棘孢木霉152-42于平板上活化5 d后,用无菌水将木霉孢子冲下,制成木霉孢子悬浮液,以血细胞计数法确定其终浓度为1×108CFU·mL-1。
1.2 棘孢木霉152-42的形态特征
将棘孢木霉152-42接种到PDA平板上,25℃培养3 d后,观察菌落形态,并取少量菌丝于光学显微镜下观察其显微结构。
1.3 棘孢木霉对两种病原菌的拮抗作用
1.3.1棘孢木霉对病原菌的空间竞争作用 分别从培养3 d的棘孢木霉和病原菌培养基边缘,取直径为9 mm的菌块,对称接种至PDA培养基两端,以在培养基的一端只接种木霉或只接种病原菌作为对照。每处理重复3次。观察木霉对病原菌的拮抗效果,25℃条件下生长3 d,7 d时分别测量木霉和病原菌的菌落直径,计算抑制率和相对抑菌率。计算公式如下:

1.3.2木霉挥发性物质(volatile substance,VS)的抑菌效果 木霉挥发性物质采用对扣培养法检测[14]。取直径为9 mm木霉菌块接种于PDA培养基中央,于25℃恒温培养3 d。而后铺单层无菌玻璃纸,将培养好的木霉菌完全遮盖。将病原菌菌块接种于另一PDA培养基中央,与接种木霉菌块的培养皿对扣,以只接种病原菌的培养皿和空白培养皿对扣为对照,每处理重复3次。25℃培养3 d后,测量病原菌菌落直径并计算抑制率。
1.3.3木霉非挥发物质(non-volatile substance,NVS)的抑菌效果 木霉非挥发性物质采用圆盘滤膜法检测[14]。在PDA培养基上平铺一张圆形玻璃纸,将木霉菌块置于玻璃纸中央,于25℃培养3 d。去除玻璃纸及木霉菌块,在培养皿中央接入病原菌菌块,以未进行木霉处理的普通PDA培养基为对照,每处理重复3次。25℃培养3 d,测量病原菌菌落直径,并计算抑制率。
1.3.4木霉诱导草坪草抗病性检测 改进自David等的实验方法[15]。分别移栽长势一致的草地早熟禾和匍匐翦股颖于培养箱中,培养条件为白天28℃,夜间23℃,光照强度24 000 lx。培养7 d后,用木霉孢子浓度为1×108CFU·mL-1的悬浮液进行灌根,以蒸馏水灌根为对照,每处理重复3次。木霉灌根诱导10 d后分别以立枯丝核菌侵染草地早熟禾叶片、草坪币斑病菌侵染匍匐翦股颖叶片。具体做法是:选取叶龄一致的新鲜离体叶片10片,表面消毒后放在滤纸上。用直径6 mm的打孔器取培养3 d的病原菌菌块,接于叶片中央。白天30℃,夜晚25℃,侵染48 h,观察病斑面积,计算发病面积占叶片总面积的百分比。叶部病害分级标准参考许天委等的分类方法[16]。

1.4 棘孢木霉152-42的环境适应性
参考王强强等对拮抗性木霉菌株抗逆性筛选评价的标准与方法[17]。取直径9 mm的棘孢木霉菌块移至PDA培养基上,设置15℃,20℃,25℃,30℃,35℃,40℃和45℃共7个温度梯度;设5,6,7,8,9,10,11,12和13共9个pH梯度;设50 g·L-1,100 g·L-1,150 g·L-1和200 g·L-14个NaCl浓度梯度,共计20种处理,每个处理重复3次,培养3 d后测量菌落直径。
1.5 数据分析
利用Excel 2016进行数据处理和作图,采用SPSS 19.0 软件中的单因素方差分析检验不同处理下木霉对两种草坪病原菌的生长抑制率、病原菌侵染叶片病情指数,采用Duncan模型分析比较不同处理间差异显著性(P<0.05)。
2 结果与分析
2.1 木霉形态特征
棘孢木霉152-42菌落呈深绿色,毛发状(图1A)。分生孢子梗细长弯曲,形成垫状,分生孢子大小平均为2.50 μm×1.90 μm,浅绿色,椭圆形或倒卵形,有细微的棘状突起(图1B)。
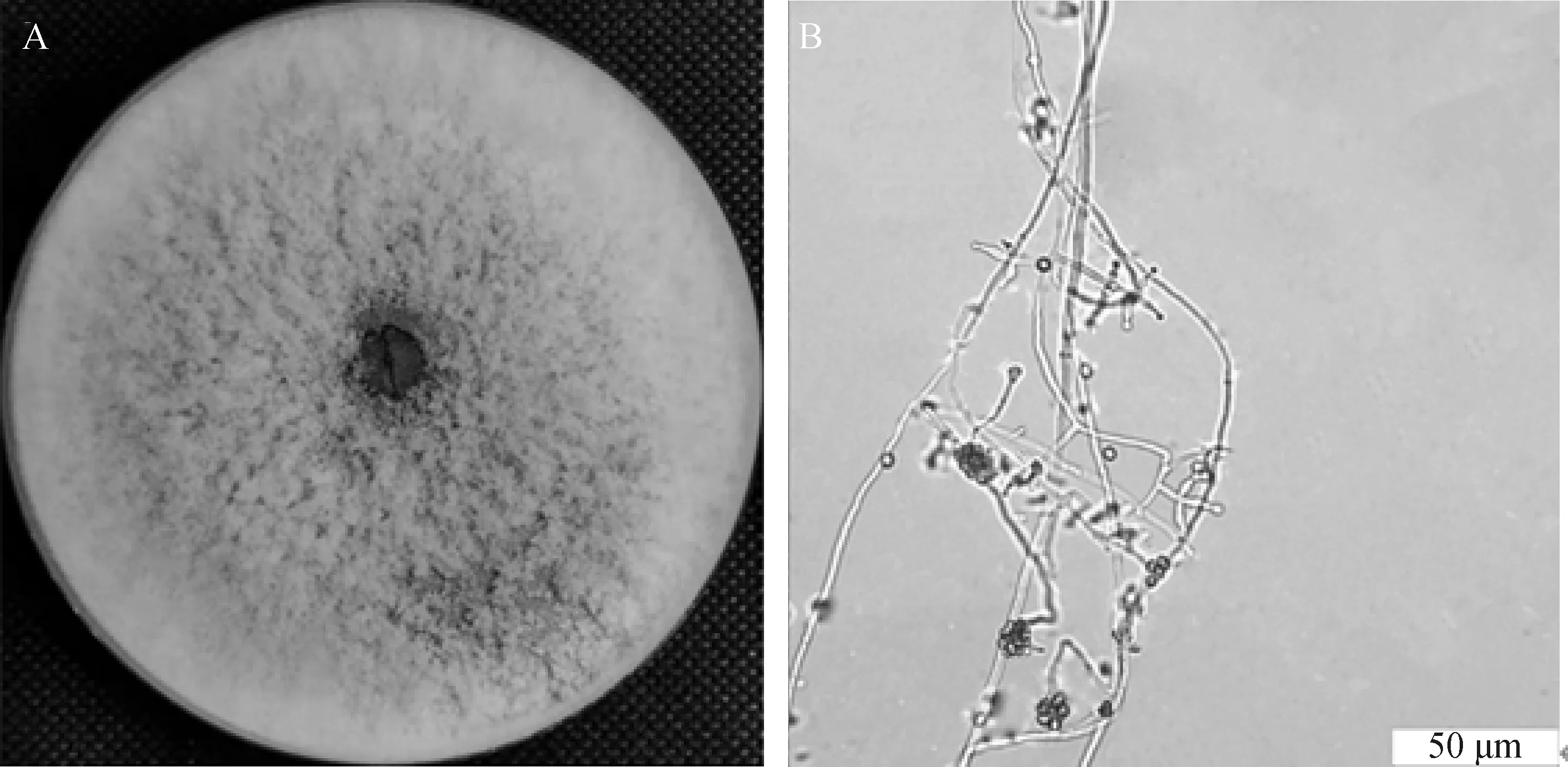
图1 棘孢木霉152-42形态Fig.1 Morphology of Trichoderma asperellum 152-42注:图A为PDA上菌落形态;图B为光学显微镜照片Note:Figure A,Colony morphology on PDA;Figure B,Morphology under light microscope
2.2 环境适应性
2.2.1高温胁迫 如表1和图2所示,棘孢木霉152-42在15~45℃范围内均可生长,但最适生长温度为25~35℃,在此范围内木霉菌株生长速度快,3 d内可将培养基完全覆盖。15℃时,木霉生长受到抑制,3 d内只能覆盖培养基的一半。40℃和45℃时木霉仍能存活,但在培养基上只观察到少量菌丝生长。
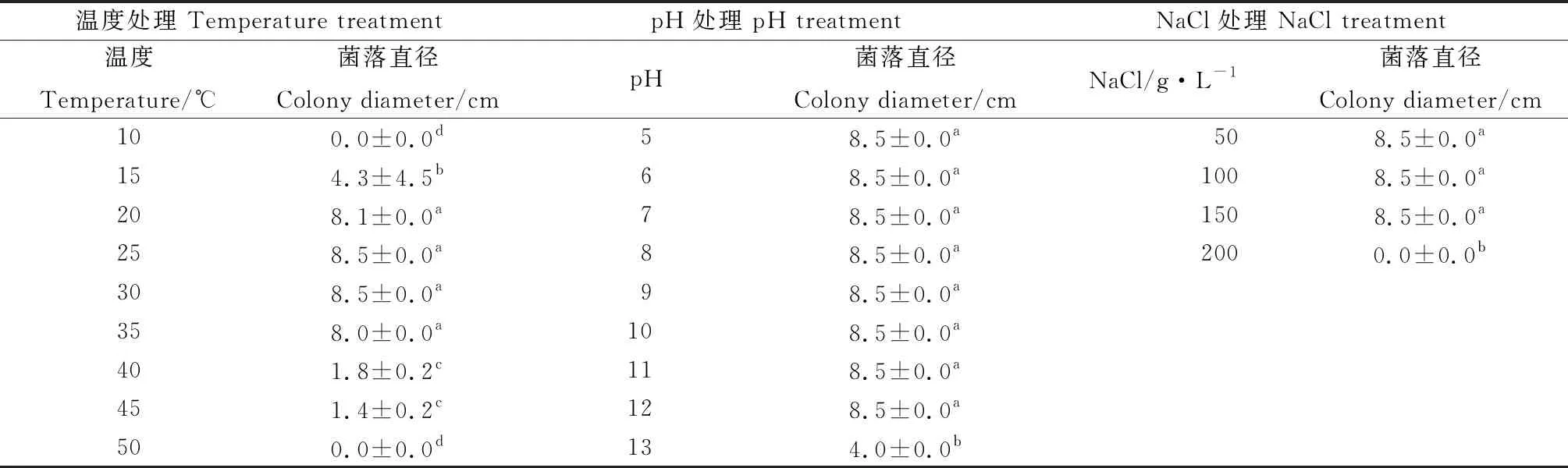
表1 木霉在不同温度、pH、NaCl浓度下培养3 d的生长状况Table 1 Growth of Trichoderma cultured at different temperatures,pH,NaCl concentrations for 3 days

图2 棘孢木霉152-42在不同温度下培养3 d的生长状况Fig.2 Growth of Trichoderma asperellum 152-42 cultured at different temperatures for 3 days注:图A~G分别为棘孢木霉152-42在15℃,20℃,25℃,30℃,35℃,40℃,45℃温度下培养3 d的生长状况Note:Figure A~G,Growth status of Trichoderma asperellum 152-42 cultured at 15℃,20℃,25℃,30℃,35℃,40℃,45℃ for 3 days
2.2.2碱胁迫 由表1和图3可知,棘孢木霉152-42在pH为5~12条件下菌丝生长迅速,3 d内长满培养皿。在pH为13时其菌丝生长受到明显抑制,在pH为14的培养基上无法生长。
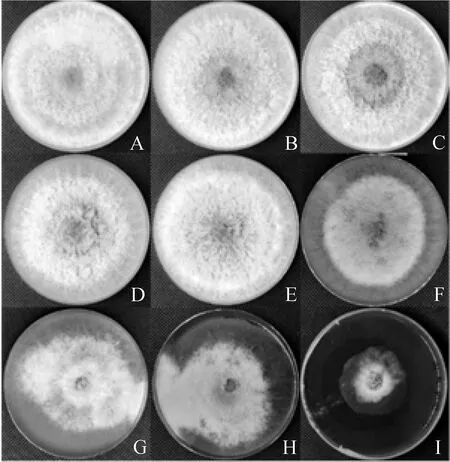
图3 棘孢木霉152-42在不同pH培养基中培养3 d的生长状况Fig.3 Growth of Trichoderma asperellum 152-42 cultured at different pH values for 3 days注:图A~I为棘孢木霉152-42在pH分别为5,6,7,8,9,10,11,12,13时培养3 d的生长状况Note:Figure A~I,Growth of Trichoderma asperellum 152-42 cultured for 3 days under pH=5,6,7,8,9,10,11,12,13
2.2.3盐胁迫 由表1及图4可以看出,棘孢木霉152-42在NaCl浓度为50 g·L-1,100 g·L-1,150 g·L-1条件下均可正常生长,在3 d内长满培养皿,菌落颜色亦正常。在NaCl浓度为200 g·L-1时木霉不能生长。
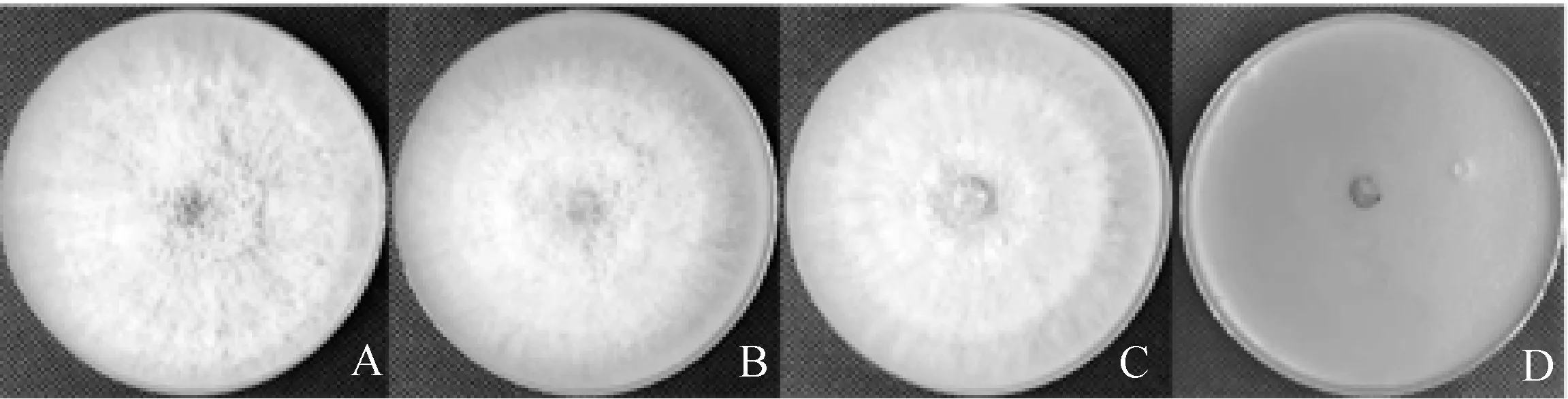
图4 棘孢木霉152-42在不同NaCl浓度下培养3 d的生长状况Fig.4 Growth of Trichoderma asperellum 152-42 cultured at different NaCl concentrations for 3 days注:图A~D分别为棘孢木霉152-42在NaCl浓度为50 g·L-1,100 g·L-1,150 g·L-1,200 g·L-1下培养3 d的生长状况Note:A~D,Growth of Trichoderma asperellum 152-42 cultured at NaCl concentrations of 50 g·L-1,100 g·L-1,150 g·L-1 and 200 g·L-1 for 3 days
2.3 木霉对病原菌的拮抗作用分析
木霉分别与立枯丝核菌和草坪币斑病原进行拮抗共培养3 d,木霉对病原菌的生长抑制情况如表2和图5所示。
由图5B和图5C可以看出,对峙培养3 d,棘孢木霉对两种病原菌均有明显的抑制效果,其中立枯丝核菌菌丝发黄萎缩,抑制率达到56.67%;币斑病菌菌落边缘轻微发黄,但菌丝没有大面积萎缩,抑制率为41.98%。相比较而言,对峙培养的棘孢木霉152-42对立枯丝核菌的抑制率显著高于其对币斑病菌的抑制率(P<0.05)。
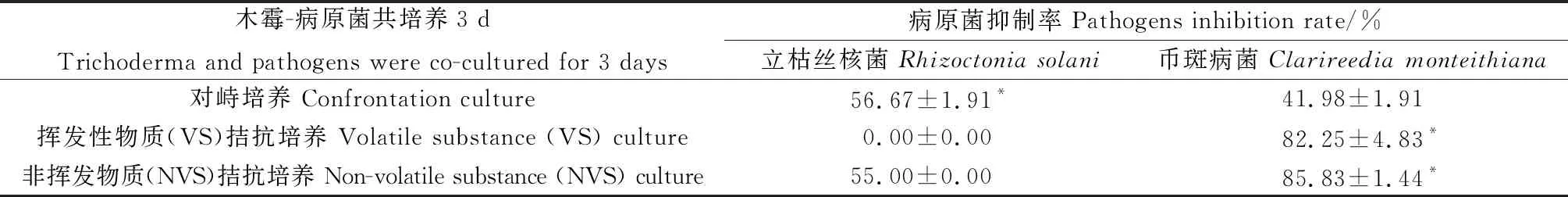
表2 棘孢木霉对两种草坪病原菌的生长抑制率Table 2 Growth inhibition rates of Trichoderma asperellum 152-42 to two pathogens

图5 棘孢木霉152-42与两种病原菌共培养3 d的拮抗作用Fig.5 Antagonism of Trichoderma asperellum 152-42 on 2 pathogens post 3 days co-culture注:A,棘孢木霉152-42对照;B-C,棘孢木霉152-42与立枯丝核菌、币斑病菌对峙培养;D,立枯丝核菌对照;E-F,棘孢木霉152-42挥发性代谢物对立枯丝核菌、币斑病菌的拮抗作用;G,币斑病菌对照;H-I,棘孢木霉152-42非挥发性代谢物对立枯丝核菌、币斑病菌的拮抗作用Note:A,Trichoderma asperellum 152-42 control;B-C,Trichoderma asperellum 152-42 was cultured in confrontation with Rhizoctonia solani and Clarireedia monteithiana;D,Rhizoctonia solani control;E-F,Antagonism of volatile substance from Trichoderma asperellum 152-42 on Rhizoctonia solani and Clarireedia monteithiana;G,Clarireedia monteithiana control;H-I,Antagonism of non-volatile substance of Trichoderma asperellum 152-42 against Rhizoctonia solani and Clarireedia monteithiana
VS培养3 d,立枯丝核菌生长正常,几乎没有受到棘孢木霉挥发性代谢物的影响(图5E);但币斑病菌的生长受到明显抑制,抑制率达到82.25%,币斑病菌菌落直径仅为1.5 mm(图5F)。可见,棘孢木霉152-42的挥发性代谢物可有效抑制币斑病菌的生长,但对立枯丝核菌几乎无效。
NVS培养3 d,棘孢木霉的非挥发性代谢物对立枯丝核菌具有明显的抑制作用(图5H),平板上仅有少量菌丝生长,且菌丝发黄,抑制率达到55.00%,与对峙培养的抑制率相近。同时,棘孢木霉的非挥发性代谢物对币斑病菌亦有明显的抑制效果(图5I),抑制率达到85.83%,是对峙培养时抑制率的2倍。相比较而言,NVS培养的棘孢木霉152-42对币斑病菌的抑制率显著高于其对立枯丝核菌的抑制率(P<0.05)。
木霉与两种病原菌对峙培养7 d,木霉将立枯丝核菌的菌丝完全覆盖,已无法观察到立枯丝核菌(图6B);木霉也覆盖了币斑病菌的大部分菌丝,仅余币斑病菌初期生长的菌丝(图6D)。
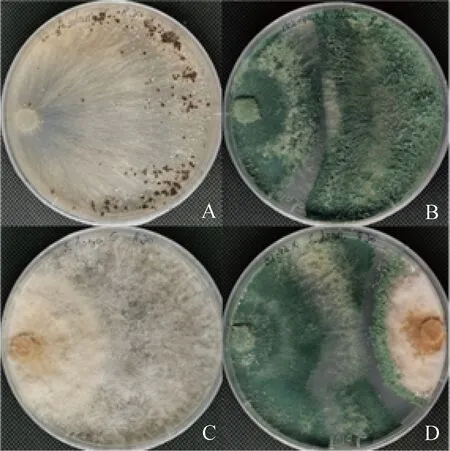
图6 棘孢木霉152-42与病原菌对峙共培养7 dFig.6 Trichoderma asperellum 152-42 was cultured in confrontation with the pathogen for 7 days注:A,立枯丝核菌对照;B,棘孢木霉152-42与立枯丝核菌对峙培养;C,币斑病菌对照;D,棘孢木霉152-42与币斑病菌对峙培养Note:A,control of Rhizoctonia solani;B,Trichoderma asperellum 152-42 was cultured in confrontation with Rhizoctonia solani;C,control of Clarireedia monteithiana;D,Trichoderma asperellum 152-42 was cultured in confrontation with Clarireedia monteithiana
2.4 木霉诱导草坪草抗病性检测
由图7可知,棘孢木霉152-42灌根诱导后的草地早熟禾叶片在立枯丝核菌侵染后48 h,褐斑病病情指数为51.3,显著低于对照(P<0.05);相应地,币斑病菌侵染后48 h,经木霉诱导的匍匐翦股颖叶片币斑病病情指数为54.6,亦显著低于对照叶片(P<0.05)。
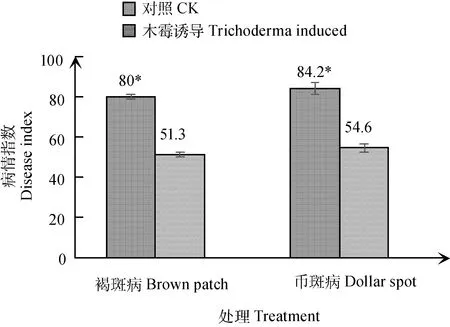
图7 病原菌侵染48 h叶片病情指数Fig.7 Disease index of leaves post pathogens infection 48 h注:图中*表示该处理下叶片病情指数显著高于另一组(P<0.05)Note:* indicates significant differences between two treatments at the 0.05 level
从图8也可以看出,病原菌侵染叶片后48 h,与对照叶片相比,经木霉诱导的叶片,其病斑面积小,发病程度轻。

图8 病原菌侵染48 h叶片发病情况Fig.8 Leaf lesions post pathogens infection 48 h注:A,立枯丝核菌侵染草地早熟禾对照叶片,B,立枯丝核菌侵染经棘孢木霉152-42诱导的草地早熟禾叶片;C,币斑病菌侵染匍匐翦股颖对照叶片;D,币斑病菌侵染经棘孢木霉152-42诱导的匍匐翦股颖叶片Note:A,Control leaf of Kentucky bluegrass were infected by Rhizoctonia solani; B,Kentucky bluegrass leaf induced by T. asperellum 152-42 were infected by Rhizoctonia solani;C,Control leaf of Creeping bentgrass were infected by Clarireedia monteithiana;D,Creeping bentgrass leaf induced by T. asperellum 152-42 were infected by Clarireedia monteithiana
3 讨论
3.1 棘孢木霉152-42的生防途径
棘孢木霉152-42在与两组病原菌和病原寄主草坪草的互作过程中,表现出对病原菌生长强烈的抑制作用,并诱导草坪草对病原菌侵染产生抗性。
分泌拮抗代谢物是棘孢木霉拮抗病原菌的重要方式。Oszako研究认为棘孢木霉能抑制栎树白粉病的发生,这得益于其多种拮抗代谢物的分泌[18]。陶玲芸等认为拮抗代谢物的分泌是棘孢木霉拮抗尖孢镰刀菌(Fusariumoxysporum)的重要途径[19]。本研究中棘孢木霉152-42代谢产生的挥发性次生代谢物和非挥发性次生代谢物均强烈抑制了草坪币斑病菌的生长,但对立枯丝核菌的抑制作用相对较弱,特别是棘孢木霉152-42挥发性次生代谢物对立枯丝核菌几乎没有抑制作用,说明棘孢木霉152-42代谢物对病原菌的拮抗作用效果在不同病原菌之间存在差异。
木霉拮抗代谢物种类繁多,Stracquadanio等分析了液体发酵条件下木霉的拮抗代谢物种类,研究表明供试的棘孢木霉可产生7类挥发性有机物和12种非挥发性有机物分子,而每种代谢物的拮抗作用机理不尽相同[20]。本文中棘孢木霉152-42的拮抗代谢物种类及对不同病原菌的拮抗作用机理有待进一步分析。
木霉与病原菌对峙共培养7 d的结果表明,棘孢木霉对立枯丝核菌有强烈的拮抗作用,共培养7 d后立枯丝核菌的菌丝全部被木霉覆盖,抑制率达到100%,但NVS培养试验结果表明棘孢木霉152-42的代谢物对立枯丝核菌的抑制率显著低于其对币斑病菌的抑制率,这表明供试木霉可能通过其他拮抗途径,如空间竞争、重寄生等在对峙培养过程中对立枯丝核菌发挥作用[21]。
木霉可增强植物的抗病性,诱导植物产生系统性抗性[22]。Meyer等研究表明,在植物的叶部接种木霉,植物不同空间位置对病原菌抗性都得到了提高,表明木霉诱导植物产生了对病原真菌的系统性抗性[23]。本试验中,草地早熟禾和匍匐翦股颖经棘孢木霉152-42灌根诱导后,与未经木霉诱导的对照叶片相比,叶片上褐斑病和币斑病的病情严重指数均明显减轻,诱导位点在草坪草根部,但叶片表现出了病原菌抗性,说明该木霉诱导草坪草产生了系统性抗性。
3.2 棘孢木霉152-42的环境适应性
棘孢木霉152-42具有耐高温、耐高盐碱的特性。
夏季是冷季型草坪受病害影响最为严重的时期,常见如弯孢霉叶斑病(Curvularialeaf spot)、镰刀菌枯萎病(Fusariumdisease)、褐斑病(Brown patch)、腐霉枯萎病(Pythiumdisease)、夏季斑枯病(Summer patch)[24]。棘孢木霉152-42能够耐一定程度的高温胁迫,在35℃下仍可以正常生长,即能在夏季草坪土壤中正常生长,因此可以认为棘孢木霉152-42具有用于草坪的夏季病害管理的潜力。
棘孢木霉152-42在pH为5~12可正常生长,参照郑柯斌等的抗逆筛选评价标准[25],该木霉耐高碱。尹大川等研究NaCl胁迫下哈茨木霉(Trichodermaharzianum)生长情况时发现,在NaCl浓度为50 g·L-1时其生长明显受到抑制[26],而本研究中的棘孢木霉152-42在NaCl浓度为150 g·L-1时仍可正常生长,与在正常盐度下的生长速度无显著差异,说明其具有更强的耐盐性。棘孢木霉152-42耐高盐碱的特性使得其可以防治盐碱地草坪的病害。
3.3 草地生态系统中木霉种质资源的潜在价值
草地是地球表面覆盖较广的主要生态系统之一,蕴含的大量生态服务功能及价值有待开发和评估[27]。Dou等对中国多种生态系统中的木霉多样性进行评估,发现在农作物土壤中的木霉丰度最高,草地生态系统中分离得到的木霉种类和数量最低,但有两种木霉只在草地生态系统中分离得到,这表明草地生态系统具有其特殊性[28]。Ma等对新疆地区的草地和森林生态系统中的木霉分布进行了评价分析,试验表明木霉更适宜在森林生态系统中存活,森林生态系统中木霉丰度显著高于草地生态系统,但部分种类木霉,如钩状木霉、短密木霉等只能从草地生态系统中分离得到[29]。草坪属于农业管理条件下的草地生态系统,棘孢木霉152-42表现出极强的耐盐碱能力,这与其独特的生境密不可分。包括草坪在内的草地生态系统中的微生物资源还有待进一步研究开发。
4 结论
来源于草坪草根际土壤的棘孢木霉152-42环境适应范围广,可耐35℃高温,在NaCl浓度为150 g·L-1、pH为5~12可正常生长,可通过空间竞争、分泌拮抗代谢物等途径显著抑制立枯丝核菌、币斑病菌生长。以棘孢木霉152-42灌根诱导草坪草后,可明显降低褐斑病和币斑病的病情严重程度,因此具有开发为草坪病害生防菌剂的良好潜力。以棘孢木霉152-42为代表的草地生态系统中的有益微生物亟待进一步研究、开发与应用。
