七氟烷后处理对原代海马神经元氧糖剥夺/复氧损伤及自噬的影响
2022-06-02王佳楠黄春霞胡宪文
王佳楠,黄春霞,胡宪文
在临床上,急性缺血性脑病的发病率、致残率、病死率很高。脑缺血可导致神经细胞损伤甚至死亡,造成不可逆的损伤[1]。临床治疗脑缺血的有效方法是尽快恢复血液灌注。再灌注后缺血区组织血供恢复但组织损伤加重的现象被称为脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)[2]。有研究[3]报道,在脑组织特别是海马中氧与三磷酸腺苷储存较少,海马神经元对线粒体功能障碍和线粒体活性氧增加敏感,对能量缺乏的耐受性较差,海马神经细胞极易因缺血再灌注受损。CIRI的发病机制复杂,其机制涉及线粒体功能障碍、自噬、自由基损伤、钙超载、炎症损伤、神经细胞凋亡。自噬是一种细胞自降解过程,能够降解和回收胞内组分,被证实与许多疾病的发生和发展有关,包括神经退行性疾病、癌症、自身免疫性疾病。
七氟烷是一种临床上广泛应用的吸入性麻醉药,既往研究[4]表明,七氟烷后处理对CIRI有神经保护作用,可以减少脑梗死面积。本课题组前期研究[5]表明七氟烷后处理可通过增加抗凋亡蛋白Bcl-2的表达,降低促凋亡蛋白Bax、细胞色素C、含半胱氨酸的天冬氨酸蛋白水解酶3(caspase-3)的表达,减少海马神经元丢失,从而抑制细胞凋亡,对大鼠有神经保护作用。但七氟烷后处理对脑自噬的影响还不清楚。故拟研究七氟烷后处理对原代海
马神经元氧糖剥夺/复氧(oxygen - glucose deprivation / reoxygenation, OGD/R)后损伤凋亡,线粒体氧化应激及自噬的影响,探讨七氟烷后处理脑保护作用的相关分子机制,为临床治疗CIRI提供新的参考依据。
1 材料与方法
1.1 材料
1.1.1实验动物 健康成年SPF级雄鼠和雌鼠由安徽医科大学实验动物中心提供,动物使用许可证号:SYXK(皖)2017-006。
1.1.2主要试剂 胎牛血清(货号:S711-001S)购自上海Lonsera 公司;DMEM-12细胞培养液(货号:11330500BT)、Neurobasal Medium(货号:21103-049)、 0.25%胰蛋白酶(货号:25200056)、GlutaMAX (货号:35050-061)、B27 (货号:17504-044)、青链霉素 (货号:15140122)均购自美国Gibco公司;5-氟-2′-脱氧尿嘧啶核苷(货号:F0503)、多聚赖氨酸 (货号:P1399)均购自美国Sigma公司;Parkin抗体(货号:2132S)、 微管相关蛋白1轻链3B(Microtubule-associated protein 1 light chain 3B, LC3B)抗体(货号:3868S) 、活化的半胱氨酸蛋白酶3 (cleaved caspase-3)抗体(货号:9661S)均购自美国Cell Signaling Technology 公司;丝氨酸/苏氨酸激酶(PTEN induced putative kinase 1, PINK1)抗体(货号:sc-517353)购自美国Santa Cruz Blotechnology公司;线粒体超氧化物指示剂(MitoSOX,货号:M36008)购自美国 invitrogen公司 ;BCA蛋白浓度测定试剂盒(货号: P0012)、 RIPA裂解液(货号:P0013K)均购自上海碧云天生物技术有限公司;七氟烷(货号: 83291)购自美国艾伯维公司;原位末端标记法(TdT-mediated dUTP nick end labeling, TUNEL)凋亡检测试剂盒(货号: 12156792910)购自美国Roche公司;ECL显影液(货号:32109)购自美国Thermo公司; 乳酸脱氢酶(lactate dehydrogenase, LDH)测定试剂盒(货号:A020)购自南京建成生物工程研究所。
1.1.3主要仪器 缺氧小室(加拿大Stem Cell公司);七氟烷蒸发罐(德国Drager公司);荧光显微镜(日本Olympus 公司);Tanon Fine Do X6 全自动化学发光图像分析系统(上海 Tannon 公司);Tecan M 1000 酶标仪(德国 Tecan 公司);37 ℃、5%CO2培养箱(美国Sigma 公司)。
1.2 方法
1.2.1原代海马神经元细胞提取及培养 雌雄大鼠交配,以雌性大鼠出现阴道栓日计算胎龄,提取自孕鼠子宫内胎龄(18±0.5)d胎鼠海马组织。根据文献方法[6],用75%乙醇消毒器械及孕鼠腹部,“V”字形剪开腹部,取出胚胎,断头取脑,放入预冷的无菌平衡盐溶液中,显微镜下分离海马组织,0.25% 胰蛋白酶消化10 min左右,加入培养基(90% DMEM-F12+10%胎牛血清 )终止消化5 min,3 000 r/min、离心5 min,弃上清液后,加入培养基(88% DMEM-F12+1%青链霉素+1% Glutamax+10%胎牛血清),制成细胞悬液,种植于多聚赖氨酸包被的玻片中,放入37 ℃细胞培养箱中进行培养。24 h后培养基全部换成细胞维持液(96% Neurobasal Medium+2% B27+1% Glutamax+1%青链霉素),再加入5-氟-2′-脱氧尿嘧啶核苷(40 μmol/L)抑制胶质细胞生长。每3 d更换培养液的1/3。培养至第7 天,神经元已经基本上发育成熟。
1.2.2建立细胞OGD/R损伤模型 参照文献方法[7],将原代海马神经元细胞正常培养时的完全培养基换为无血清无糖的平衡液(139 mmol/L NaCl、4.7 mmol/L KCl、0.5 mmol/L MgCl2、1.0 mmol/L CaCl2、5 mmol/L HEPES,pH 7.4),细胞置于缺氧小室中,通入95% N2+5% CO2气体10 min 以驱除小室内的氧气,随后将缺氧小室放入 37 ℃培养箱中培养1.5 h 进行氧糖剥夺处理,然后用完全培养基正常培养来进行复氧复糖。
1.2.3实验分组及处理 原代海马神经元培养已经基本发育成熟,对能量缺乏敏感。将细胞随机分为3组: 对照组(CON组),原代海马神经元细胞置于培养液中常规培养;氧糖剥夺/复氧组(OGD/R组),将原代海马神经元细胞进行1.5 h氧糖剥夺和24 h复氧复糖处理;七氟烷后处理组(OGD/R+SEVO组),原代海马神经元细胞进行氧糖剥夺处理后,缺氧小室内预充浓度2.4%七氟烷6 min,然后密闭缺氧小室培养1 h ,后置于37 ℃, 培养箱继续培养23 h。
1.2.4检测细胞LDH活性 完成以上分组及处理后,每组各取40 μl细胞培养上清液,严格按照LDH试剂盒说明书操作,利用酶标仪于波长450 nm处测定各孔吸光度值,然后根据公式计算各组培养液中LDH活性,以反映神经元的损伤程度。
1.2.5MitoSOX染色 培养细胞经处理后用磷酸盐缓冲液(phosphate buffer saline, PBS)洗涤,在培养皿中加入MitoSOX与培养基混合物,37 ℃ 黑暗条件下孵育20 min。用PBS洗涤2次,将爬片捞出,用抗淬灭剂封片后固定至载玻片,用荧光倒置显微镜获得图像,统计荧光强度,以其反映线粒体活性氧水平。
1.2.6TUNEL染色 用PBS洗涤两次爬片,在样品上加入50 μl TUNEL反应混合物。为了确保TUNEL反应混合物在细胞单层间均匀扩散,并避免蒸发损失,样品在孵化过程中应覆盖副膜。在37 ℃黑暗条件下,在加湿气氛中孵育60 min。用PBS洗涤玻片3次。采用共聚焦显微镜获得图像。
1.2.7免疫荧光 处理结束后的细胞用PBS冲洗,使用4%多聚甲醛固定细胞形态10 min,使用含有0.1%Triton X-100和1%牛血清白蛋白的PBS溶液通透并封闭细胞120 min,4 ℃过夜孵育一抗:兔抗LC3B (1 ∶200)。细胞在室温下与相应的二抗孵育2 h。PBS洗涤后,用含细胞核标记物(DAPI)的抗淬灭剂封片后,指甲油将爬片固定至载玻片,采用共聚焦显微镜获得图像。
1.2.8Western blot 取处理结束后的原代海马神经元加入RIPA裂解液充分反应30 min,13 200 r/min离心30 min后取上清液,检测各组细胞蛋白浓度,加入上样缓冲液,100 ℃煮10 min。 蛋白样品用SDS-PAGE电泳分离,转膜,室温下用5%脱脂牛奶封闭2 h, 含Tris缓冲液(TBST)洗涤2次,加一抗4 ℃孵育过夜,TBST洗涤3次,加二抗室温孵育1 h,TBST洗涤3次后用ECL化学发光法检测蛋白表达,采用Image J软件计算目的蛋白与内参灰度值。
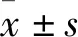
2 结果
2.1 七氟烷后处理对原代海马神经元LDH释放的影响与CON组相比,OGD/R组原代海马神经元培养液中LDH活性增加(F=23.12,P<0.01);与OGD/R组相比,OGD/R+SEVO组LDH活性降低(F=15.30,P<0.05)。见图1。
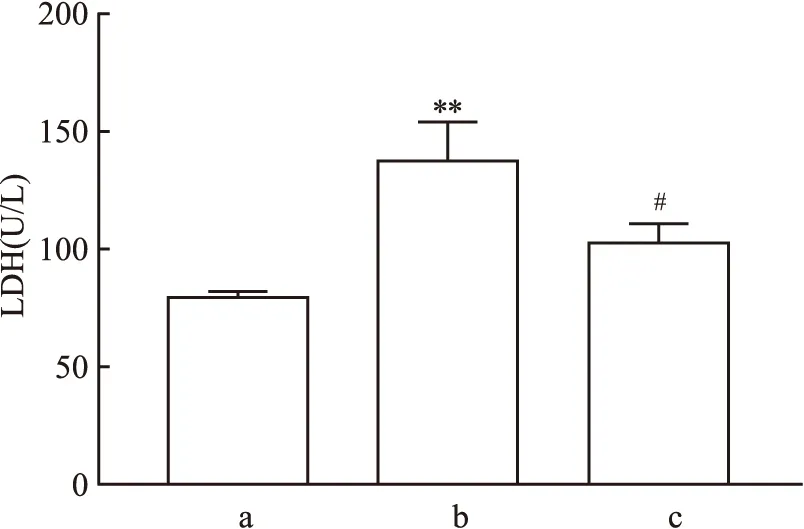
图1 七氟烷后处理对原代海马神经元LDH释放的影响a: CON组; b: OGD/R组; c: OGD/R+SEVO组; 与CON组比较:**P<0.01;与OGD/R组比较:#P<0.05
2.2 七氟烷后处理对原代海马神经元氧化应激的影响与CON组相比,OGD/R组线粒体活性氧增多(F=24.41,P<0.01);与 OGD/R组相比,OGD/R+SEVO组线粒体活性氧减少(F=17.38,P<0.05)。见图2。
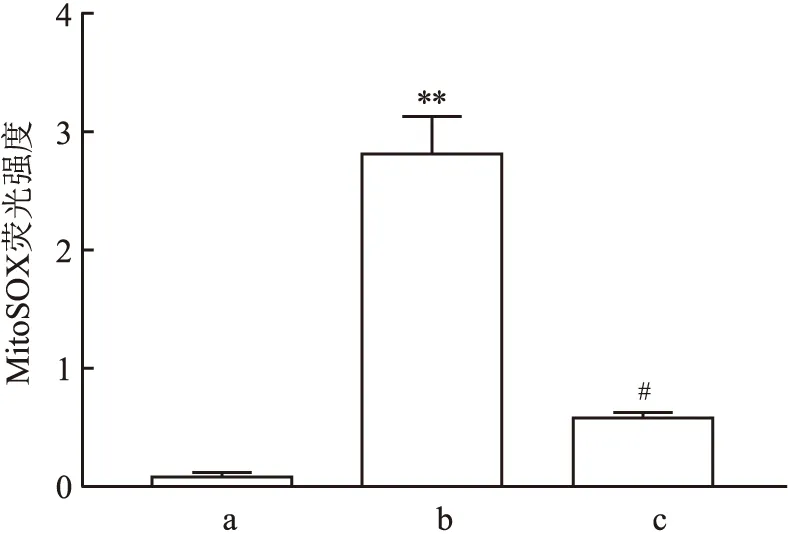
图2 七氟烷后处理对原代海马神经元线粒体活性氧的影响a: CON组; b: OGD/R组; c: OGD/R+SEVO组;与CON组比较:**P<0.01;与OGD/R组比较:#P<0.05
2.3 七氟烷后处理对原代海马神经元细胞凋亡的影响与CON组相比,OGD/R组TUNEL阳性细胞数量和cleaved caspase-3表达量增多;与 OGD/R组相比,OGD/R+SEVO组TUNEL阳性细胞数量和cleaved caspase-3表达量减少。见图3。
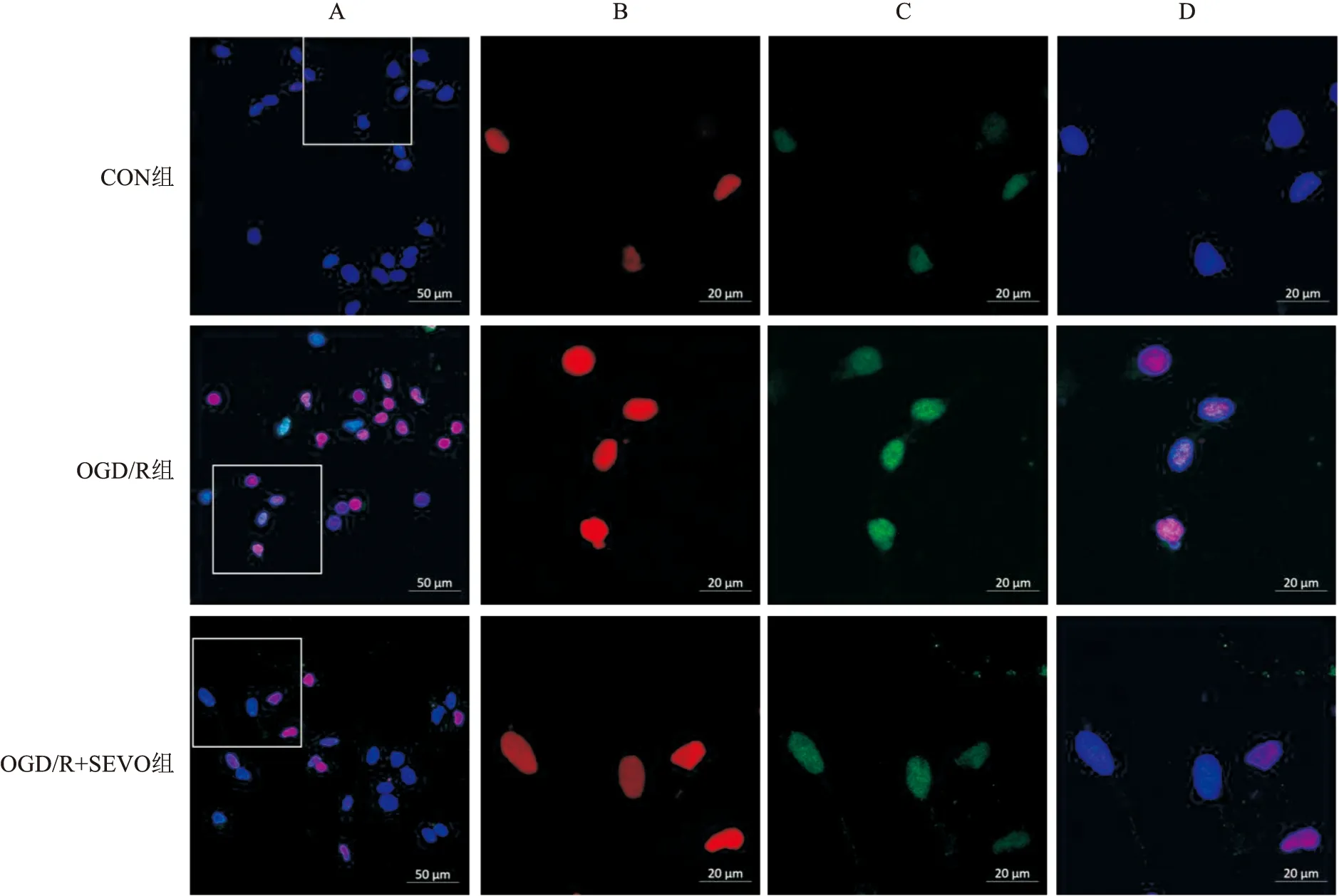
图3 TUNEL法检测七氟烷后处理对原代海马神经元凋亡的影响A:Merge ×200;B:TUNEL ×600;C:cleaved caspase-3 ×600;D:Merge ×600
2.4 七氟烷后处理对原代海马神经元细胞自噬的影响采用免疫荧光染色检测原代海马神经元细胞LC3B的表达水平。LC3B蛋白荧光染色结果如图4所示,与CON组相比,OGD/R组LC3B蛋白的表达增多(F=6.97,P<0.01);与OGD/R组相比,OGD/R+SEVO组LC3B蛋白减少(F=4.74,P<0.05)。用Western blot检测细胞PINK1和Parkin蛋白表达,结果如图 5所示,与CON组相比,OGD/R 组PINK1的表达增多(F=19.30,P<0.001),Parkin的表达增多(F=5.26,P<0.05);与OGD/R 组相比,OGD/R+SEVO组PINK1的表达减少(F=14.80,P<0.01),Parkin 的表达也降低(F=5.65,P<0.05)。
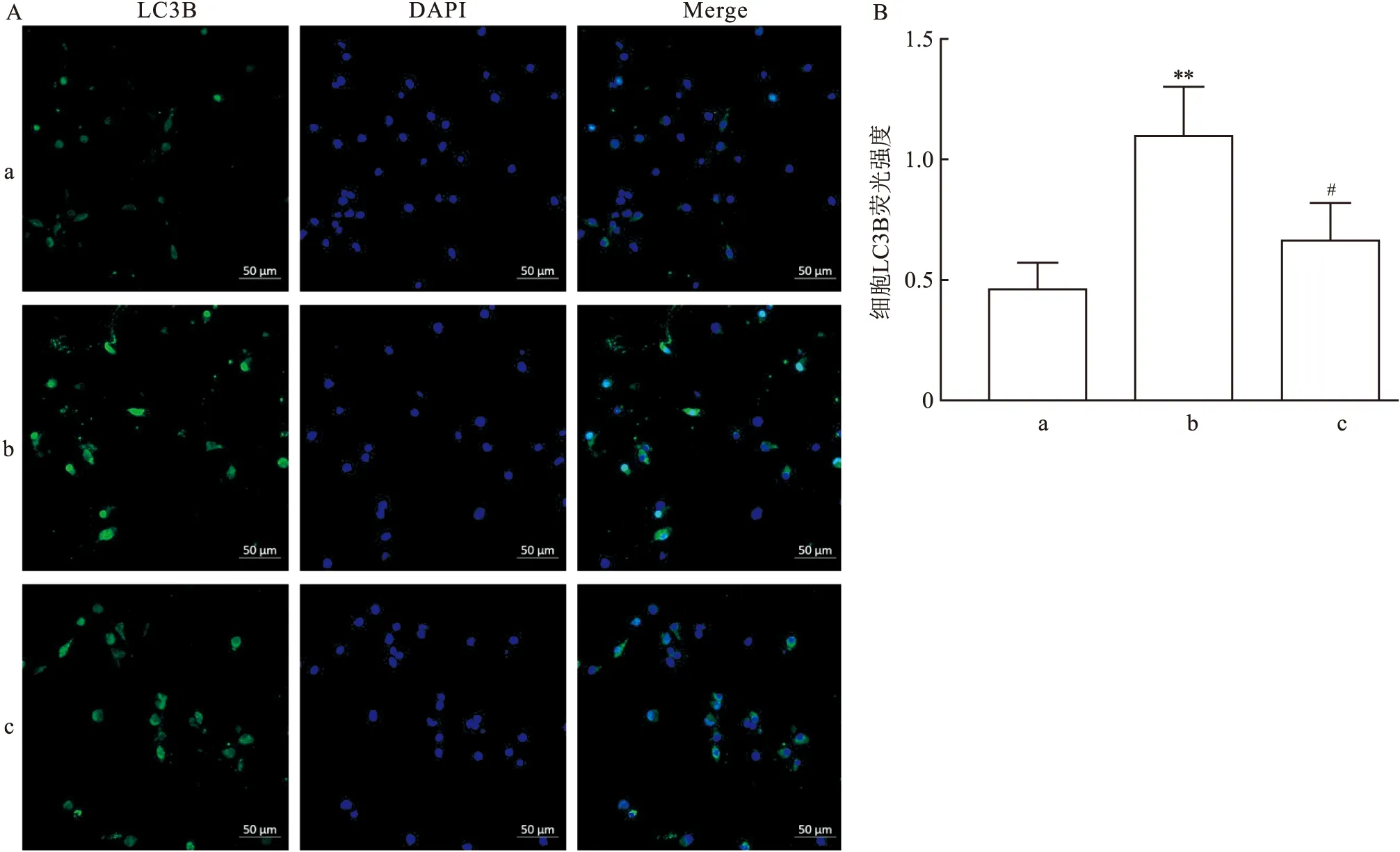
图4 七氟烷后处理对原代海马神经元LC3B蛋白表达的影响A:免疫荧光法检测LC3B ×120;B:原代海马神经元中LC3B的表达变化;a: CON组;b:OGD/R组;c:OGD/R+SEVO组;与CON组比较:**P<0.01;与OGD/R组比较:#P<0.05
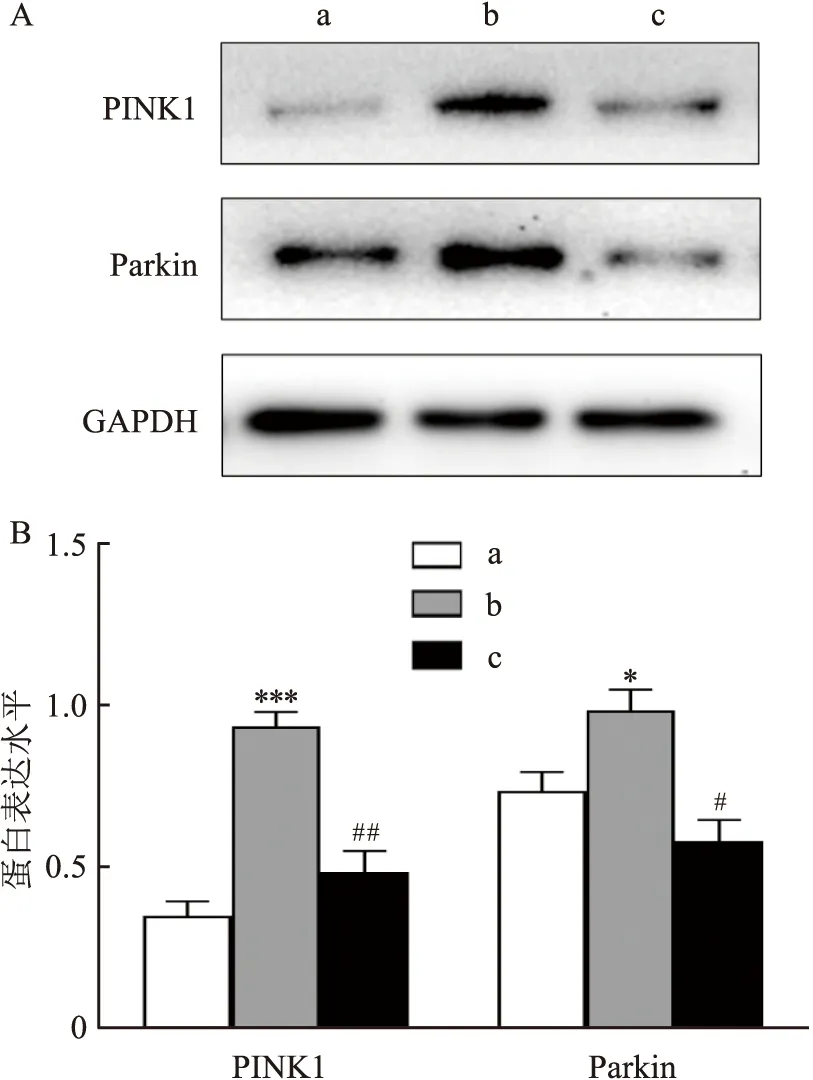
图5 七氟烷后处理对原代海马神经元PINK1、Parkin蛋白的影响A:Western blot检测PINK1、Parkin;B:原代海马神经元中PINK1、Parkin的表达变化;a:CON组;b:OGD/R组;c:OGD/R+SEVO组;与CON组比较:*P<0.05,***P<0.001;与OGD/R组比较:#P<0.05,##P<0.01
3 讨论
脑组织尤其海马区域因供能方式单一对能量缺乏非常敏感,极易因缺血再灌注受损。脑缺血再灌注的潜在病理改变与炎症、氧化应激、自噬密切相关,这些改变最终可导致细胞凋亡、坏死。临床上,麻醉和手术中遇到的失血性休克与复苏事件非常常见,故找到一种有效且切实可行的方法来减轻CIRI具有非常重要的临床意义。
课题组前期研究[8]表明2.4%七氟烷后处理可通过抑制细胞凋亡改善大鼠失血性休克和复苏损伤后的空间学习和记忆障碍。有研究[9]表明七氟烷后处理可以减轻HT22细胞OGD/R损伤及凋亡程度。故研究采用(18±0.5)d孕鼠子宫内胎鼠进行体外原代海马神经元培养,其对氧糖剥夺敏感性高[10]。对培养7 d的原代海马神经元进行OGD/R处理,以此模拟体内脑缺血再灌注过程。本研究通过此体外模型进行七氟烷保护作用机制的验证与探索。OGD/R处理后神经元LDH释放及凋亡细胞数量均增加,说明OGD/R模型建立成功。经过2.4%的七氟烷处理后LDH释放减少,证实采用的七氟烷后处理可减轻OGD/R诱导的细胞损伤。在实验中七氟烷后处理可以降低OGD/R诱导的神经元线粒体活性氧的生成,降低神经元氧化应激水平,改善线粒体功能。TUNEL和cleaved caspase-3染色证明七氟烷后处理可以减轻OGD/R诱导的细胞凋亡,改善凋亡早期的DNA断裂。此次体外实验证实七氟烷后处理可以减少OGD/R后的细胞损伤和凋亡,改善线粒体损伤。
目前越来越多的研究关注自噬在缺血/再灌注中的病理生理过程。自噬作为一种机体自我防御的机制,在缺血再灌注诱导的脑损伤中起着重要作用。在体外氧糖剥夺条件下,自噬是通过自噬体包裹损坏的蛋白及细胞器,将其送入溶酶体降解,提高自噬水平从而保护细胞免受损伤。有体外研究[11]证明,七氟烷后处理通过减少自噬体形成,增加自噬体的清除率而有助于细胞保护。LC3B是哺乳动物细胞中常见的自噬小体的标志蛋白。有研究[12]表明细胞在能量底物缺乏的情况下,会产生过度自噬的激活。本研究中OGD/R处理后神经元LC3B表达增多,神经元自噬过度激活。而七氟烷后处理可以减轻OGD/R所致的过度自噬。在细胞发生自噬的过程中,多种途径被激活发挥作用。PINK1/Parkin可以通过对受损线粒体的识别来启动及扩大自噬信号,是目前较公认的自噬途径,被广泛用来评估自噬水平[13]。本研究表明,OGD/R处理后神经元PINK1、Parkin蛋白表达量增多,而七氟烷处理后这两种蛋白表达量降低,证明七氟烷后处理可以减轻OGD/R所致的过度自噬,且这种作用可能与PINK1/Parkin通路有关。
综上,研究表明七氟烷后处理可以通过减少OGD/R诱导的细胞过度自噬、减轻氧化应激、减少凋亡等途径来保护原代海马神经元,且降低自噬的机制可能与PINK1/Parkin通路有关。该研究证实了七氟烷后处理对CIRI中神经元的保护作用,探讨了七氟烷后处理对CIRI中神经元自噬的影响。但该研究只初步探讨了可能的分子机制,没有应用PINK1/Parkin通路抑制剂进行进一步证明,需在后续的研究中进一步深入研究其具体机制,为临床治疗CIRI提供潜在的分子靶点。
