母子分离对青年CD-1雄鼠认知功能及海马BDNF介导的LTP的影响
2022-06-02王亚涛张月明韦琪瑶吴永芳陈贵海
王亚涛,张月明,韦琪瑶,吴永芳,陈贵海
生命早期的负性生活事件如母子分离(maternal separation, MS)是神经精神类疾病的高危因素,可导致机体一系列的神经心理行为的改变,严重者可造成持久的情绪和认知功能障碍[1-2],但其具体机制不明。现有研究[3]表明MS会加速子代老年期的认知功能损害,其中涉及兴奋性突触传递的长时程增强(long-term potentiation, LTP)受损。然而由于采取的动物品系与分离程序各不相同,MS对青年期认知功能的影响结果矛盾[4-5],且是否涉及突触可塑性的改变尚不清楚。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)作为内源性蛋白之一,是海马等脑区突触可塑性的重要调节因子[6],在脑发育及脑功能中起关键作用。研究表明,MS导致的认知功能改变与BDNF水平有关[7],后者是否联系认知损害相关的突触可塑性有待研究。该研究旨在探讨早期MS对青年期雄鼠认知功能及海马BDNF介导的LTP的影响。
1 材料与方法
1.1 实验动物CD-1小鼠(SPF级,6~8周)购自于北京维通利华责任有限公司。将14只健康CD-1孕鼠照料至其自然生产。随后将子代雄鼠随机分配至MS组及对照(CON)组,其中MS组的新生幼鼠在出生后第4天开始,每日上午9 ∶00—12 ∶00将母鼠与子鼠分离,直至出生后第21天断奶,CON组不进行任何干预。期间给予母鼠及子鼠充足的食物,维持室温22~24 ℃、湿度50%~60%、明暗周期12 h/12 h。断奶后,将两组幼鼠分笼饲养至3月龄。最终每组各纳入13只,其中8只用于行为学、Western blot及实时荧光定量PCR的检测,另外5只用于离体海马LTP的诱导。实验程序均经安徽医科大学实验动物委员会批准。
1.2 研究方法
1.2.1Morris水迷宫实验 采用Morris水迷宫实验评估幼鼠空间学习和记忆能力。水迷宫由一圆形水池和水下平台组成。实验分为定位航行期(学习期)和空间探索期(记忆期)两部分。① 定位航行期:每次测试将小鼠头部面向池壁随机从4个象限投入水中,小鼠在规定时间(60 s)内爬上平台或未能找到平台均让其在平台适应30 s。每天进行4次测试,间歇15 min,实验持续7 d。② 空间探索期:在定位航行实验的最后一天,撤去平台,将小鼠从靶象限的相反象限放入水中,让其自由探索60 s。使用Any-Maze分析定位航行期中受试小鼠找到平台的潜伏期、游泳路程及速度,以及空间探索期的靶象限时间及路程百分比。
1.2.2Western blot 采用Western blot法检测两组子鼠大脑海马区BDNF的相对含量。水迷宫结束后15 d将两组小鼠颈椎脱臼后取脑,剥离海马组织并充分研磨后,加入RIPA细胞裂解液进行裂解。12 000 r/min离心10 min。收集上清液,在收集的蛋白样品中按照1 ∶4加入5×SDS-PAGE蛋白上样缓冲液。沸水浴加热10 min,以充分变性蛋白。随后按照Western blot法的步骤操作,一抗为BDNF抗体,二抗为羊HRP标记的山羊抗兔IgG和山羊抗小鼠IgG。使用Image J软件分析蛋白条带,计算BDNF的相对表达量。
1.2.3实时荧光定量PCR 提取海马组织,加入TRIzol裂解液进行研磨,提取总RNA,利用分光光度计检测其纯度。使用逆转录试剂盒将RNA逆转录生成cDNA,将其作为荧光定量的模板,反应体系包括:5 μl的2×SYBR Green Mixture、1 μl的上游引物、1 μl的下游引物、1 μl的cDNA、2 μl的RNase Free water。反应条件为:95 ℃预变性、单循环1 min,95 ℃、20 s,60 ℃、1 min,共计40个循环。mRNA相对含量计算方法为2-ΔΔCt。引物序列见表1。

表1 引物序列
1.2.4离体海马CA1区LTP诱导 将小鼠腹腔注射戊巴比妥钠麻醉、处死,从颅腔中取出脑组织,将切除嗅球和小脑的脑组织直立粘于标本底座,固定于标本槽内。调整刀片高度,振动切片机进行连续切片,切取包含背侧海马的400 μm厚冠状脑片。脑片在记录之前,在持续通入95% O2和5% CO2混合气体的人工脑脊液中孵育1 h。加入各组药物后进行场电位记录。将刺激电极钨丝电极置于海马CA3区,玻璃记录电极置于CA1区,记录CA1区的场兴奋性突触后电位。场电位经放大器放大后,输出信号经数模转换器处理,由数据采集系统进行数据采集、分析和处理。记录时首先找到能引起可观察场兴奋性突触后电位(filed excitatory postsynaptic potential, fEPSP)的最小刺激,再逐渐增大刺激强度,记录每次刺激引起的突触前动作电位和突触后fEPSP的幅度。刺激方波的波宽为0.1 ms,刺激频率为0.033 Hz。以能引起最大fEPSP幅度50%的刺激强度作为测试刺激强度。给予时间间隔分别为20、40、60、80、100、150、200、400、600、800 ms和1 s的双脉冲刺激,计算第2个fEPSP与第1个fEPSP幅度的比率。以能引起最大fEPSP幅度的50%刺激强度作为测试刺激强度,稳定记录30 min作为基线,由高频电刺激(100 Hz、1 000 ms ×2, 30 s间隔诱导),诱导后持续记录90 min。
2 结果
2.1 母子分离对小鼠空间记忆的影响定位航行期,两组寻找平台的潜伏期[F(6,84)=109.6,P<0.01]以及游泳路程[F(6,84)=76.06,P<0.01]均随天数的增加而逐渐减小;与CON组小鼠相比,MS组小鼠定位航行期潜伏期[F(1,14)=30.10,P<0.01](图1A)及游泳路程[F(1,14)=64.95,P<0.01](图1C)增加;而处理因素×天数的交互效应对潜伏期[F(6,84)=1.813,P>0.05]及游泳路程[F(6,84)=0.956 7,P>0.05]无显著性影响。空间探索期,与CON组小鼠相比,MS组小鼠靶象限时间百分比(P<0.05,图1B)及游泳路程百分比(P<0.05,图1D)均下降。游泳速度[F(6,84)=0.606 3,P>0.05]不随天数发生改变,且组间比较无统计学差异[F(1,14)=0.724 1,P>0.05](图1E)。
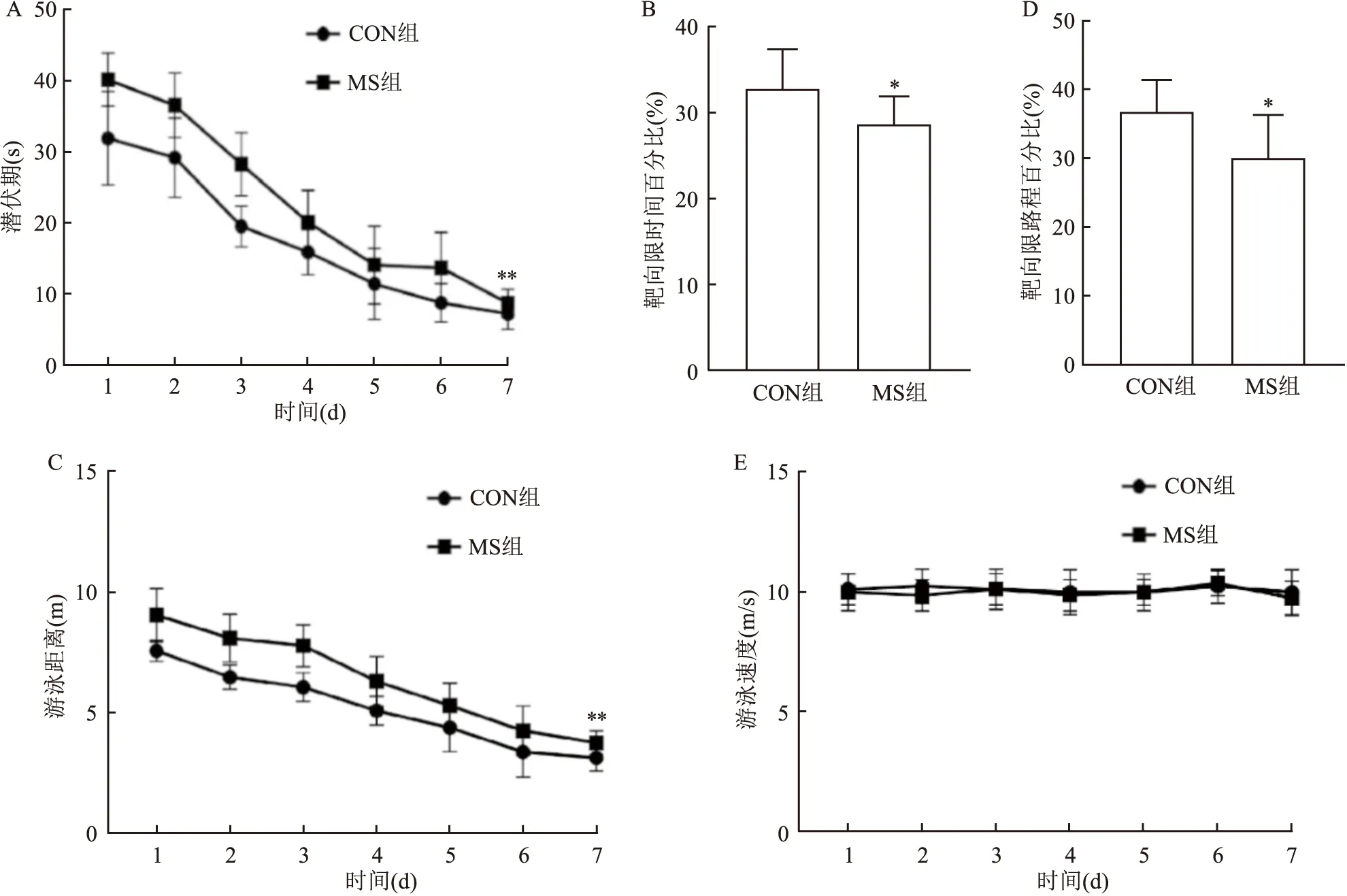
图1 两组CD-1小鼠在Morris水迷宫中的测试情况A:定位航行期潜伏期;B:空间探索期靶象限时间百分比;C:定位航行期游泳距离;D:空间探索期靶象限路程百分比;E:游泳速度;与CON组比较:*P<0.05,**P<0.01
2.2 母子分离对小鼠海马区BDNF水平的影响两独立样本t检验结果表明,与CON组相比,MS组海马区BDNF蛋白含量降低(P<0.01)。见图2。
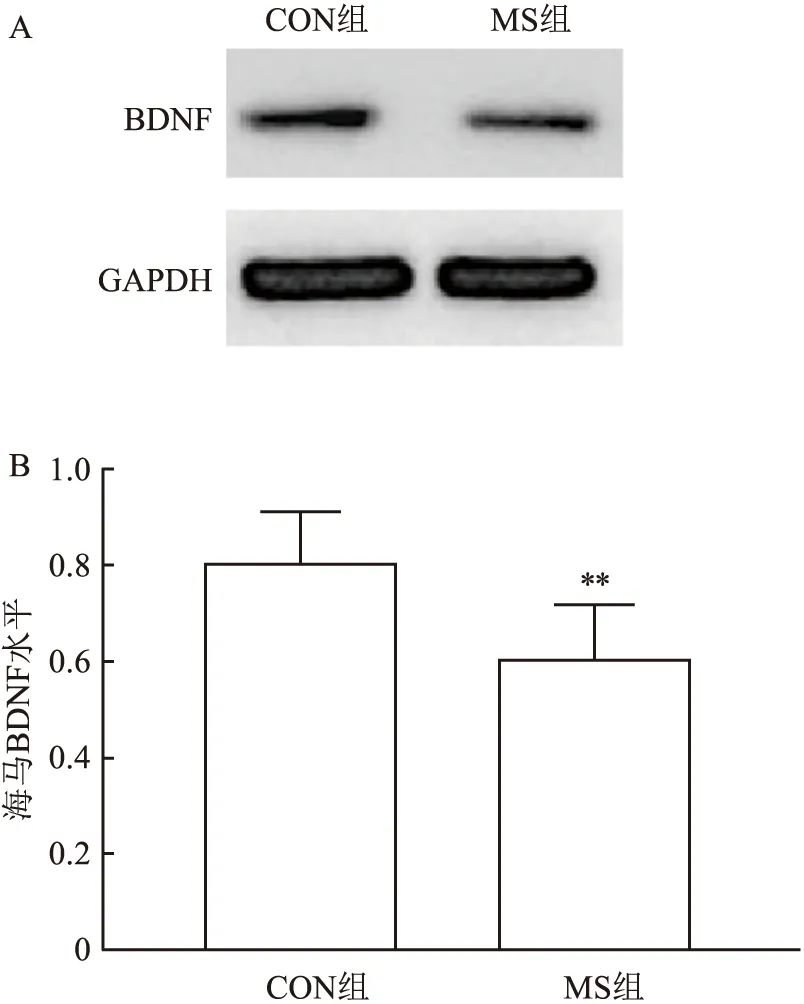
图2 两组CD-1小鼠海马区BDNF蛋白含量的表达比较A:BDNF蛋白条带;B:BDNF蛋白相对含量;与CON组比较:**P<0.01
2.3 母子分离对小鼠海马区BDNF mRNA水平的影响实时荧光定量PCR结果显示,MS组BDNF mRNA相对含量低于CON组(P<0.05)。见图3。

图3 两组CD-1小鼠海马区BDNF mRNA水平比较与CON组比较:*P<0.05
2.4 母子分离对小鼠海马CA1区LTP的影响使用θ爆发刺激(TBS)诱导海马CA3-CA1通路LTP,与对照组相比,MS组LTP振幅降低(P<0.01)。见图4。

图4 离体海马CA1区LTPA:fEPSP模式图;B:fEPSP相对斜率统计图;与CON组比较:**P<0.01
3 讨论
生命早期是个体神经系统发育的关键时期,这一时期神经元的发育及功能完善极易受应激事件的影响,引起一系列神经生物学变化,从而导致成年后的认知功能损害[1]。母子分离通过母爱剥夺这一较为温和的手段对幼鼠进行心理打击,常被用于探讨生命早期应激影响成年后学习与记忆功能的机制。本研究显示,经历MS的青年期CD-1子鼠在Morris水迷宫学习期的潜伏期及游泳路程显著延长,在记忆期靶象限时间及路程百分比显著降低,而运动能力(即游泳速度)未发生损害。这表明婴儿期的MS经历可损害青年期的空间学习记忆功能。
尽管MS导致学习和记忆功能受损的机制尚不明确,但海马作为记忆形成和维持的关键脑区可能参与其中。BDNF在海马区广泛表达,并通过与酪氨酸激酶受体B(tyrosine receptor kinase B, TrkB)结合调节下游的PI3K/AKT、PLC-γ等信号通路,进而参与认知相关神经元的功能调节[8-9]。该研究使用Western blot与实时荧光定量PCR分析结果表明,3月龄MS组海马区BDNF的表达水平(蛋白和mRNA)显著下降。以往母子分离研究对象多为分离程序持续整个哺乳期的大鼠或哺乳前中期的近交系小鼠。由于前者品系的差异及后者分离时间的不足,使得母子分离操作对认知功能的影响具有矛盾性[10-11]。为改善这一模型,该研究选用对更能模拟人群特点的封闭群CD1小鼠进行足够强度的母子分离操作,并通过多种技术评估其BDNF的表达水平,同时利用电生理技术填补了该品系的小鼠LTP变化这一空白,进而显示负性生活事件如母爱剥夺易导致海马区BDNF的表达水平下降,从而造成持久的认知功能减退。
目前研究MS对啮齿类动物突触可塑性的影响,其研究对象聚焦于大鼠,而鲜有研究关注小鼠的突触可塑性是否改变。仅有的一项研究显示,通过检测经历MS操作的C57BL/6J子鼠青春期第35~55天海马不同通路的LTP,结果提示,CA3-CA1通路的LTP尚未受损,而颗粒细胞发出的轴突组成的苔藓纤维与CA3区锥体细胞通路的LTP下调[11]。该研究电生理结果表明婴儿期经历MS的青年CD-1小鼠CA3-CA1通路的LTP受损。究其原因,可能是该研究采用的动物品系、分离程序以及检测时期的差异所致。
既往研究[9]结果表明,BDNF作为突触可塑性的重要调节因子,参与学习与记忆功能,其机制之一是通过与TrkB受体结合发挥调节作用。另有研究[12]显示,通过选择性的降低海马CA1/CA3区BDNF/TrkB的表达,在突触前膜BDNF与TrkB结合参与LTP的诱导,二者在突触后膜结合用于维持LTP。LTP是NMDA受体突触传递效能持续增强的表现,在学习记忆过程中发挥重要作用。BDNF可以通过促进NMDAR的转录、翻译过程,调节NMDAR的磷酸化水平从而促进谷氨酸突触传递,这一过程依赖于突触后TrkB的活化[13]。此外,BDNF/TrkB通路通过促进Ca2+内流,活化蛋白激酶C诱导NMDAR的转运进而调节突触可塑性[14]。以上研究提示,BDNF可能通过介导突触可塑性在MS导致的青年期认知功能受损中发挥重要作用。
综上所述,一定强度的母子分离会导致青年期雄鼠的认知功能减退,后者可能与海马区BDNF介导的LTP受损有关。该实验的不足之处在于未采用免疫组化技术检测海马各亚区BDNF含量,未进一步向脑室注射外源性BDNF或转基因技术使BDNF在青年期过表达,观察能否逆转MS带来的LTP下调及学习记忆功能的损害。此外,BDNF介导的LTP的下游通路如何参与MS导致认知功能损害的过程有待于进一步研究。
