蝉芩颗粒含药血清对脂多糖诱导人支气管上皮细胞神经源性炎症的干预机制
2022-06-01陈侃俊赵源石炜弘窦丹波吕俊余小萍沈若冰
陈侃俊, 赵源, 石炜弘, 窦丹波, 吕俊, 余小萍, 沈若冰
(1.上海中医药大学附属曙光医院,上海 201203;2.上海中医药大学,上海 201203;3.上海市浦东新区老年医院,上海 201314)
感染后咳嗽(post infectious cough)是亚急性咳嗽主要病因之一[1],占亚急性咳嗽病因的48.4%,发病率高,上呼吸道感染的患者11%~25%会发生感染后咳嗽[2]。感染后咳嗽的发生机制尚未明确,随着广泛分布于呼吸道的速激肽网的发现,神经源性炎症在感染后咳嗽机制中的作用也逐渐成为研究热点之一[3]。研究显示,激活的诱导型一氧化氮 合 酶(iNOS)/一 氧 化 氮(NO)-环 磷 酸 鸟 苷(cGMP)-cGMP 依赖性蛋白激酶(PKG)信号通路及瞬时受体电位香草酸亚型1(TRPV1),可导致P 物质(SP)等速激肽释放,在神经源性炎症中起重要作用[4-5]。蝉芩颗粒是上海市名中医黄吉赓教授的治咳经验方。临床研究表明,蝉芩颗粒治疗风邪恋肺型感染后咳嗽患者有较好的疗效[6]。前期实验研究[7]表明,蝉芩颗粒可减轻感染后咳嗽大鼠气道神经源性炎症,机制可能与下调TRPV1 蛋白表达、减少速激肽释放有关,其上游机制尚不明确。网络药理学研究表明,iNOS 可能是蝉芩颗粒治疗感染后咳嗽的潜在靶点[8]。因此,本研究通过体外实验,选择人支气管上皮细胞16HBE 作为研究对象,以脂多糖(LPS)诱导构建神经源性炎症细胞模型,观察蝉芩颗粒对模型细胞iNOS/NOcGMP-PKG 信号通路作用的影响,为该方应用于感染后咳嗽提供分子生物学依据,现将研究结果报道如下。
1 材料与方法
1.1 细胞人支气管上皮细胞16HBE,购自武汉普诺赛生命科技有限公司,货号:CL-0249。
1.2 药物与试剂蝉芩颗粒(上海中医药大学附属曙光医院药剂科制备,批号:200401,14 g/包,主要成分:僵蚕、柴胡、黄芩、竹沥半夏、生甘草等)。LPS、N-硝基-L-精氨酸甲酯(L-NAME)(美国Sigma 公司);胎牛血清(美国Gibco 公司);DMEM培养基(美国Gibco公司);细胞计数试剂盒8(CCK-8,日本同仁株式会社);TRIzol RNA 提取试剂(美国Thermo Fisher 公司);逆转录PCR 试剂盒、荧光定量SYBR Green试剂盒(南京诺唯赞生物科技股份有限公司);iNOS 抗体(英国Abcam 公司);可溶性鸟苷酸环化酶(sGC)抗体(英国Abcam公司);PKG抗体(美国Proteintech 公司);β-actin抗体(英国Abcam公司);钙离子荧光探针(日本同仁株式会社)。
1.3 仪器PCR仪(美国ABI公司,型号:7500);显微镜(日本Olympus 公司,型号:BX51TF);酶标仪(美国Rayto 公司,型号:RT-6000);Mini Trans-Blot垂直电泳仪系统(美国Bio-Rad公司,型号:1703930); CO2培养箱(日本Sanyo 公司,型号:XD-101);Cary Eclipse 分光光度计(美国安捷伦公司)。
1.4 蝉芩颗粒含药血清的制备与保存
1. 4. 1 实验动物 16 只SPF 级SD 大鼠,体质量180 ~220 g,购自上海斯莱克实验动物有限责任公司,动物生产许可证号:SCXK(沪)2017-0005。将16 只大鼠随机分为空白组与蝉芩颗粒高、中、低剂量组,每组4只。饲养于上海中医药大学实验动物中心,动物使用许可证号:SYXK(沪)2020-0009,温度(22±2)℃,相对湿度50%~60%,12 h光照。研究内容与过程中涉及的实验动物,均符合国家对医学实验动物的有关要求,伦理批准编号:PZSHUTCM211115014。
1.4.2 灌胃与血清采集 按照中药血清药理学方法[9-10],蝉芩颗粒高、中、低剂量组大鼠适应性饲养1 周后开始灌胃给药。蝉芩颗粒成人(按60 kg体质量计算)给药剂量是84 g/d,大鼠给药剂量按“人和动物体表面积折算的等效剂量比值表”换算,为17.6 g·kg-1·d-1(高剂量)、8.8 g·kg-1·d-1(中剂量)、4.4 g·kg-1·d-1(低剂量)。空白组灌胃等体积生理盐水。各组大鼠均按照每次1 mL 灌胃,每日早晚2次,连续3 d。于末次灌药后1 h,用戊巴比妥钠麻醉大鼠,无菌条件下分离、暴露腹主动脉,取血,置于4 ℃冰箱中静置1 h 后,以3 000 r/min(离心半径为3 cm)离心20 min,无菌收集血清,同组血清混合。将4 组血清置于56 ℃水浴灭活30 min,0.22 μm 微孔滤膜过滤,密封,-80 ℃保存备用。
1.5 细胞培养16HBE 细胞,以含10%胎牛血清DMEM培养基(其中含100 U/mL青霉素和100 μg/mL链霉素),置于37 ℃5% CO2恒温培养箱中培养,倒置显微镜下观察细胞生长情况,待细胞大部分融合并基本长满瓶底后,2.5 g/L 胰蛋白酶消化传代。选取处于对数生长期的细胞进行实验。
1.6 细胞分组与干预
1.6.1 细胞分组 按随机数字表将细胞分为6组:空白组,模型组,蝉芩颗粒高、中、低剂量组,L-NAME(iNOS抑制剂)组。
1.6.2 细胞干预 空白组:加入含10%空白血清的DMEM 培养基培养。模型组:给予LPS(1 μg/mL,12 h,预实验获得LPS 最佳损伤浓度及时间)+含10%空白血清的DMEM 培养基培养。蝉芩颗粒高、中、低剂量组和L-NAME 抑制剂组在加入模型组相同量的LPS 基础上,分别对应加入10%高、中、低剂量蝉芩颗粒含药血清及L-NAME 0.1 mmol/L(LPS干预前预处理1 h)[11-12]。各组干预12 h后收集细胞备用。
1.7 检测指标与方法
1. 7. 1 CCK-8 法检测16HBE 细胞活力 取处于对数生长期的16HBE 细胞,使用胰酶进行消化,按8×103个/mL细胞接种于96孔板中,每组设3个复孔。细胞贴壁后,同步化培养24 h,再给予相应药物干预后继续培养12 h。吸弃培养基,更换为10%CCK-8稀释液,100 μL/孔,继续孵育4 h,终止培养后应用酶标仪450 nm 波长检测各孔吸光度(OD)值。细胞活力(%)=(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100%。
1.7.2 实时荧光定量聚合酶链反应(RT-qPCR)检测16HBE 细胞iNOS、sGC、PKG、TRPV1、SP、IL-6、IL-1β、ICAM-1的mRNA表达 采用TRIzol法提取各组细胞总RNA,按试剂盒说明书合成cDNA,以β-actin为内参进行荧光定量PCR扩增以检 测 各 组 中iNOS、sGC、PKG、TRPV1、SP、IL-6、IL-1β、ICAM-1 mRNA 的表达水平。反应条件:95 ℃预变性10 min;95 ℃变性15 s,56 ℃退火55 s,72 ℃延伸20 s,35个循环。引物由金唯智公司合成。引物序列见表1。各组均设3 个复孔。用2-△△CT法计算目的基因mRNA 的相对表达水平。

表1 PCR引物序列Table 1 The PCR primer sequences
1.7.3 蛋白免疫印迹(Western Blot)法检测16HBE细胞iNOS、sGC、PKG 的蛋白表达 取各组细胞,加入放射免疫沉淀分析(RIPA)细胞裂解液,冰上裂解30 min 后,离心收集上清,二喹啉甲酸(BCA)法测定细胞总蛋白浓度。加入制备好的电泳液,上样量为每泳道30 μg,浓缩胶电泳电压80 V,分离胶电泳电压120 V,当溴酚蓝迁移至分离胶下缘时,停止电泳。将分离后的蛋白转移至聚偏氟乙烯(PVDF)膜。加入50 g/L 脱脂奶粉的封闭液,于摇床上室温封闭1.5 h。用TBST 洗膜3 次,每次10 min,分别加入稀释好的一抗iNOS抗体(1∶10 000)、SGC 抗体(1∶1 000)、PKG 抗体(1∶2 000)、β-actin 抗体(1∶1 000),4 ℃反应过夜。次日先以TBST 洗膜3 次,每次10 min,后加入辣根过氧化物酶(HRP)标记的羊抗兔IgG(1∶5 000)或羊抗鼠IgG(1∶10 000),室温摇床振荡反应2 h。再用TBST 洗膜3 次,每次10 min。按电化学发光(ECL)试剂盒说明进行显影。应用ImageJ软件进行灰度分析,以目的蛋白灰度值/β-actin 灰度值比值表示目的蛋白的相对表达水平。
1. 7. 4 荧光分光光度法检测16HBE 细胞[Ca2+]i水平 细胞分组并干预后,使用PBS 溶液漂洗3 次,除去培养基,加入荧光探针Fluo-4 AM 工作液(终浓度5 μmol/L),溶液量以能充分覆盖细胞为准。避光37 ℃负载40 min。随后用PBS 溶液漂洗3 次,再避光37 ℃继续孵育20 min,以保证Fluo-4 AM在细胞内被充分转变为Fluo-4。使用荧光分光光度计检测Fluo-4 荧光强度,以确定细胞内钙离子浓度变化。激发光波长为488 nm,发射光波长为520 nm。
1.8 统计方法所有实验均设置3 次重复。所有实验数据均采用SPSS 19.0软件包处理,实验数据表示为均数±标准差(±s)。多组均数比较采用单因素方差分析(One-way ANOVA),若方差不齐,采用Dunnett’s T3 检验分析。以P<0.05 为差异有统计学意义。统计图表使用Graphpad Prism 5 软件完成。
2 结果
2.1 蝉芩颗粒含药血清对LPS诱导16HBE细胞活力的影响CCK-8 法检测各组细胞的活力,结果显示:与空白组比较,LPS 处理后16HBE 细胞活力显著降低(P<0.01);高剂量蝉芩颗粒及L-NAME 可恢复LPS 诱导16HBE 细胞活力的下降(P<0.05),中、低剂量蝉芩颗粒无明显作用(P>0.05)。具体结果见图1。
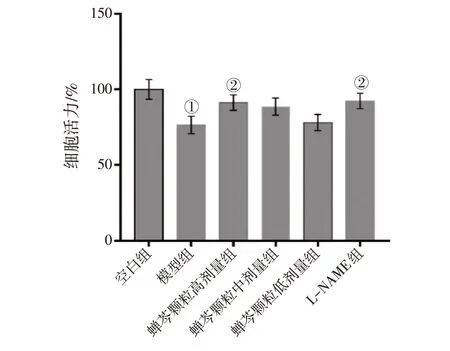
图1 各组16HBE细胞活力比较Figure 1 Comparison of 16HBE cell viability between various groups
2.2 蝉芩颗粒含药血清对LPS诱导16HBE细胞信号分子iNOS、sGC、PKG,TRPV1通道,神经源性炎症相关炎症因子SP、IL-6、IL-1β、ICAM-1 mRNA表达的影响应用RT-qPCR 法检测各组细胞中iNOS、sGC、PKG的mRNA表达水平,结果显示,LPS 诱导上调了16HBE 细胞中iNOS、sGC、PKG 的mRNA 表达水平(P<0.01),而高剂量蝉芩颗粒及L-NAME 有效抑制了LPS 诱导16HBE 细胞中iNOS、sGC、PKG mRNA表达的升高(P<0.01),蝉芩颗粒中剂量有效抑制了LPS诱导16HBE细胞中iNOS、sGC mRNA的升高(P<0.05或P<0.01),蝉芩颗粒低剂量则无显著性效果(P>0.05)。具体结果见图2 ~图4。

图2 各组16HBE细胞中iNOS mRNA表达水平比较Figure 2 Comparison of the mRNA expression level of iNOS between various groups of 16HBE cells
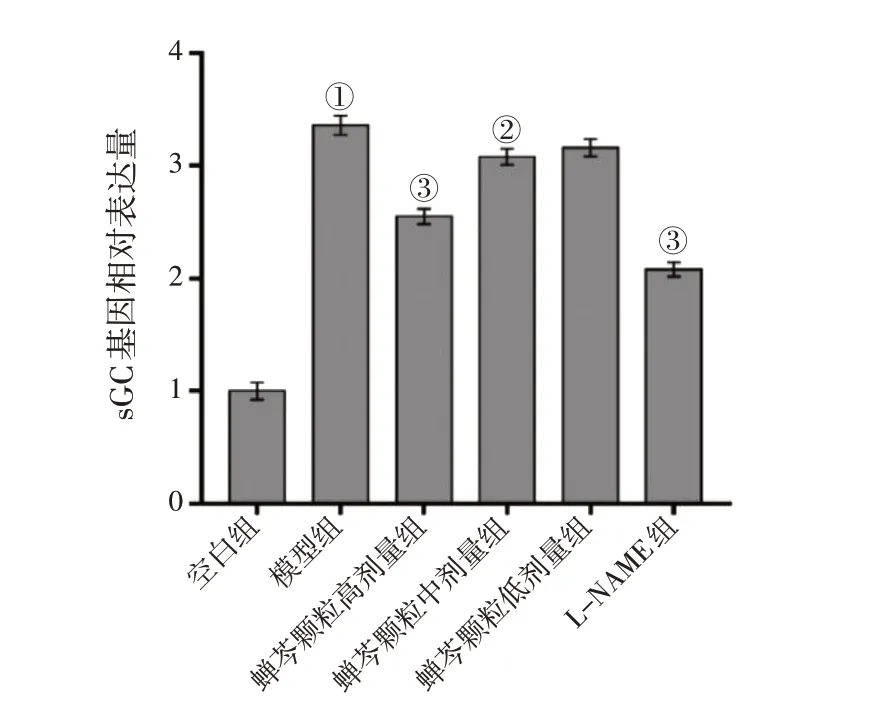
图3 各组16HBE细胞中sGC mRNA表达水平比较Figure 3 Comparison of the mRNA expression level of sGC between various groups of 16HBE cells

图4 各组16HBE细胞中PKG mRNA表达水平比较Figure 4 Comparison of the mRNA expression level of PKG between various groups of 16HBE cells
RT-qPCR 检测各组细胞中TRPV1 mRNA 的表达水平,结果显示,LPS 诱导上调了16HBE 中TRPV1 mRNA 的表达水平(P<0.01),而高、中剂量蝉芩颗粒及L-NAME 有效抑制了LPS 诱导16HBE 细胞中TRPV1 mRNA 的升高(P<0.05 或P<0.01),蝉芩颗粒低剂量无显著性效果(P>0.05)。具体结果见图5。
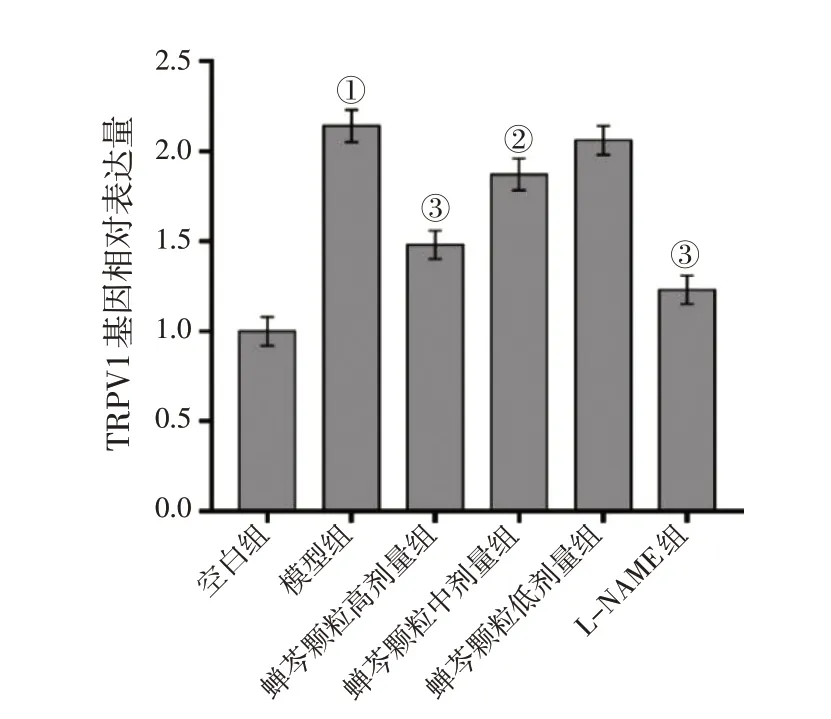
图5 各组16HBE细胞中TRPV1 mRNA表达水平比较Figure 5 Comparison of the mRNA expression level of TRPV1 between various groups of 16HBE cells
RT-qPCR 检测各组细胞中SP、IL-6、IL-1β、ICAM-1mRNA 的表达水平,结果显示,LPS 诱导上 调 了16HBE 中SP、IL-6、IL-1β、ICAM-1 mRNA 的表达水平(P<0.01),而高剂量蝉芩颗粒及L-NAME 均有效抑制了LPS 诱导16HBE 细胞中SP、IL-6、IL-1β、ICAM-1 mRNA 表达的升高(P<0.01),中剂量蝉芩颗粒有效抑制了LPS 诱导16HBE细胞中SP、IL-6、ICAM-1 mRNA表达的升高(P<0.05 或P<0.01),低剂量蝉芩颗粒抑制了SP mRNA 表达的升高(P<0.01)。具体结果见图6 ~图9。

图6 各组16HBE细胞中SP mRNA表达水平比较Figure 6 Comparison of the mRNA expression level of SP between various groups of 16HBE cells
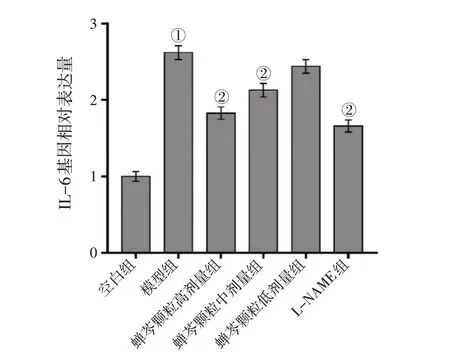
图7 各组16HBE细胞中IL-6 mRNA表达水平比较Figure 7 Comparison of the mRNA expression level of IL-6 between various groups of 16HBE cells
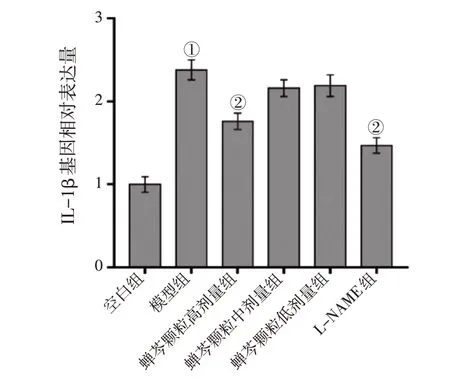
图8 各组16HBE细胞中IL-1β mRNA表达水平比较Figure 8 Comparison of the mRNA expression level of IL-1β between various groups of 16HBE cells

图9 各组16HBE细胞中ICAM-1 mRNA表达水平比较Figure 9 Comparison of mRNA expression level of ICAM-1 between various groups of 16HBE cells
2.3 蝉芩颗粒含药血清对LPS诱导16HBE细胞信号通路iNOS、sGC、PKG蛋白表达的影响Western Blot 检测结果显示,LPS 处理后16HBE 中iNOS、sGC、PKG 蛋白水平显著上调(P<0.01),而高剂量蝉芩颗粒及L-NAME有效抑制了LPS诱导16HBE细胞中iNOS、sGC、PKG 蛋白表达水平的升高(P<0.01),中、低剂量蝉芩颗粒的效果不明显(P>0.05)。具体结果见图10。

图10 各组16HBE细胞中iNOS、sGC、PKG蛋白表达比较Figure 10 Comparison of he protein expression of iNOS,SGC and PKG between various groups of 16HBE cells
2. 4蝉芩颗粒含药血清对LPS诱导16HBE细胞[Ca2+]i的影响荧光分光光度法测细胞[Ca2+]i,结果显示,LPS 处理16HBE 细胞,导致LPS 诱导16HBE 细胞中[Ca2+]i 水平显著上调(P<0.01),而高剂量蝉芩颗粒及L-NAME 有效抑制了LPS 诱导16HBE细胞中[Ca2+]i水平的升高(P<0.01),蝉芩颗粒中、低剂量无显著效果(P>0.05)。具体结果见图11。

图11 各组16HBE细胞[Ca2+]i水平比较Figure 11 Comparison of cellular[Ca2+]i level between various groups of 16HBE cells
3 讨论
蝉芩颗粒为上海市名中医黄吉赓教授的治咳验方,方中:蝉衣、僵蚕、射干疏散风热,化痰解痉利咽,为君;柴胡、黄芩、竹沥半夏清热和解枢机,前胡、白前、杏仁、紫菀、款冬花宣肃并用祛痰镇咳,为臣;桔梗、枳壳升降肺气理气祛痰,丹参、郁金活血理气,为佐;甘草祛痰止咳调和诸药,为使。黄吉赓教授认为,感染后咳嗽属于久咳范畴,其病机为风邪恋肺,治以祛风清热、化痰止咳、理气活血为主。蝉芩颗粒应用于感染后咳嗽患者的治疗,疗效显著,可有效改善感染后咳嗽患者的症状,提高生活质量,减轻气道神经源性炎症[6]。前期实验研究表明,蝉芩颗粒可减轻感染后咳嗽大鼠气道神经源性炎症,其机制可能与下调TRPV1表达、减少速激肽SP的释放有关[7]。鉴于蝉芩颗粒治疗感染后咳嗽的疗效在临床与实验研究中均得到验证,本课题组基于网络药理学,运用TCMSP、PharmGKb、TTD、DrugBank 等数据库对蝉芩颗粒药物活性成分及靶点分析发现:蝉芩颗粒重要的活性成分有槲皮素、山柰酚、异鼠李素、β-谷留醇等,具有抗炎、免疫调节、镇痛等作用,治疗的主要靶点集中在iNOS、过氧化物酶体增殖物激活受体γ(PPARsγ)等,靶点对应的疾病种类集中在呼吸道疾病及神经系统疾病等[8]。
感染后咳嗽的反射主要受2种不同类别的感觉传入神经纤维控制,分别为有髓鞘Aδ纤维和无髓鞘C 纤维[13]。由感觉神经末梢释放以SP 为主的速激肽所介导的炎症反应称为神经源性炎症[14]。SP由TAC1基因编码而成,主要表达于神经元胞体及神经纤维,其mRNA 及蛋白在不同种属生物的支气管上皮细胞、肺泡上皮细胞等亦有分布[15-18]。SP被激活后可促进IL-6、IL-1β、ICAM-1 等炎症介质释放,激发炎症反应[19]。支气管上皮细胞是感染后咳嗽病理环节中参与神经源性炎症的重要效应细胞之一,病毒感染等因素可促进胞内SP 的表达,与气道炎症和气道高反应性有关[17,20]。高表达的SP 使气道上皮细胞受到持续损害,并可间接刺激咳嗽感受器,导致咳嗽反射敏感性增加,使咳嗽发作或加重[21]。
NO 作为一种具有极强生物活性的效应分子,可由3 种一氧化氮合酶(eNOS、nNOS、iNOS)催化L-精氨酸产生,其中iNOS 在呼吸道疾病的病理状态中广泛表达,参与炎症性疾病反应过程,与炎症关系更为密切,是造成局部组织损伤的因素之一[22]。
TRPV1 是配体门控非选择性阳离子通道,广泛分布于哺乳动物的感觉神经纤维上,尤其是无髓鞘的C 类和部分少髓鞘的Aδ 类纤维[23],在呼吸道平滑肌细胞、上皮细胞等细胞上亦有分布[24]。TRPV1能被NO等多种炎症介质激活[21],sGC是NO的重要受体,它通过β亚基的卟啉基团结合NO 分子,自身结构发生改变而被激活,活化的sGC催化cGMP,通过结合PKG 的2 个调节结构域中cGMP结合位点,激活PKG启动下游信号级联[25-26],活化后的PKG 可激活TRPV1[27],增敏后的TRPV1 通道开放,Ca2+内流引起细胞膜去极化,启动一系列级联反应,介导SP 等速激肽释放,形成神经源性炎症[28]。在感染后咳嗽等疾病中,TRPV1既可以作为感受器,将刺激信息整合后上传至中枢神经系统,又可以作为效应器,接受中枢信号,激活后释放速激肽等炎症因子引起炎症反应[29]。
本研究采用LPS模拟革兰氏阴性菌感染的方法诱导支气管上皮细胞神经源性炎症模型[30-32],结果显示,LPS 诱导后细胞中IL-6、IL-1β 等炎症介质明显增高,速激肽SP 也有所升高,提示神经源性炎症细胞模型复制成功。在高剂量蝉芩颗粒含药血清干预后,炎症细胞模型因子IL-6、IL-1β、ICAM-1 及速激肽SP mRNA 水平下降,信号分子iNOS、sGC、PKG与TRPV1 mRNA(或蛋白)表达水平也同步下降,且标志TRPV1通道活化的Ca2+内流减少,与iNOS抑制剂L-NAME作用趋势相似。故推测蝉芩颗粒抑制支气管上皮细胞神经源性炎症的作用可能是通过下调iNOS/NO-cGMP-PKG 信号通路,抑制TRPV1 通道活化而实现。本研究为进一步深入探索蝉芩颗粒抗气道神经源性炎症的靶点,阐明该方治疗感染后咳嗽的机制提供了科学的依据和基础。
