温通抗癌方外敷治疗晚期胃癌恶性腹水的临床研究
2022-06-01黄永恒邹凤娇谭惠璇赵昌林
黄永恒, 邹凤娇, 谭惠璇, 赵昌林
(1.广州中医药大学研究生院,广东广州 510006;2.广东祈福医院,广东广州 511495;3.广东药科大学健康学院康复治疗系,广东广州 510006)
胃癌是临床常见的恶性肿瘤之一,根据国际癌症研究机构最新发布的研究数据[1]显示,2020年全球新发胃癌病例达108.9万例,以占全球新发癌症病例总数的5.6%位居全球第五大癌症,而在中国的比例更高达10.5%。胃癌早期诊断率低,约40%的患者就诊时已经是晚期,失去手术机会;50%左右的胃癌根治术后,2年内必将发生复发转移。晚期胃癌预后差,仅行支持治疗的患者,中位生存期约3~5 个月[2],1 年生存率约8%[3]。晚期胃癌常见腹腔内广泛转移和种植,临床表现为腹腔积液、腹胀、腹痛等,严重影响患者的生活质量,西医主要治疗手段为利尿、腹腔穿刺放液、腹腔热灌注化疗、免疫治疗等,但临床效果不佳且具有诸多弊端[4]。中医认为,晚期胃癌多表现为脾肾阳虚的证候特点[5];且癌性腹水以正虚为本,尤以脾肾阳虚证居多[6],治当温阳利水。中医药治疗手段具有多元化的特点,其中外治法以其使用方便、效果良好、副作用小和不需口服的独特优势在癌性腹水的治疗中发挥了积极作用[7]。基于此,本研究主要探讨温通抗癌方外敷治疗脾肾阳虚证晚期胃癌恶性腹水的临床疗效以及对相关肿瘤标志物的影响。现将研究结果报道如下。
1 对象与方法
1.1 研究对象及分组选取2011年1月至2017年12月广东祈福医院收治的108例符合纳入标准的脾肾阳虚证晚期胃癌恶性腹水患者为研究对象,依据随机数字表将患者随机分为治疗组和对照组,每组各54 例。本研究符合医学伦理学要求并通过广东祈福医院伦理委员会的审核批准。
1.2 病例选择标准
1.2.1 诊断标准 西医诊断标准:依据《内科肿瘤学》[8]及国家卫生部颁布的《临床疾病诊断与疗效判断标准》[9]中胃癌伴恶性腹腔积液的诊断标准,所入选病例均经过病理学诊断及影像学检查证实。临床分期标准依据美国联合委员会2010 年第七版胃癌TNM 分期制定[10]。中医诊断标准:参照2007 年国际中医药肿瘤学术大会提出的《中医恶性腹腔积液的诊疗指南(草案)》[11]中脾肾阳虚证诊断,表现为腹部胀满,纳呆脘闷,肢冷浮肿,小便短少,大便稀薄,舌淡体胖有齿痕,脉沉细无力。
1.2.2 纳入标准 ①符合上述西医晚期胃癌恶性腹水诊断标准和中医脾肾阳虚证的辨证标准。②年龄18~70岁,男女均可。③近1个月内无放疗、化疗史。④B超检查提示中量及以上腹水。⑤预期生存期≥12周。⑥体力状况ECOG(Eastern Cooperative Oncology Group)评分为0~1 分。⑦重要器官的功能指标符合下列要求:a.中性粒细胞绝对计数(ANC)≥1.5 × 109/L;b.血小板≥100 × 109/L;c.血红蛋白≥90 g/L;d.血清白蛋白≥28 g/L;e.胆红素≤1.5倍正常值上限(ULN),谷丙转氨酶(ALT)和谷草转氨酶(AST)均≤1.5 倍ULN,如存在肝脏转移,则ALT 和AST 均≤5倍ULN;f.肌酐清除率≥50 mL/min。⑧自愿参加本研究并签署知情同意书的患者。
1. 2. 3 排除标准 ①不符合上述纳入标准的患者;②有任何未控制的全身性疾病,如活动性感染、充血性心功能衰竭等的患者;③合并有腹部皮肤炎症的患者;④存在任何活动性自身免疫性疾病或既往有自身免疫性疾病病史的患者;⑤妊娠期或哺乳期妇女;⑥经研究者判断,受试者有其他可能导致本研究被迫中途终止的因素,如精神性疾病需要接受治疗的患者。
1.2.4 脱落、剔除标准 ①受试者要求终止治疗者;②未能如期随访者;③自行加用其他治疗措施,从而影响疗效判定者。
1.3 治疗方法
1. 3. 1 对照组 给予最佳姑息治疗,包括口服利尿剂呋塞米片(40 mg,每日1 次)、螺内酯片(40 mg,每日2 次)和静脉营养支持治疗等,共治疗4周。
1.3.2 治疗组 给予温通抗癌方以神阙穴为中心外敷腹部治疗。温通抗癌方的药物组成:附子30 g,肉桂20 g,干姜15 g,吴茱萸20 g,丁香15 g,小茴香15 g,甘遂30 g,大戟30 g,茯苓皮30 g,大腹皮30 g,当归20 g,莪术30 g,木香15 g,桂枝30 g,白芷30 g,法半夏10 g,守宫15 g,龙葵30 g,山慈菇30 g。方法:采取温通抗癌方腹部外贴。具体操作:将中药打成粉末,用醋调和成糊状,直接平摊于大小约24 cm×32 cm 的敷料贴中心区域,厚约0.5 cm 左右。本膏药贴在以神阙穴为中心的腹部,胶布固定,6 h 后取下,每天1 次,7 d为1个疗程,连用4个疗程(共4周)。注意事项:如出现皮肤瘙痒严重者可用抗过敏治疗,出现丘疹或小水疱者消毒控制感染后,可继续外敷膏药,不需停药过久。
1.4 观察指标及疗效判定
1.4.1 生活质量评分 (1)采用Karnofsky 功能状态(KPS)评分法[12]评价患者的生活质量,分别于治疗前后进行评分。(2)采用欧洲癌症治疗研究组织推出的癌症患者生活质量测定量表(EORTC QLQC30)[13]评分多维度评价患者的生活质量,包括对患者的躯体、角色、情绪、认知、社会5 个功能领域,疲劳、疼痛、恶心呕吐3 个症状领域,1 个总体健康状况领域和气促、失眠、食欲丧失、便秘、腹泻、经济困难6个条目进行评分。各领域得分采用极差方法进行线性变换,将原始分转化为0~100 分以内的标准化得分,分数越高表示生活质量越好。
1.4.2 中医证候评分及疗效评定标准 参照《中药新药临床研究指导原则(试行)》[14]中的证候评分标准制定中医证候评分量表,对治疗前后患者腹部胀满、食少纳呆、恶心呕吐、腹痛、疲乏、腰膝酸软等症状,按无、轻度、中度、重度4级分别计0、1、2、3 分进行量化评分并计算总积分,再根据治疗前后中医证候积分的变化情况评价疗效。采用尼莫地平法计算:证候积分减少率=(治疗前证候积分-治疗后证候积分)/治疗前证候积分×100%。疗效判定标准:临床痊愈:治疗后,临床证候积分减少≥95%;显效:治疗后,70%≤临床证候积分减少<95%;有效:治疗后,30%≤临床证候积分减少<70%;无效:治疗后,临床证候积分减少<30%或增加。总有效率=(临床痊愈例数+显效例数+有效例数)/总病例数×100%。
1.4.3 腹围测量 分别于治疗前(试验第1 天)和治疗后(试验完成后第2天)测量腹围,统一于晨起7点空腹排尿后以脐部为水平用软尺测量。
1.4.4 肿瘤标志物检测 抽取患者治疗前后空腹状态下血清和腹腔积液以测定恶性肿瘤特异性生长因子(tumor specific growth factor,TSGF)、转化生长因子β1(transforming growth factor β1,TGF-β1)和癌胚抗原(carcinoembryonic antigen,CEA)浓度。采用酶联免疫吸附法检测TSGF、TGF-β1 浓度,采用电化学发光法检测CEA 浓度。检测方法按照试剂盒说明书进行。
1.4.5 毒副作用观察 按照美国国立癌症研究所制定的毒副作用标准[15],观察药物不良反应。Ⅱ度和Ⅲ度毒副作用按照药物研究标准进行相关治疗,并定期监测血常规、肝功能、肾功能、心电图等安全性指标有无明显异常变化。
1.5 统计方法应用SPSS 19.0统计软件进行试验数据的统计分析。计量资料用均数±标准差(±s)表示,组内治疗前后比较采用配对t检验,组间比较采用两独立样本t检验;计数资料用率或构成比表示,组间比较采用χ2检验。均采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2 组患者脱落情况及基线资料比较研究过程中,治疗组脱落2例,对照组脱落4例,脱落原因均为要求放弃治疗,最终完成全部疗程治疗102 例,其中治疗组52 例,对照组50 例。治疗组52 例患者中,男30 例,女22 例;年龄40~65 岁,平均年龄(54.46 ± 7.16)岁;病理分型均为胃腺癌;肿瘤分期:Ⅲ期27 例,Ⅳ期25 例。对照组50 例患者中,男27 例,女23 例;年龄41~69 岁,平均年龄(52.94±7.03)岁;病理分型均为胃腺癌;肿瘤分期:Ⅲ期28 例,Ⅳ期22 例。2 组患者的性别、年龄、病理分型、肿瘤分期等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。
2. 2 2组患者治疗前后生活质量评分比较表1
表1 2组晚期胃癌恶性腹水患者治疗前后Karnofsky功能状态(KPS)评分和癌症患者生活质量测定量表(EORTC QLQ-C30)评分比较Table 1 Comparison of KPS scores and EORTC QLQC30 scores in the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,分)
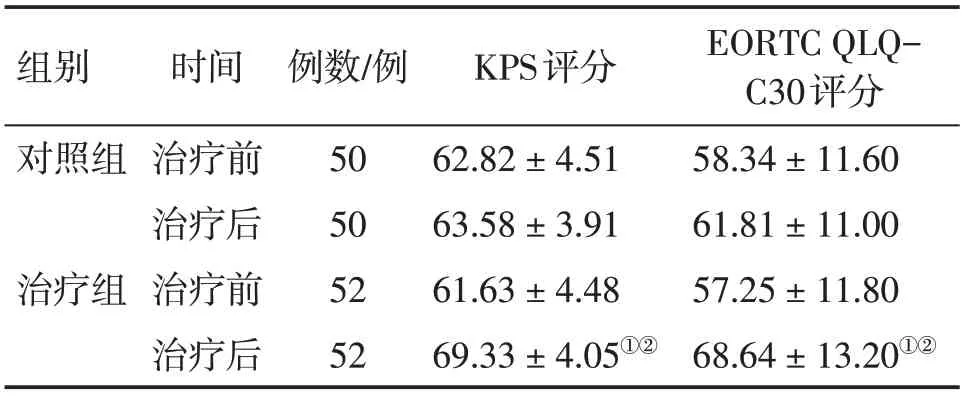
表1 2组晚期胃癌恶性腹水患者治疗前后Karnofsky功能状态(KPS)评分和癌症患者生活质量测定量表(EORTC QLQ-C30)评分比较Table 1 Comparison of KPS scores and EORTC QLQC30 scores in the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,分)
①P<0.05,与治疗前比较;②P<0.05,与对照组治疗后比较
EORTC QLQC30评分58.34±11.60 61.81±11.00 57.25±11.80 68.64±13.20①②组别对照组治疗组时间治疗前治疗后治疗前治疗后例数/例50 50 52 52 KPS评分62.82±4.51 63.58±3.91 61.63±4.48 69.33±4.05①②
结果显示:治疗前,2 组患者的KPS 评分和EORTC QLQ-C30评分比较,差异均无统计学意义(P>0.05)。治疗后,治疗组的KPS 评分和EORTC QLQ-C30评分均较治疗前明显提高(P<0.05),对照组仅EORTC QLQ-C30 评分较治疗前略有提高,而KPS 评分无明显变化,差异均无统计学意义(P>0.05);治疗后组间比较,治疗组对KPS 评分和EORTC QLQ-C30评分的提高幅度均明显大于对照组,差异均有统计学意义(P<0.05)。
2.3 2组患者治疗前后腹围变化情况比较表2结果显示:治疗前,2组患者的腹围比较,差异无统计学意义(P>0.05)。治疗后,2 组患者的腹围均较治疗前明显减少(P<0.05),且治疗组患者的腹围减少幅度明显大于对照组,差异有统计学意义(P<0.05)。
表2 2组晚期胃癌恶性腹水患者治疗前后腹围变化情况比较Table 2 Comparison of abdominal circumference between the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,cm)

表2 2组晚期胃癌恶性腹水患者治疗前后腹围变化情况比较Table 2 Comparison of abdominal circumference between the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,cm)
①P<0.05,与治疗前比较;②P<0.05,与对照组治疗后比较
治疗后87.14±4.43①84.42±3.99①②组别对照组治疗组例数/例50 52治疗前95.43±6.79 95.99±5.20
2.4 2组患者治疗前后中医证候疗效比较表3结果显示:治疗4周后,治疗组的总有效率为63.5%(33/52),对照组为42.0%(21/50),组间比较,治疗组的中医证候疗效明显优于对照组,差异有统计学意义(P<0.05)。

表3 2组晚期胃癌恶性腹水患者中医证候疗效比较Table 3 Comparison of TCM syndrome efficacy between the two groups of advanced gastric cancer patients with malignant ascites [例(%)]
2.5 2组患者治疗前后肿瘤标志物比较
2.5.1 2组患者治疗前后腹腔积液和血清中TSGF浓度比较 表4 结果显示:治疗前,2 组患者腹腔积液和血清中TSGF浓度比较,差异均无统计学意义(P>0.05)。治疗后,对照组腹腔积液和血清中TSGF浓度均较治疗前升高(P<0.05),而治疗组腹腔积液和血清中TSGF 浓度均无明显升高(P>0.05)。组间比较,治疗组腹腔积液和血清中TSGF浓度均明显低于对照组(P<0.05),表明温通抗癌方局部外敷可有效稳定腹腔积液和血清中TSGF的浓度。
表4 2组晚期胃癌恶性腹水患者治疗前后腹腔积液和血清中恶性肿瘤特异性生长因子(TSGF)的浓度比较Table 4 Comparison of TSGF level in the ascites and serum of the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,U·mL-1)

表4 2组晚期胃癌恶性腹水患者治疗前后腹腔积液和血清中恶性肿瘤特异性生长因子(TSGF)的浓度比较Table 4 Comparison of TSGF level in the ascites and serum of the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,U·mL-1)
①P<0.05,与治疗前比较;②P<0.05,与对照组治疗后比较
组别对照组治疗组例数/例50 52腹腔积液治疗前45.23±12.66 44.12±13.23血清治疗后88.86±14.15①81.65±15.12②治疗后57.06±13.37①45.44±11.26②治疗前80.55±15.75 79.14±17.40
2.5.2 2组患者治疗前后腹腔积液和血清中TGFβ1浓度比较 表5结果显示:治疗前,2组患者腹腔积液和血清中TGF-β1浓度比较,差异均无统计学意义(P>0.05)。治疗后,对照组腹腔积液和血清中TGF-β1 浓度均较治疗前升高(P<0.05),而治疗组腹腔积液中TGF-β1 浓度无明显升高(P>0.05),血清中TGF-β1 浓度较治疗前下降(P<0.05)。组间比较,治疗组腹腔积液和血清中的TGF-β1 浓度均明显低于对照组(P<0.05),表明温通抗癌方局部外敷可有效稳定腹腔积液中TGFβ1浓度和降低血清中TGF-β1浓度。
表5 2组晚期胃癌恶性腹水患者治疗前后腹腔积液和血清中转化生长因子β1(TGF-β1)的浓度比较Table 5 Comparison of TGF-β1 level in the ascites and serum of the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,ng·mL-1)

表5 2组晚期胃癌恶性腹水患者治疗前后腹腔积液和血清中转化生长因子β1(TGF-β1)的浓度比较Table 5 Comparison of TGF-β1 level in the ascites and serum of the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,ng·mL-1)
①P<0.05,与治疗前比较;②P<0.05,与对照组治疗后比较
组别对照组治疗组例数/例50 52腹腔积液治疗前142.41±21.87 144.24±22.72血清治疗后204.14±22.20①184.77±20.95①②治疗后151.67±18.01①145.96±19.61②治疗前192.21±24.82 194.25±20.31
2.5.3 2 组患者治疗前后腹腔积液和血清中CEA浓度比较 表6 结果显示:治疗前,2 组患者腹腔积液和血清中CEA 浓度比较,差异均无统计学意义(P>0.05)。治疗后,对照组腹腔积液和血清中CEA 浓度均无显著性变化(P>0.05),而治疗组腹腔积液和血清中CEA 浓度均较治疗前明显下降(P<0.05)。组间比较,治疗组腹腔积液和血清中CEA 浓度均明显低于对照组(P<0.05),表明温通抗癌方局部外敷可有效降低腹腔积液和血清中的CEA浓度。
表6 2组晚期胃癌恶性腹水患者治疗前后腹腔积液和血清中癌胚抗原(CEA)的浓度比较Table 6 Comparison of CEA level in the ascites and serum of the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,ng·mL-1)

表6 2组晚期胃癌恶性腹水患者治疗前后腹腔积液和血清中癌胚抗原(CEA)的浓度比较Table 6 Comparison of CEA level in the ascites and serum of the two groups of advanced gastric cancer patients with malignant ascites before and after treatment (±s,ng·mL-1)
①P<0.05,与治疗前比较;②P<0.05,与对照组治疗后比较
组别对照组治疗组例数/例50 52腹腔积液血清治疗后21.20±5.23 16.09±3.86①②治疗前23.47±6.90 22.40±6.30治疗后24.03±4.78 18.12±5.57①②治疗前20.23±4.47 19.52±5.25
2.6 毒副反应观察治疗4周后,2组患者的血常规、心电图均未见明显变化,肝功能、肾功能均未见明显下降。按照美国国立癌症研究所制定的毒副作用标准观察温通抗癌方局部外敷治疗的毒副作用,在治疗期间,治疗组有6例患者出现皮肤过敏反应(Ⅰ度5例,Ⅱ度1例),给予对症治疗后均可缓解。结果见表7。

表7 温通抗癌方的毒副作用Table 7 Toxic and side effects of Wentong Kang’ai Prescription (例)
3 讨论
胃癌归属于中医学“胃脘痛”“癥积”“反胃”的范畴,癌性腹水则归属于“鼓胀”的范畴。胃癌病位在胃,与脾肾关系密切。胃癌在胃失和降的基础上,脾失健运,脾胃气虚,酿湿生痰。而痰湿为阴寒之邪,易伤脾阳,后期久病累及肾阳,加之放疗、化疗后,更严重损耗人体阳气,故晚期胃癌多表现为脾肾阳虚的证候。晚期胃癌患者脾、肾之阳常不足,癌性腹水者尤甚。脾主运化输布津液,肾主水液代谢,脾肾调节水液的功能有赖于脾肾阳气的充盛。晚期胃癌患者脾肾阳虚,无以温煦机体,无力推动津液输布与代谢及温化痰湿阴寒之邪,故水液停聚于腹腔而成腹水。
中药外治法是中医学的主要治疗方法之一。清代吴师机《理瀹骈文》曰:“外治之理,即内治之理。外治之药,亦即内治之药,所异者法耳。”中医学使用中药外治法治疗恶性肿瘤已有几千年历史,《灵枢·痈疽》中就有记载:“发于腋下赤坚者,名曰米疽,治之以砭,涂之以豕膏。”指的是对于恶性肿瘤可采用外治法治疗。许明鉴[16]应用由千金子和马钱子组成的膏剂,外敷晚期肿瘤腹水患者腹部,结果发现可产生利便通淋、排气消胀、减轻腹水腹胀的作用。马杰等[17]用中药(生黄芪、牵牛子等)外敷脐部,加热水袋热敷,每日3次,每次2~3 h,治疗腹水30 例,总有效率为93.3%。可见中医外治法对腹水具有显著治疗效果。
方玖云等[18]通过总结中医文献,提出温阳化瘀利水是治疗癌性腹水的根本大法,其重点在于温阳。因此,本研究以温阳利水、化瘀散结为治则,使用温通抗癌方外敷治疗晚期胃癌恶性腹水患者,方中选用附子、肉桂、干姜,味辛,性热,均入脾、肾经,合用峻补脾肾阳气;丁香、小茴香、吴茱萸辛散温经散寒;甘遂、大戟、茯苓皮、大腹皮利水消肿;当归、莪术活血化瘀;木香为理气要药,行气调中;桂枝温阳化气以利水;白芷、法半夏燥湿化痰;守宫、龙葵、山慈菇抗癌散结;诸药合用,共奏温阳利水、化瘀散结之功,使局部气血经络通畅,阴寒湿邪得以温散,则腹水自减、腹胀自消。本研究结果显示,经治疗4 周后,治疗组的总有效率(63.5%)明显高于对照组(42.0%),且治疗组的KPS 评分、EORTC QLQ-C30生活质量评分改善程度和腹围减少程度均明显优于对照组,差异均有统计学意义(P<0.05),表明使用温通抗癌方局部外敷可有效减少晚期胃癌患者腹腔积液,改善患者临床症状和提高患者生活质量。
肿瘤标志物存在于血液、细胞、组织或体液中,反映肿瘤的存在与生长情况,可用于肿瘤发展程度的判断、肿瘤治疗效果的观察和评价以及肿瘤复发和预后的预测等。研究表明,TSGF 在肝癌和胃癌患者中的血清含量显著高于对照组和良性肿瘤组,阳性率分别达到82%和65.3%[19-20]。CEA和TSGF联合检测,能提高诊断的灵敏度,预测阳性的可靠性提高[19-21]。TGF-β1 可上调肿瘤细胞的黏附分子表达,抑制机体免疫细胞活性,促进肿瘤血管生成。研究[22-23]证明,阻断TGF-β1 的表达可以阻止癌细胞的侵袭和转移。TGF-β1可以作为前列腺癌术后监测肿瘤复发标记[24],也具有监测胃癌复发和观察治疗效果的作用[25-26]。故检测TSGF、TGF-β1、CEA能观察胃癌进展情况及治疗效果。本研究结果显示:(1)2 组患者治疗前后腹腔积液和血清中TSGF浓度的变化情况相似,治疗组均稳定无明显变化(P>0.05),而对照组则均较治疗前升高(P<0.05)。(2)治疗后,治疗组血清中TGF-β1 浓度较治疗前下降(P<0.05),腹腔积液中TGF-β1 浓度无明显变化(P>0.05),而对照组均较治疗前明显升高(P<0.05)。(3)与前两者不同,治疗组治疗后腹腔积液和血清中CEA 浓度均较治疗前明显降低(P<0.05),对照组则均较治疗前无明显变化(P>0.05)。综合以上结果,治疗组腹腔积液及血清中的TSGF、TGF-β1 浓度较治疗前稳定,CEA 浓度较治疗前下降。提示温通抗癌方外敷可有效减缓胃癌进展,对胃癌的治疗具有一定效果。在毒副作用方面,观察结果显示,温通抗癌方局部外敷无Ⅲ度的毒副作用及肝、肾功能下降情况出现,表明温通抗癌方局部外敷具有较高的安全性。
综上所述,温通抗癌方局部外敷治疗脾肾阳虚证晚期胃癌恶性腹水患者疗效确切,能有效改善中医临床症状,减轻腹水和提高患者生活质量,并能减缓胃癌的进展,稳定腹腔积液和血清中的TSGF、TGF-β1 浓度,降低CEA 浓度,对肿瘤标志物具有积极的影响,且安全性高,无明显毒副作用,可在临床中推广应用。
