基于Wnt/β-catenin信号通路探讨益气活血法对缺血性脑中风急性期大鼠脑神经元的保护作用
2022-06-01江利敏桑锋刘向哲嵇朋郭向东
江利敏, 桑锋, 刘向哲, 嵇朋, 郭向东
[1.河南中医药大学第一附属医院体检中心,河南郑州 450003;2.河南中医药大学第一附属医院重点实验室,河南郑州450003;3.河南中医药大学第一附属医院脑病一区,河南郑州 450003;4.郑州市第三人民医院(河南大学肿瘤医院)神经内科三病区,河南郑州 450003;5.河南中医药大学第一附属医院耳鼻喉科,河南郑州 450003]
缺血性脑中风是具有高致残率和致死率的临床常见疾病,是临床死亡和致残的主要原因之一[1]。在我国,缺血性脑中风的发病率占脑卒中总发病率的60%~80%[2]。缺血性脑中风急性期主要表现为失语、偏瘫、口舌歪斜、不省人事等。本病中医属本虚标实之证,病机以气滞血瘀、脑络痹阻为主,益气活血法为主要治疗方法[3]。黄芪和川芎为常用中药材,黄芪大补元气、提升中气,川芎活血行气、祛风止痛,二者配伍具有补益气血的功效[4-5]。本课题组前期临床研究发现,以黄芪注射液和川芎嗪(ligustrazine,川芎的有效成分之一)注射液或以含有黄芪和川芎等益气活血作用的中药方剂治疗缺血性脑中风患者,能够明显改善缺血性脑中风患者神经功能的缺失。因此,本研究以益气活血法为治则,采用黄芪注射液和川芎嗪注射液配伍,建立缺血性脑中风大鼠模型,观察该配伍对缺血性脑中风急性期脑神经元的保护作用及其机制,以期为临床应用提供依据,现将研究结果报道如下。
1 材料与方法
1. 1实验动物40 只6~8 周龄SPF 级SD 大鼠,雌雄各半,体质量为180 ~220 g,购自河南省实验动物中心[动物合格证号:SCXK(豫)2017-0001]。实验动物及饲养条件符合《实验动物管理条件》要求。饲养条件:室温(22 ± 1)℃,湿度(50 ±10)%,每天定时换气,保持12 h∶12 h 光暗照明,食水不限。研究方案获本院伦理委员会批准,实验严格遵循实验动物使用的3R原则。
1.2 药物、试剂与仪器黄芪注射液(神威药业集团有限公司生产,每支装10 mL,每1 mL 相当于黄芪生药2 g,批号:国药准字Z13020999);川芎嗪注射液(河南福森药业有限公司生产,2 mL∶40 mg,批号:国药准字H20056061);尼莫地平注射液(山东新华制药股份有限公司生产,批号:国药准字H10950226)。苏木素-伊红(HE)染色试剂盒、脱氧核苷酸末端转移酶(TdT)介导的dUTP 缺口末端标记法(TUNEL)染色试剂盒(北京索莱宝科技有限公司);白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)酶联免疫吸附分析(ELISA)试剂盒(武汉伊莱瑞特生物科技有限公司);RevertAidTMFirst Strand cDNA Synthesis Kit(美国Thermo Scientific 公司);Wnt3a、β-连环蛋白(β-catenin)、糖原合成酶激酶3β(GSK-3β)、磷酸化GSK-3β(p-GSK-3β)、甘油醛-3-磷酸脱氢酶(GAPDH)兔单抗,羊抗兔免疫球蛋白(IgG)(美国CST 公司)。双板垂直电泳仪(北京六一仪器厂,型号:DYCZ-24KS);PCR 仪(美国Applied Biosystems 公司,型号:7500);显微镜(日本奥林巴斯公司,型号:IX53);多功能凝胶成像系统(美国Syngene公司,型号:G:BOX);酶标仪(美国Thermo Fisher Scientific 公司,型号:Multiskan MK3)。
1.3 分组、造模与给药所有大鼠均适应性喂养1周后,将40只SPF级SD大鼠随机分为假手术组、模型组、尼莫地平组、益气活血组,每组各10只。除假手术组不插栓线外,其余各组大鼠参考文献方法[6]制备局灶性脑缺血模型。具体方法:麻醉大鼠后将大鼠以仰卧位固定,切开颈部正中部位,分离右颈总动脉与迷走神经,结扎颈外动脉,将颈总动脉和颈内动脉夹闭后将栓线插入颈总动脉,然后打开微动脉夹把栓线插入颈内动脉,固定好后缝合创口并消毒。造模成功的大鼠在苏醒后可出现左侧肢体瘫痪、站立不稳的情况,且提尾时向一侧转圈,如出现上述症状即判断为造模成功[7]。最终模型组、尼莫地平组和益气活血组各有9、8、9只大鼠造模成功。各组大鼠均在造模成功后10 min 开始给药治疗,给药剂量结合文献方法[8]、人与大鼠体表面积折算公式[8]及预实验结果确定:尼莫地平组大鼠给予腹腔注射0.5 mg/kg 尼莫地平注射液,益气活血组大鼠给予腹腔注射1.8 mL/kg 黄芪注射液和7.2 mg/kg 川芎嗪注射液,假手术组和模型组大鼠给予腹腔注射等体积生理盐水,每天1次,连续4 d。
1.4 观察指标与方法
1.4.1 神经功能评分 治疗前和治疗后12、24、48、72、96 h时分别计算各组大鼠Longa 神经功能评分,评分标准参考文献方法[9]。0 分:无神经损伤症状;1 分:对侧前爪不能完全伸展;2 分:行走时向外侧转圈;3 分:行走时向外侧倾倒;4 分:不能自发行走,意识丧失;5 分:死亡。剔除评分为0分和4~5分的大鼠。
1. 4. 2 HE 染色法观察脑神经元病理变化 给药结束后2 h,将大鼠麻醉固定于手术台,开胸,暴露心脏,剪开右心耳,灌注150 mL 生理盐水冲去血液;然后灌注150 mL 4%多聚甲醛固定,先慢后快,内固定完毕后断头取脑,置于4%多聚甲醛溶液中继续固定48 h。将脑组织常规脱水、透明,石蜡包埋,切片(厚度为4 μm),脱蜡至水,行HE染色。
1. 4. 3 TUNEL 法观察脑神经元的凋亡情况 取“1.4.2”项中制作的石蜡组织切片,严格按照TUNEL 试剂盒说明书步骤操作,置于显微镜下拍照记录。
1.4.4 RT-qPCR法检测脑组织Caspase-3、Bcl-2、Bax mRNA 表达 给药结束后2 h,快速断头取脑缺血侧皮层组织,加入TRIzol 裂解液提取总RNA,使用RevertAidTMFirst Strand cDNA Synthesis Kit 逆转录试剂盒合成cDNA,作为荧光定量模版。引物由日本TaKaRa 公司设计合成,引物序列见表1。采用2-△△CT法计算目的基因mRNA 相对表达水平。

表1 PCR引物序列Table 1 PCR primer sequences
1.4.5 ELISA 法检测脑组织IL-6、TNF-α、MDA含量和GSH-Px、SOD活性 给药结束后2 h,快速断头取脑缺血侧皮层组织,严格按照试剂盒说明书步骤操作,应用Multiskan MK3型酶标仪检测。
1.4.6 蛋白免疫印迹(Western Blot)法检测脑组织Wnt/β-catenin 信号通路相关蛋白的表达水平 给药结束后2 h,快速断头取脑缺血侧皮层组织。研磨匀浆后按照蛋白提取试剂盒说明书提取组织蛋白,用二喹啉甲酸(BCA)蛋白定量试剂盒测定蛋白浓度,定量完毕后蛋白中加入loading buffer,在EP管中混匀,置于沸水中煮沸5 min使蛋白变性。配制15%的分离胶和5%的浓缩胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),上样后80 V电泳2 h,60 V转膜2 h,50 g/L脱脂奶粉封闭2 h,将聚偏氟乙烯(PVDF)膜分别放入Wnt3a、β-catenin、p-GSK-3β、GSK-3β、GAPDH 等一抗稀释液(1∶1 000)中,4 ℃过夜。第2 天用TBST 缓冲液清洗3 次,每次10 min,然后加入羊抗兔IgG二抗(1∶2 000 稀释),37 ℃孵育2 h,TBST 缓冲液清洗3 次后滴加电化学发光液(ECL),反应1 min后置于凝胶成像系统显影。内参蛋白为GAPDH,应用ImageJ 软件分析各个蛋白对应的灰度值,计算目的蛋白的相对表达量,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.5 统计方法采用SPSS 25.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多样本比较采用单因素方差分析(One way ANOVA),两样本比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分比较表2 结果显示:与模型组比较,尼莫地平组大鼠在治疗后48、72、 96 h 时的神经功能缺损评分降低(P<0.05),益气活血组大鼠在治疗后24、48、72、96 h时的神经功能缺损评分降低(P<0.05)。模型组在治疗后96 h时的神经功能缺损评分低于治疗后12 h(P<0.05),其余时间点的神经功能缺损评分无显著性差异(P>0.05)。尼莫地平组在治疗后48、72、96 h 时的神经功能缺损评分低于治疗后12 h,并呈时间依赖性降低(P<0.05)。益气活血组在24、48、72、96 h时的神经功能缺损评分低于治疗后12 h,且24、48、72、96 h时的评分呈时间依赖性降低,差异有统计学意义(P<0.05)。
表2 各组大鼠不同时间点神经功能缺损评分比较Table 2 Comparison of neurological deficit scores between various groups of rats at different time points (±s,分)

表2 各组大鼠不同时间点神经功能缺损评分比较Table 2 Comparison of neurological deficit scores between various groups of rats at different time points (±s,分)
①P<0.05,与模型组同一时间点比较;②P<0.05,与同组12 h 比较;③P<0.05,与同组24 h 比较;④P<0.05,与同组48 h比较;⑤P<0.05,与同组72 h比较
治疗后96 h 0.00±0.00 2.26±0.31②1.47±0.20①②③④⑤1.01±0.15①②③④⑤组别假手术组模型组尼莫地平组益气活血组鼠数/只10 989治疗前0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00治疗后12 h 0.00±0.00 2.67±0.45 2.52±0.38 2.43±0.41治疗后24 h 0.00±0.00 2.56±0.42 2.23±0.37 1.72±0.25①②治疗后48 h 0.00±0.00 2.49±0.28 2.09±0.29①②③1.35±0.17①②③治疗后72 h 0.00±0.00 2.38±0.37 1.79±0.26①②③④1.20±0.13①②③④
2.2 各组大鼠脑神经元病理变化比较图1 结果显示,假手术组大鼠脑神经元排列整齐,细胞膜完整,细胞核清晰。与假手术组比较,模型组大鼠脑神经元排列紊乱,细胞肿胀破裂,可见明显的核固缩和核溶解现象。与模型组比较,尼莫地平组和益气活血组大鼠的脑神经元结构相对正常,排列紊乱现象减轻,细胞膜基本完整,核固缩和核溶解现象减轻。

图1 各组大鼠脑神经元病理变化比较(HE染色,×400)Figure 1 Comparison of pathological changes of cerebral neurons between various groups of rats(by HE staining,×400)
2.3 各组大鼠脑神经元凋亡情况比较图2、图3结果显示,假手术组大鼠脑组织几乎无TUNEL 阳性染色神经元,而模型组大鼠脑组织则可见大量TUNEL 阳性染色神经元,且神经元体积缩小,有核固缩现象,呈黄褐色颗粒状,神经元凋亡率亦显著增加(P<0.05)。与模型组比较,尼莫地平组和益气活血组大鼠脑TUNEL 阳性染色神经元数量减少,神经元凋亡率显著降低(P<0.05)。

图3 各组大鼠脑神经元凋亡率比较(±s)Figure 3 Comparison of cerebral neuronal apoptosis rate between various groups of rats(±s)
2. 4各组大鼠脑组织Caspase-3、Bcl-2、Bax mRNA表达比较表3 结果显示:与假手术组比较,模型组大鼠脑组织Caspase-3、Bax mRNA 表达水平显著增加(P<0.05),Bcl-2 mRNA表达水平显著降低(P<0.05)。与模型组比较,尼莫地平组、益气活血组大鼠脑组织Caspase-3、Bax mRNA表达水平显著降低(P<0.05),Bcl-2 mRNA表达水平显著增加(P<0.05)。
表3 各组大鼠脑组织Caspase-3、Bcl-2、Bax mRNA表达比较Table 3 Comparison of mRNA expression of Caspase-3,Bcl-2 and Bax in brain tissues between various groups of rats (±s)

表3 各组大鼠脑组织Caspase-3、Bcl-2、Bax mRNA表达比较Table 3 Comparison of mRNA expression of Caspase-3,Bcl-2 and Bax in brain tissues between various groups of rats (±s)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较
Bax 0.92±0.12 4.98±0.23①2.96±0.18①②2.87±0.17①②组别假手术组模型组尼莫地平组益气活血组鼠数/只10 9 8 9 Caspase-3 1.10±0.13 3.49±0.20①1.58±0.17①②1.82±0.15①②Bcl-2 3.97±0.19 0.95±0.11①2.33±0.14①②2.18±0.16①②
2.5 各组大鼠脑组织IL-6、TNF-α、MDA含量和GSH-Px、SOD活性比较表4 结果显示:与假手术组比较,模型组大鼠脑组织IL-6、TNF-α、MDA 含量显著增加(P<0.05),GSH-Px、SOD 活性显著降低(P<0.05)。与模型组比较,尼莫地平组、益气活血组大鼠脑组织IL-6、TNF-α、MDA含量显著减少(P<0.05),GSH-Px、SOD活性显著升高(P<0.05)。
表4 各组大鼠脑组织IL-6、TNF-α、MDA含量和GSH-Px、SOD活性比较Table 4 Comparison of contents of IL-6,TNF-α,MDA and activities of GSH-Px and SOD in brain tissues between various groups of rats (±s)

表4 各组大鼠脑组织IL-6、TNF-α、MDA含量和GSH-Px、SOD活性比较Table 4 Comparison of contents of IL-6,TNF-α,MDA and activities of GSH-Px and SOD in brain tissues between various groups of rats (±s)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较
组别假手术组模型组尼莫地平组益气活血组SOD/(U·mg-1)230.51±18.65 101.65±13.88①190.18±16.87①②187.33±17.12①②鼠数/只10 989 IL-6/(ng·L-1)250.31±39.66 872.65±59.14①304.26±42.92①②332.41±41.51①②TNF-α/(ng·L-1)230.32±36.81 1 900.15±53.24①840.52±44.37①②912.56±47.21①②MDA/(nmol·mg-1)11.19±1.32 19.85±1.23①14.01±1.36①②14.18±1.29①②GSH-Px/(U·mg-1)96.25±9.82 40.18±6.79①75.42±8.32①②70.65±7.95①②
2.6 各组大鼠脑组织Wnt/β-catenin信号通路蛋白表达水平比较图4 结果显示:与假手术组比较,模型组大鼠脑组织Wnt3a、β-catenin蛋白表达水平降低(P<0.05),GSK-3β磷酸化水平升高(P<0.05);与模型组比较,尼莫地平组、益气活血组大鼠脑组织Wnt3a、β-catenin 蛋白表达水平升高(P<0.05),GSK-3β磷酸化水平降低(P<0.05)。
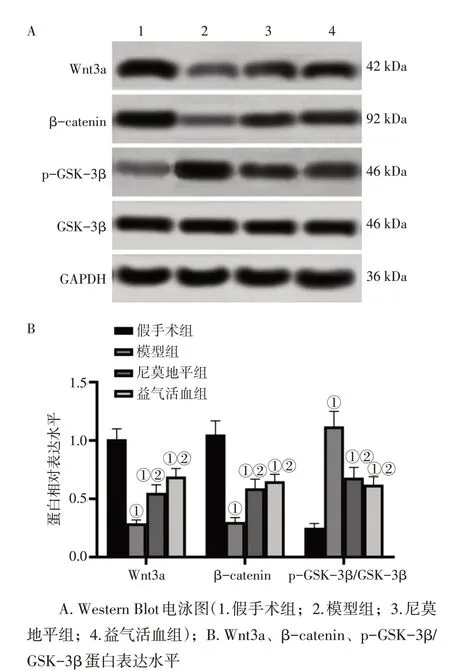
图4 各组大鼠脑组织Wnt/β-catenin信号通路蛋白表达水平比较Figure 4 Comparison of expression levels of proteins in Wnt/β-catenin signaling pathway in brain tissues between various groups of rats
3 讨论
缺血性脑中风是指由于多种因素导致脑部血液循环障碍、脑供血不足,导致脑组织缺血缺氧、损伤、坏死的疾病,属于中医“中风”范畴[10-11]。中医研究领域认为,缺血性脑中风以元气亏虚为本、以血瘀为标,以益气活血为治疗原则[12-13]。既往临床研究表明,黄芪注射液、川芎嗪注射液对脑血管意外后神经功能缺损、脑神经元的损伤具有改善作用,可提高患者生存质量[14-17]。本研究通过建立缺血性脑中风大鼠模型,观察黄芪注射液和川芎嗪注射液配伍对脑神经元的治疗机制,探讨益气活血法的保护作用。
本研究结果显示,与模型组比较,益气活血组大鼠神经功能缺损评分降低,且呈现出时间依赖性。HE染色结果显示,益气活血组大鼠脑神经损伤明显减轻,脑神经元结构基本正常,细胞排列较为有序,细胞膜基本完整。TUNEL 染色结果显示,益气活血组大鼠脑组织可见少量TUNEL 阳性染色神经元,神经元凋亡率显著低于模型组。以上结果表明,黄芪注射液和川芎嗪注射液配伍可显著改善缺血性脑中风大鼠急性期的神经功能受损症状,减轻脑神经元损伤和凋亡。
有研究表明,氧化应激和炎症反应作为脑缺血发病过程中的关键分子机制,其在缺血性脑疾病中的重要作用已得到共识,针对这些机制进行靶向治疗显示出较好的神经保护作用[18-19]。Li 等[20]研究表明,抑制氧化应激和炎症反应能够抑制脑缺血造成的神经细胞凋亡,并可有效减轻脑缺血再灌注大鼠神经功能缺损。本研究结果显示,益气活血组大鼠脑组织中IL-6、TNF-α、MDA 含量较模型组显著降低,GSH-Px、SOD 活性较模型组显著升高,表明黄芪注射液和川芎嗪注射液配伍可显著抑制缺血性脑中风急性期大鼠脑组织的炎症和氧化应激反应。
Bcl-2和Bax是调控细胞凋亡的关键基因,Bax过表达可促进细胞凋亡,而Bcl-2 可与Bax 形成二聚体抑制Bax 基因的表达,从而抑制细胞凋亡,Bcl-2和Bax可共同激活促凋亡因子Caspase-3及其家族的其他因子,引起衰老和凋亡的发生[21]。在本研究中,黄芪注射液和川芎嗪注射液配伍治疗可使缺血性脑中风大鼠脑组织Bax、Caspase-3 mRNA表达显著降低,Bcl-2 mRNA 表达升高,表明该配伍可显著抑制缺血性脑中风急性期大鼠脑神经元的凋亡。
Wnt/β-catenin 信号通路在缺血性脑中风神经血管单元保护中可能发挥重要调控作用[22]。Wnt/β-catenin信号通路不仅可以调节脑血管生成、血-脑脊液屏障形成及其生物学特征的维持[23],还参与了调节缺血性脑卒中后缺血周边的血管新生[24]。有研究表明,Wnt信号通路在缺血性脑损伤的修复过程中和神经血管稳态重构中起重要的调控作用[25]。Wnt3a、β-catenin、GSK-3β 是Wnt 信号通路的关键信号分子。Wnt3a 主要促进神经干细胞的分化[26]。在成年大鼠大脑中,β-catenin、GSK-3β 在整个脑组织中都有表达,大多数都表达于神经元细胞中[27]。脑缺血时,β-catenin 稳定性下降,上调β-catenin 可抑制缺血诱导的神经元凋亡、促进神经发生以及维持血脑屏障的稳定性,对缺血性脑损伤起修复作用[28]。GSK-3β 蛋白对缺血性脑损伤的细胞凋亡则起促进作用[29]。本研究结果显示,缺血性脑中风大鼠脑组织Wnt3a、β-catenin蛋白表达显著降低,GSK-3β磷酸化水平升高,经过黄芪注射液和川芎嗪注射液配伍治疗后,大鼠脑组织Wnt3a、β-catenin蛋白表达水平升高,GSK-3β磷酸化水平降低,表明该配伍可通过上调脑组织Wnt3a、β-catenin表达,抑制GSK-3β过度活化对缺血性脑中风大鼠起脑保护作用。
综上所述,本研究以益气活血法为原则,采用黄芪注射液和川芎嗪注射液配伍治疗缺血性脑中风急性期大鼠,可减轻神经功能损伤,改善脑神经元凋亡,抑制炎症和氧化应激反应,其作用机制可能与调控脑组织Wnt/β-catenin通路有关。
