腹腔镜手术治疗粘连性肠梗阻患者的临床疗效
2022-06-01万焱华
万焱华
(九江市第一人民医院普外三科,江西 九江 332000)
肠梗阻是外科常见急腹症之一,而粘连性肠梗阻是肠梗阻最常见的一种类型,多由先天发育异常及后天腹腔炎症、腹腔损伤、出血、腹腔异物等因素引起[1-2]。对于经过保守治疗,肠梗阻缓解不佳且发作次数频繁,甚至出现肠管缺血、坏死、梗阻加重的粘连性肠梗阻患者,临床主要采用手术治疗,分为开腹手术和腹腔镜手术[3]。开腹手术是早期临床治疗肠梗阻的常用方式,虽然能够缓解肠梗阻症状,但手术创伤较大,患者存在肠梗阻复发风险。随着腹腔镜技术的不断发展,已广泛应用于胃肠外科疾病治疗中,具有创伤小、疼痛轻等优点[4]。本研究旨在探讨腹腔镜手术治疗粘连性肠梗阻的临床疗效,现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2019 年5 月至2020 年6 月本院收治的93 例粘连性肠梗阻患者的临床资料,根据治疗方法不同分为A 组(n=46)和B 组(n=47)。A 组男25 例,女21 例;年龄39~67 岁,平均(54.38±4.48)岁;发病至送医时间1~12 h,平均(6.58±1.17)h。B 组男23 例,女24 例;年龄42~69岁,平均(54.71±4.94)岁;发病至送医时间1~11 h,平均(6.24±1.13)h。两组临床资料比较差异无统计学意义,具有可比性。本研究经医院医学伦理委员会审核批准。所有患者均对本研究知情同意,并签署知情同意书。纳入标准:立位或侧卧位X线检查显示肠内存在较多胀气肠袢和气液平面的患者;存在腹部手术治疗史,且术中确定为粘连引起的肠梗阻患者;经药物保守治疗后,梗阻症状未缓解甚至加重患者。排除标准:有出血倾向或凝血异常患者;术前检查发现存在腹内广泛粘连患者;胃肠道恶性肿瘤患者。
1.2 方法 A 组采用开腹手术治疗。嘱患者保持平卧位,给予全身麻醉,于患者腹部正中做标记作为切口点;若患者曾接受过腹部手术治疗,则在旧切口边缘5 cm处做一手术切口,找到病变部位并确认粘连情况后分离粘连组织,对已破损的肠管实施修补处理,常规清洗腹腔,留置引流管后关腹,结束手术。
B组采用腹腔镜手术治疗。协助患者仰卧于手术床上,给予气管插管全身麻醉,在脐部下方约1 cm处做手术观察穿刺孔,向腹腔注入CO2,建立气腹,气腹控制在12~14 mmHg。置入腹腔镜,观察梗阻部位粘连程度,于直视条件下在腹部作手术操作穿刺孔及辅助操作穿刺孔,注意保持各穿刺孔之间的合理距离,避免术中出现相互干扰的情况。对于肠梗阻系单一束带粘连引起的患者,采用超声刀(湖南安百医疗科技有限公司,型号:BN-CSD-JS17)或电凝钩(浙江申达斯奥医疗器械有限公司,型号:SD-310-099)切断束带,以消除肠梗阻症状;对于腹壁切口与肠管之间形成粘连的患者,使用无损伤钳(沈阳沈大内窥镜有限公司,型号:D5017)牵拉肠管,使之与腹壁分离产生空隙,以超声刀或电凝钩切断粘连组织;对于肠管系膜之间形成粘连的患者,用超声刀进行分离处理。手术过程中,若发现患者全层肠壁或肠管浆肌层受损,给予修补处理;若粘连较为广泛、肠管血运较差,且部分组织出现坏死,进行小肠肠段切除治疗。清理粘连组织后,观察腹腔有无渗血,充分止血后使用0.9%氯化钠注射液(济川药业集团有限公司,国药准字H32023269,规格:250 ml∶2.25 g)清洗腹腔,于手术部位放置生物蛋白胶(浙江赛灵特医药科技有限公司,普通型:3.0ml),于肠管上重新覆盖大网膜;若患者术中出血量较多,则留置引流管,术后尽可能减少引流管留置时间。
1.3 观察指标 观察并比较两组临床疗效、手术情况(术中出血量、手术时间、首次排气时间)及并发症(肠漏、感染、出血)发生率。疗效评定标准[5]:患者经治疗,肠梗阻症状完全消除,无明显的阳性体征,未发生肠漏、感染、出血等并发症,为显效;患者经治疗,肠梗阻症状基本消除,阳性体征较治疗前明显改善,存在轻微的肠漏、感染、出血等手术并发症,为有效;患者经治疗,肠梗阻症状未消除,阳性体征未改善,存在显著的肠漏、感染、出血等并发症,为无效。总有效率=显效率+有效率。
1.4 统计学方法 采用SPSS 22.0统计学软件对数据进行分析,计量资料以“±s”表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较 B组治疗总有效率(97.87%)高于A 组(86.96%),差异有统计学意义(P<0.05),见表1。
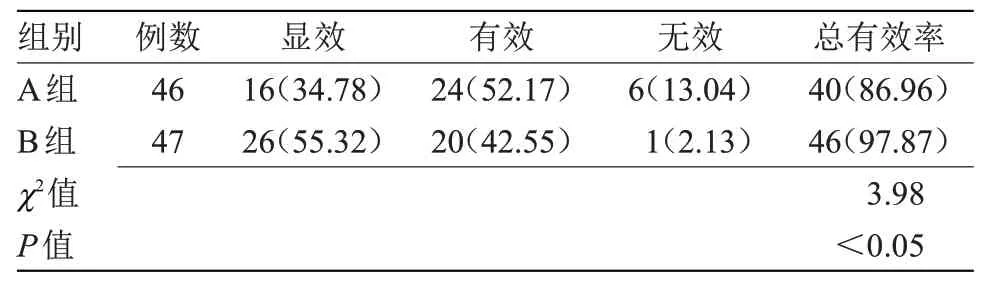
表1 两组临床疗效比较[n(%)]Table 1 Comparison of clinical efficacy between the two groups[n(%)]
2.2 两组手术情况比较 B 组术中出血量少于A组,手术时间及术后首次排气时间均短于A 组,差异有统计学意义(P<0.05),见表2。
表2 两组手术情况比较(±s)Table 2 Comparison of surgical conditions between the two groups(±s)

表2 两组手术情况比较(±s)Table 2 Comparison of surgical conditions between the two groups(±s)
?
2.3 两组并发症发生率比较 B 组并发症发生率(4.26%)低于A组(17.39%),差异有统计学意义(P<0.05),见表3。
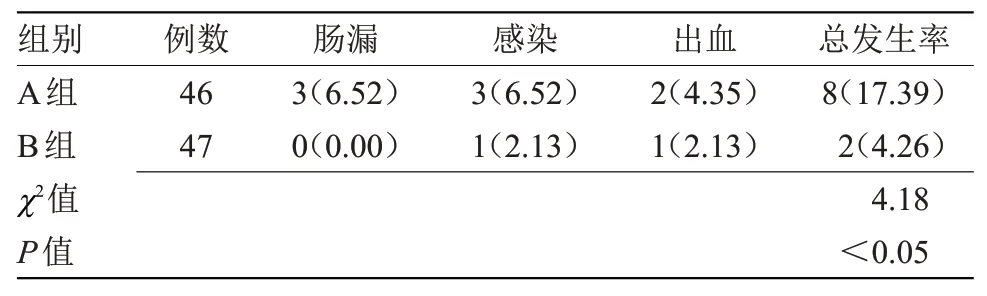
表3 两组并发症发生率比较[n(%)]Table 3 Comparison of the incidence of complications between the two groups[n(%)]
3 讨论
粘连性肠梗阻发生后,大量气体不能排出体外而积聚于肠腔内,引起肠膨胀,导致肠腔内压增高,肠壁变薄,肠壁血循环严重受到影响;且肠腔膨胀时,腹压增高,横膈上升,腹式呼吸减弱,严重时可影响患者的呼吸和循环功能。传统开腹手术虽然能够缓解患者的肠梗阻症状,但创伤较大,患者术后复发风险较高。随着微创理论、技术及器械的发展,腹腔镜手术兼具创伤小、疼痛轻、术后恢复快等优势,在胃肠外科中越来越受到重视。
本研究结果显示,B组术中出血量少于A组,手术时间及术后首次排气时间均短于A组(P<0.05),表明与传统开腹手术比较,腹腔镜手术可减轻对患者的损伤,减少术中出血量,缩短手术时间及首次排气时间,利于术后康复。分析原因为,腹腔镜手术中,建立气腹后能够为手术操作者创造较大的操作空间,且腹腔镜的镜头可放大局部组织,扩大术野,有利于操作者仔细观察粘连部位,进而避免手术分离过程中对周围组织造成较大的损伤。镜下游离组织后行锐性分离,加以局部放大操作提高病理解剖精细度,可最大限度地减少术中出血量、缩短手术时间[6]。与传统开腹手术相比,腹腔镜引导下手术的可视空间较充分,操作者可在缩小腹腔暴露面积的基础上精准定位肠管粘连病灶位置,维持周围肠管旁系膜组织结构完整性;腹腔镜术中将观察孔与操作孔分开、合理控制孔间距,对防止腹壁肠管受损有重要作用。运用腹腔镜锁定粘连较为广泛、肠管血运较差的坏死病灶,能避免术中电凝、牵拉操作破坏正常组织结构完整性。在腹腔镜手术最大限度控制术后肠管受损、降低出血风险的影响下,可促进患者术侧肠管及腹腔生理功能恢复,进而加快其术后胃肠功能恢复进程。
有研究[7]指出,人体腹膜可产生促纤维蛋白溶解的激活因子,使血中的纤溶酶原转变为纤溶酶,从而溶解凝固的纤维蛋白和血浆蛋白,避免血液凝固,但腹膜受创后去纤维蛋白功能下降,经过一系列酶促反应后,导致腹腔内粘连,增加肠梗阻的发生风险。本研究结果显示,B 组治疗总有效率较高于A 组,并发症发生率低于A 组(P<0.05),表明腹腔镜手术疗效显著,可明显减少并发症的发生。腹腔镜治疗粘连性肠梗阻的优势在于,腹腔镜可避开原来粘连紧密的切口进入腹腔,分离粘连,找到引起梗阻的病变组织及部位并松解梗阻;由于腹腔镜进入部位与原切口和病变部位有一定距离,因此发生新粘连的可能性较低,也易于分离原切口的粘连,从而达到微创治疗的目的[8]。腹腔镜手术在保证低创性的前提下,松解粘连腹膜,可迅速重建腹膜抗凝机制,恢复正常纤溶、凝血过程,维持腹腔微循环稳定性,促进肠道能够完成正常的血氧及营养物质转运活动,降低肠梗阻继发风险[9。此外,腹腔镜引导下,可有效控制术侧肠管暴露面积及时长,肠管浆膜层能保持湿润状态,对于维持肠内菌群平衡、阻止异物污染均有重要作用,患者术后不易受到肠内菌群失衡、异物污染等不利因素影响,因此,不易继发感染,且腹腔镜下微创操作减轻手术创伤,患者术后不易继发出血症状[10]。针对全层肠壁或肠管浆肌层受损病灶,于腹腔镜下进行修补,可提高受损组织修复精准性和有效性,避免修补不完全所致术后肠管过度牵拉,降低术后肠漏的可能性。
综上所述,腹腔镜手术治疗粘连性肠梗阻的效果显著,可提高临床疗效,缩短手术治疗时间,有利于减少术中出血量,降低并发症的发生风险,值得临床推广应用。
