甜瓜链格孢菌的鉴定及其CAZymes 活性研究
2022-06-01蒋莉莹曾禹睿慷白羽嘉冯作山
蒋莉莹,曾禹睿慷,白羽嘉,*,冯作山,杨 杉,杨 旭
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆果品采后科学与技术重点实验室,新疆 乌鲁木齐 830052)
新疆拥有着得天独厚的地理优势,夏季最长光照时长达16 h/d,光热资源充足,昼夜温差大,降雨少,极为适合甜瓜的种植,是厚皮甜瓜次生起源中心之一。甜瓜每年的采收期集中在7—8 月,正值夏季炎热高温季节,采后果实迅速后熟衰老、抗病性降低,极易遭受病原菌侵染[1-2]。甜瓜采后微生物侵染引起的病害主要有黑斑病、白霉病、软腐病等[3]。由链格孢菌(Alternaria alternata)引起的黑斑病是甜瓜贮藏期危害性最大、发病率最高的病害[4-5]。甜瓜作为新疆农作物生产量最大的水果之一,只有从根源上找到其受侵染原因,才能从根本上解决其生长及贮藏期间产生黑斑病的问题。
链格孢菌(Alternaria alternata)属真菌,是造成果蔬黑斑病的重要致病菌,可侵染杏[6]、梨[7]、伽师瓜[8]、苹果[9]等水果。链格孢菌菌落为絮状,生长迅速,初期呈白色,老后变暗,侵染水果后,在水果表面形成黑色或深褐色病斑,即黑斑病。致病菌侵染果实所需要突破的第一道防线就是果实的细胞壁,而纤维素和果胶等多糖类物质是植物细胞壁的重要组成成分。因此研究病原菌入侵甜瓜的第一道防线,就是要研究病原菌自身所携带的碳水化合物酶(CAZymes)活性[10]。
目前,就甜瓜遭受病原菌侵染方面的研究大多以甜瓜为主体,研究其发病后内部组织结构变化、酶活特性及基因表达规律[11],但以链格孢菌为主体,其生长特性及其致病酶活性的研究相对较少。本研究从导致甜瓜发病的病原菌本身链格孢为出发点,以甜瓜链格孢菌为主体,研究其在侵染甜瓜过程中的生长规律,及其产生的致病相关酶(多聚半乳糖醛酸酶(PG)、果胶甲酯酶(PME)、纤维素酶(Cx)、β-葡萄糖苷酶(β-Glu))的活性表达,从根本出发,探索链格孢是如何侵入甜瓜组织内部并分析原因,以期为针对性预防黑斑病的发生提供链格孢菌自身酶活特性的理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
新疆喀什市伽师县伽师瓜全生育期112 d,采摘后,经过2%过氧化氢浸泡,于4 ℃贮藏,等待其自然发病备用。
菌株A2015:分离自新疆喀什市伽师县八乡患病伽师瓜;菌株A2018:分离自新疆喀什市伽师县十乡患病伽师瓜;菌株A2019:分离自新疆喀什市伽师县九乡患病伽师瓜;菌株3.18017:购自中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)梨黑斑链格孢(Alternaria gaisen)。
过氧化氢、冰乙酸、无水醋酸钠、氯化钠、多聚半乳糖醛酸、酒石酸钾钠、3,5-二硝基水杨酸、葡萄糖、结晶酚、氢氧化钠、亚硫酸钠、无水乙醇、柠檬酸、柠檬酸钠、羧甲基纤维素钠、水杨苷,以上均为分析纯(AR),购自天津市致远化学试剂有限公司。
马铃薯葡萄糖琼脂(PDA)、孟加拉红琼脂,购自海博生物技术有限公司。
1.1.2 仪器与设备
JH-SCA 型净化工作台,上海鸿都电子科技有限公司;LDZX-50KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;DZKW-S-4 型电热恒温培养箱,北京市永光明医疗仪器厂;TGL-16gR 型冷冻离心机,上海安亭科学仪器厂;TU-1810 系列PC 紫外-可见分光光度计,北京普析通用仪器有限责任公司;DZKW-S-4型电热恒温水浴锅,北京市永光明医疗仪器厂。
1.2 方法
1.2.1 分离
取发病甜瓜,用2%过氧化氢擦拭表面,取甜瓜果实病健交界处组织于PDA 固体培养基平板上,于28 ℃培养3 d。
1.2.2 纯化
取分离菌边缘菌块,分别3 点转接至孟加拉红培养基平板上,于28 ℃培养3 d,再取菌落边缘菌块,3点转接至PDA 培养基平板上,于28 ℃培养7 d。
1.2.3 生长曲线的绘制
采用菌斑直径测量法(十字交叉法)绘制生长曲线。用直径为0.86 cm 的打孔器取一点转接于PDA培养基平板上,28 ℃培养,分别于0、1、2、3、4、5、6、7 d测量菌斑直径,重复3 组,绘制生长曲线。
1.2.4 形态学鉴定
菌落形态观察:将供试菌株接种于PDA 培养基上,3~5 d 后用直径为0.86 cm 的无菌打孔器切取菌落边缘菌丝团块,转接于PDA 培养皿中,于28 ℃恒温培养7 d 后,测量菌落直径大小,拍照并记录菌落颜色及形态[12]。
孢子形态观察:挑取在PDA 培养基上生长3~5 d的供试菌株菌丝制成玻片,显微镜下观察菌体形态,拍照并记录其分生孢子形态、色泽等[13]。
1.2.5 酶液的提取
参照曹建康等[14]的方法并稍作修改。准确称取0.20 g 菌体,置于预冷的研钵中,加入2 mL 预冷的醋酸钠缓冲液,在冰浴条件下研磨匀浆后,低温放置20 min,12 000 r/min 离心20 min,取上清液,即为酶液,于4 ℃保存备用。
1.2.6 CAZymes 活性的测定
多聚半乳糖醛酸酶、纤维素酶及β-葡萄糖苷酶活性:均参照曹建康等[14]的方法测定;果胶甲酯酶活性:参照Li 等[15]的方法测定。在整个菌体培养过程中,由于菌体生长速度慢,且菌体质量轻,在其培养1~2 d 时,菌体质量过于微小,不足以取样以测定酶活,因此取样时间为3~9 d,故酶活测定时间为3~9 d。
1.2.7 数据处理
采用Origin2019 进行图表绘制,IBMSPSSStatistics 20 进行显著性分析。
2 结果与分析
2.1 形态学鉴定
根据《中国真菌志》第十六卷[16]链格孢属的相关描述,A2015、A2018、A2019 三个菌株被鉴定为链格孢属(Alternaria Nees)。它们在PDA 培养基上的菌丝都较为松散,初生菌丝白色,菌落呈灰绿色、灰白色或黄褐色至褐色;分生孢子梗单枝或丛生;分生孢子呈倒棍棒形,黄褐色至褐色,孢身(17.5~40.0)μm×(7.5~15.0)μm,喙呈柱状或锥状,(6~20)μm×(2.5~5)μm,具横隔2~6 个,纵(斜)隔0~5 个。菌株3.18017 为梨链格孢(Alternaria gaisen),菌株A2015、A2018 从菌落形态上观察明显区别于A2019 和3.18017(图1),菌株A2015 呈黄褐色,A2018 呈深褐色,而A2019 呈灰白色,3.18017 呈灰绿色。
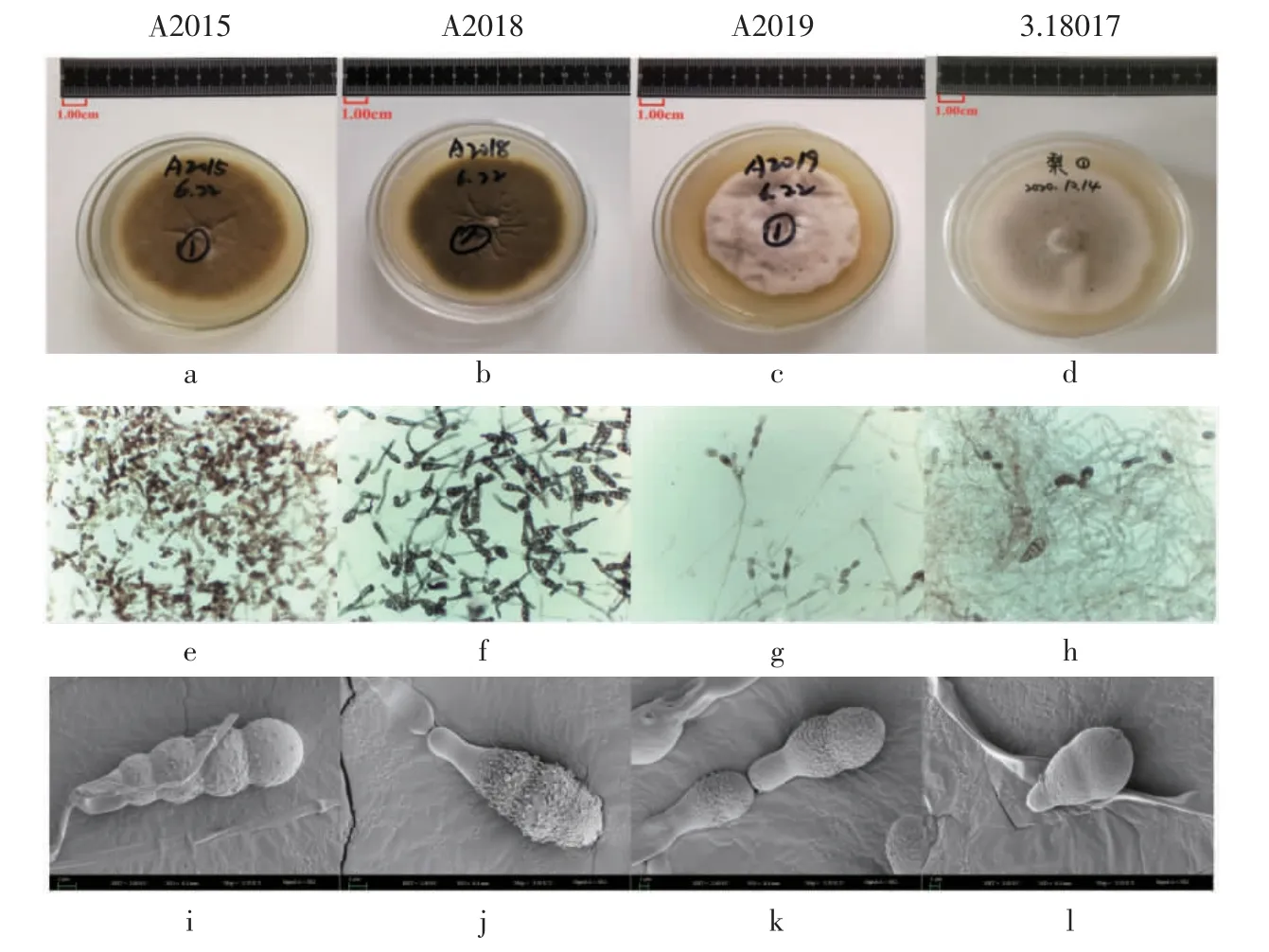
图1 菌株A2015、A2018、A2019、3.18017 的孢子及菌落形态Fig.1 Spore and colony morphology of strains A2015,A2018,A2019 and 3.18017
2.2 不同链格孢菌的生长曲线
图2 为4 株链格孢菌的生长曲线。由图2 可见,菌落直径呈逐渐增大的变化趋势,培养4 d 时,生长趋势开始出现明显的差异,对比其他3 种菌株,A2019 的生长趋势低于其他菌株;于28 ℃培养7 d,菌株A2015、A2018、A2019 和3.18017 菌落直径分别为7.77、7.55、6.66、7.36 cm。说明链格孢菌A2015、A2018、A2019 和3.18017 在生长趋势上存在一定的差异。

图2 链格孢菌生长曲线Fig.2 Growth curve of Alternaria
2.3 不同链格孢菌多聚半乳糖醛酸酶活性比较
由图3 可见,菌株A2015、A2018、A2019 和3.18017在培养期间PG 活性总体呈降低的变化趋势,链格孢自身能够产生大量PG,对甜瓜进行初步侵染后,开始降解细胞壁中果胶成分,而后引起甜瓜自身细胞壁代谢的加速,导致甜瓜自身PG 活性不断增加[17]。菌株A2015、A2018、A2019 和3.18017 培养3 d时,PG 活性分别为20 924.25、17 439.85、14 119.82、19 342.79 μg·h-1·g-1FW,且差异具有显著性(P<0.05);培养5~6 d 时,菌株A2015 和A2018 的PG 活性以相同的趋势急速下降,菌株A2019 和3.18017 则呈缓慢下降的趋势;培养6~9 d 时4 种菌株的PG 活性变化趋于平缓,培养6 d 时,菌株A2015、A2018、A2019和3.18017 酶活性分别为3 689.82、2081.36、8006.12、11 515.09 μg·h-1·g-1FW,且具有显著性差异(P<0.05)。

图3 不同链格孢菌多聚半乳糖醛酸酶活性变化Fig.3 Changes of polygalacturonase activity of different Alternaria
2.4 不同链格孢菌果胶甲酯酶活性比较
由图4 可见,在培养期间,菌株A2015、A2018、A2019 和3.18017 的PME 活性均呈先上升后下降的趋势,并且在培养第7 天时达到峰值,分别为0.23、0.24、0.20、0.21 μg·h-1·g-1FW,其中菌株A2018 的PME 活性最高,为0.24 μg·h-1·g-1FW,此时菌株A2015 和A2018 的PME 活性在峰值时明显高于菌株A2019 和3.18017。培养7~9 d,4 种菌株PME 活性均呈现急速下降的趋势,且菌株A2015 和A2018 的下降趋势明显大于菌株A2019 和3.18017。与朱婉彤等[18]的研究结果相似,甜瓜在采后自身的细胞壁代谢加快,导致PME 活性逐渐升高,而链格孢菌的侵染则加速了这一进程,使细胞壁迅速被降解,为链格孢在甜瓜组织内部侵染创造有利条件。

图4 不同链格孢菌果胶甲酯酶活性变化Fig.4 Changes of pectin methylesterase(PME)activity of different Alternaria
2.5 不同链格孢菌纤维素酶活性比较
纤维素是甜瓜果皮含量最高的组成成分,也是甜瓜抵抗外来微生物侵染最有效的组织成分,因此链格孢本身会产生大量纤维素酶来突破防线。由图5 可见,菌株A2015、A2018、A2019、3.18017 在培养期间Cx 活性总体呈先升高后降低的变化趋势,菌株A2015、A2019、3.18017 的Cx 活性在6 d 时出现峰值,分别为222.71、250.20、227.71 μg·h-1·g-1FW,三者间具有显著性差异(P<0.05);A2018 的Cx 活性在8 d 时出现峰值,为192.72 μg·h-1·g-1FW。

图5 不同链格孢菌纤维素酶活性变化Fig.5 Changes of cellulase(Cx)activity of different Alternaria
2.6 不同链格孢菌β-葡萄糖苷酶活性比较
由图6 可以看出,菌株A2015、A2018、A2019、3.18017 在培养期间β-Glu 活性总体呈先升高后降低的变化趋势,随着培养时间的不断延长,β-Glu活性不断升高,在第6 天时达到酶活峰值,分别为2 121.13、2 408.54、8 619.21、4 670.38 μg·h-1·g-1FW,随后活性降低,菌株A2019 的β-Glu 活性在第6 天时明显高于其他3 种菌株,是菌株A2015 的4.06 倍,菌株A2018 的3.58 倍,菌株3.18017 的1.85 倍,呈现显著性差异(P<0.05)。而菌株A2015 和A2018 较A2019 和3.18017 而言上升和下降的趋势较为平缓。

图6 不同链格孢菌β-葡萄糖苷酶活性变化Fig.6 Changes of β-glucosidase(β-Glu)activity of different Alternaria
3 结论与讨论
上述试验结果表明,经形态学鉴定,由甜瓜黑斑病病斑中分离出的3 个菌株A2015、A2018、A2019 均为链格孢属真菌。虽然分离出的3 个菌株和3.18017均为链格孢属真菌,但其在生长特性上存在着显著差异。首先从菌落颜色上看,A2015 和A2018 均呈现褐色,而A2019 呈现出灰白色,3.18017 则为灰绿色;再从生长曲线上看,各菌株生长至第4 天时出现明显差异。由此可见,不同产区被侵染的甜瓜病斑中分离出的病原菌有所不同,这也有可能导致了在甜瓜采摘后,防治此类病原菌入侵过程中的针对性有所差异。
植物细胞的细胞壁是病原菌进入寄主细胞需要克服的第一道结构[19],因此,链格孢菌在侵染甜瓜的过程中首先会产生降解细胞壁主要成分物质的酶。本试验通过对链格孢菌自身所携带的此类酶活性的测定来确定链格孢菌在侵染过程中细胞壁降解酶活力大小,从而进一步分析出在链格孢菌侵染甜瓜过程中是如何穿过防线侵染瓜体。研究结果表明,链格孢菌在生长过程中,首先产生最多的为多聚半乳糖醛酸酶,以此来分解甜瓜果皮中的多聚半乳糖醛酸,其次纤维素酶和β-葡萄糖苷酶在第6 天时活性达到最高,果胶甲酯酶的含量在第7 天时达到最高,说明链格孢菌在侵染甜瓜时是由此顺序,互相协调作用于甜瓜,逐步入侵甜瓜内部,导致甜瓜产生黑斑病。此研究结果可为后期针对性防治黑斑病以及甜瓜抵御链格孢的入侵提供病原菌自身特性的理论基础。
