20例肾上腺皮质癌的手术治疗及预后分析
2022-06-01李玉黄涛刘骋谈宜傲刘树瀚
李玉 黄涛 刘骋 谈宜傲 刘树瀚
肾上腺皮质癌(adrenocortical carcinoma, ACC)是一种罕见的发生在肾上腺皮质的内分泌恶性肿瘤,其恶性度高,侵袭性强,发现时多处于中晚期,且术后复发率高,预后差,死亡率高。由于其发病率低,临床研究少,临床诊治经验相对欠缺。本文旨在通过回顾性分析中国科学技术大学附属第一医院2015年9月至2020年7月收治的20例术后病理证实为ACC患者的电子病历及随访资料,包括患者的一般资料、临床特征、治疗及预后情况,并总结其手术治疗及预后因素,以期为ACC的临床治疗提供一些借鉴。
对象与方法
一、一般资料
回顾性分析2015年9月至2020年7月中国科学技术大学附属第一医院诊治的ACC患者的临床资料。纳入标准:接受肾上腺切除术且病理证实为ACC的患者, ACC病理诊断按照Weiss评分标准打分,3分及以上归为恶性[1]。排除标准:①合并其他恶性肿瘤;②合并自身免疫性疾病、严重心肺疾病或明显影响临床预后的其他疾病;③术前经外院穿刺活检证实ACC,已行放化疗或其他辅助治疗者。共20例患者纳入研究。通过查询电子病历获取各项临床资料,包括患者的年龄、性别、肿瘤部位、肿瘤最大径、肿瘤分期、手术切缘、实验室检查(白蛋白、血糖、血钾)、病理结果及Ki-67等资料。通过门诊或电话随访,收集患者术后治疗、疾病进展、生存状况等相关信息。患者手术出院后第1年每3个月随访1次,以后每6个月随访1次,直至患者死亡或最后一次随访。
二、评价标准
ACC分期采用欧洲肾上腺肿瘤研究网络(European Network for the Study of Adrenal Tumours, ENSAT)分期系统,Ⅰ期:肿瘤局限于肾上腺,直径≤5 cm;Ⅱ期:肿瘤局限于肾上腺,直径>5 cm;Ⅲ期:肿瘤侵犯周围组织,发生区域淋巴结转移,或者腔静脉/肾静脉有瘤栓形成;Ⅳ期:肿瘤发生远处转移。
总生存期(overall survival, OS)指从手术开始至死亡的时间,或至最后一次随访时间。无疾病进展生存期(progression-free survival, PFS)指的是手术开始至肿瘤发生任意进展,或至死亡的时间。
切缘状态R0:切缘无肉眼或显微镜下可见肿瘤残留;R1:显微镜下见切缘肿瘤残留;R2:肉眼可见肿瘤残留。
三、治疗方法
积极完善术前检查,评估手术指征,排除手术禁忌后,对内分泌检查指标升高或怀疑存在隐匿性功能性嗜铬细胞瘤的患者,术前予以扩管降压,补液扩容;对于低血钾患者予以口服螺内酯,补钾治疗;术后根据患者病情适量补充糖皮质激素预防肾上腺危象的发生,逐渐减量停药或小剂量维持。20例均行手术治疗,开放手术14例,其中2例由腹腔镜手术中转开放手术;腹腔镜手术6例。14例R0切除,4例R1切除,2例R2切除。对于肿瘤分期Ⅱ~Ⅳ期,或切缘阳性,且愿意接受辅助治疗的患者,共有7例予以辅助治疗(表1)。

表1 7例ACC患者术后辅助治疗情况
四、统计学方法
结 果
本组20例患者中,男9例,女11例;年龄35~82岁,中位年龄58.5岁;肿瘤位于左侧13例,右侧7例;肿瘤最大径4.6~17.0 cm,中位最大径为12.5 cm,其中1例为多发肿瘤。因体检发现肾上腺占位10例,因腹部或腰部疼痛就诊9例,1例因食欲减退检查发现肾上腺占位。患者临床特征见表2。

表2 20例ACC患者的临床特征
20例ACC全部获得随访,随访时间3~68个月,平均随访时间(28.5±19.7)个月,末次随访时间为2021年5月31日。至随访结束,20例患者中存活13例,中位生存时间37.0个月。有4例出现肿瘤复发或转移,其中2例予以再次手术治疗;1例术后24个月局部复发予以再次手术切除后,至今无复发、转移;另1例术后13个月出现局部复发及肝脏转移,予以再次手术切除复发及肝脏转移灶,2个月后新发肝脏转移灶,予以介入治疗和化疗。死亡7例,中位生存时间7.0个月。1例术后3个月死亡,另6例均出现肿瘤复发或转移,病情发生进展至死亡。
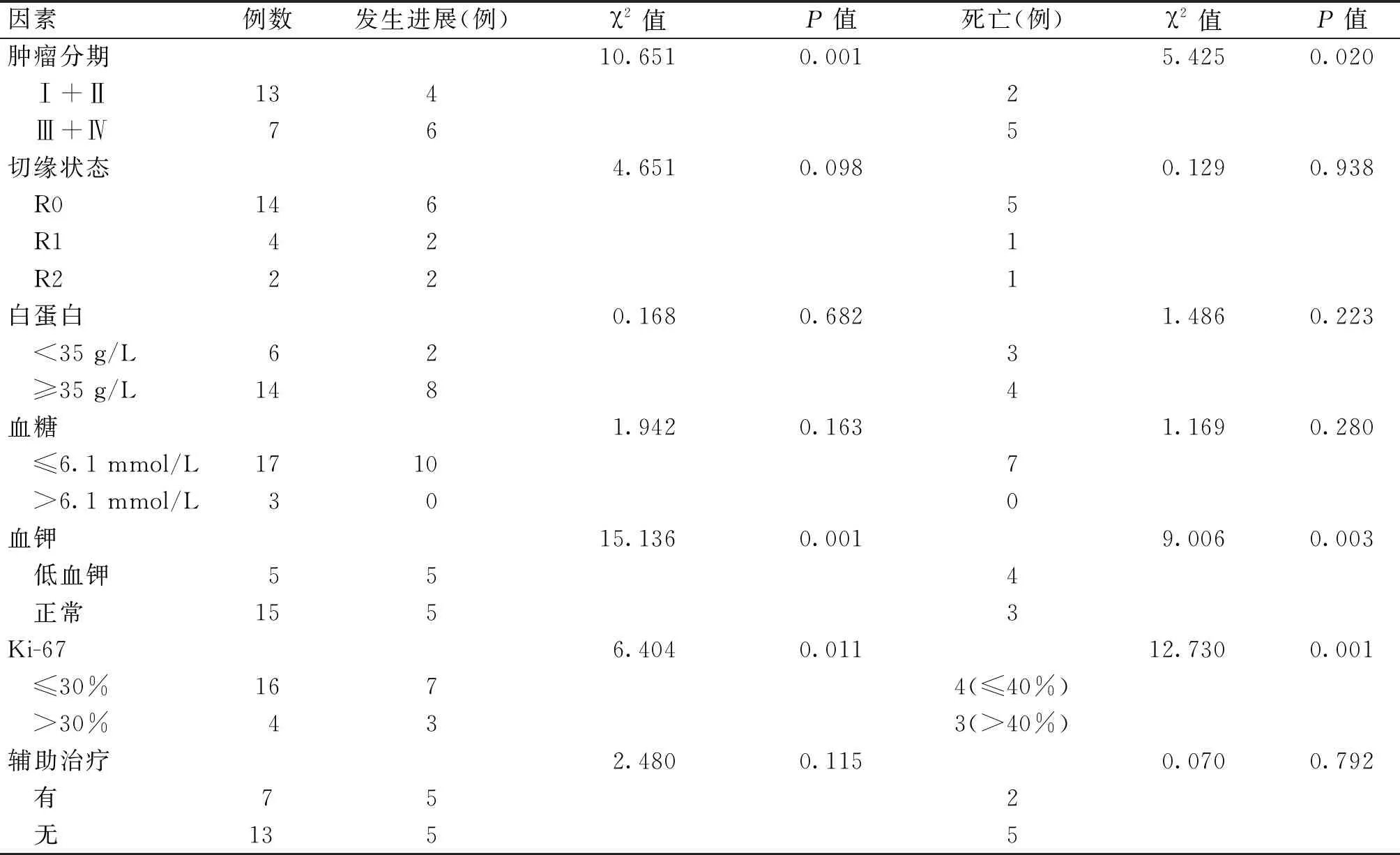
将患者年龄、性别、肿瘤部位、肿瘤最大径、肿瘤分期、手术方式、切缘状态、白蛋白、血糖、血钾、Ki-67值、有无辅助治疗纳入单因素分析(表3)。应用R语言survminer包中的surv_cutpoint函数计算求得Ki-67对应PFS及OS的预后最佳截断值分别为30%和40%。单因素分析提示肿瘤分期(χ2=10.651,P=0.001;χ2=5.425,P=0.020)、血钾(χ2=15.136,P=0.001;χ2=9.006,P=0.003)、Ki-67值(χ2=6.404,P=0.011;χ2=12.730,P=0.001)是影响患者疾病进展及预后的因素(生存曲线见图1)。
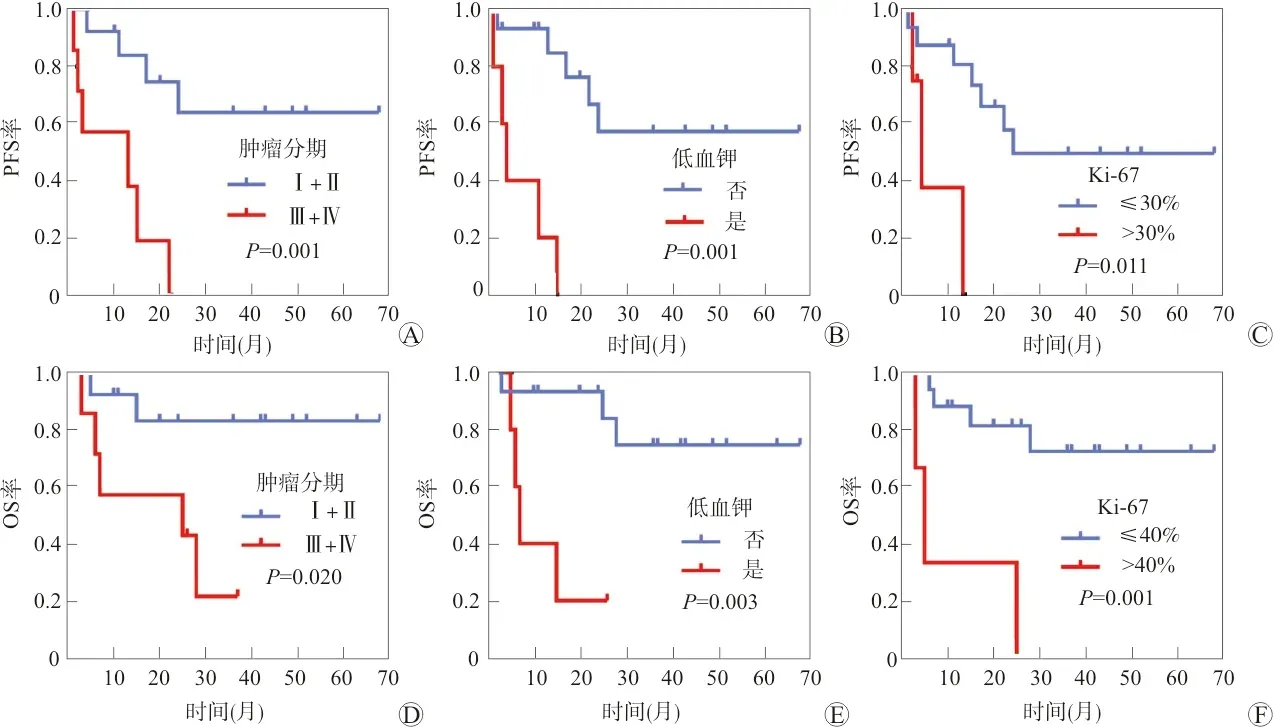
A:肿瘤分期与PFS;B:低血钾与PFS;C:Ki-67与PFS;D:肿瘤分期与OS;E:低血钾与OS;F:Ki-67与OS

表3 影响患者术后OS、PFS的单因素分析
多因素Cox回归分析提示,肿瘤分期晚(HR=5.973,P=0.039)、低钾血症(HR=18.183,P=0.007)、高Ki-67(>30%)值(HR=10.889,P=0.027)的患者无疾病进展时间短(表4);低钾血症(HR=19.826,P=0.011)、高Ki-67(>40%)值(HR=25.721,P=0.006)的患者死亡风险增加(表5)。
续表3 影响患者术后OS、PFS的单因素分析
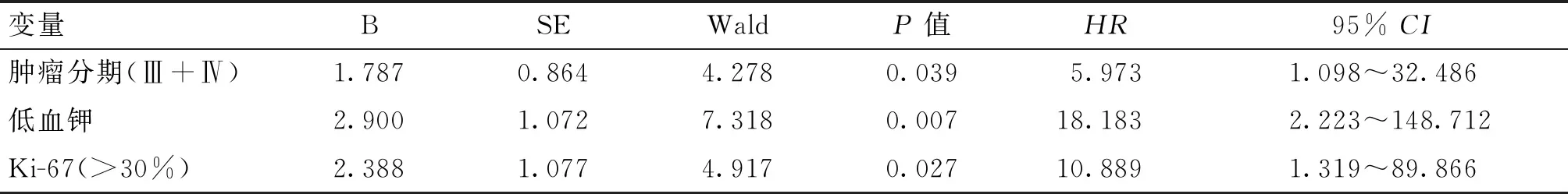
表4 影响ACC术后PFS的多因素Cox回归分析

表5 影响ACC术后OS的多因素Cox回归分析
讨 论
ACC是一种侵袭性较强的内分泌恶性肿瘤,病因尚不明确,好发于40~50岁成年人或<5岁的儿童,欧美国家流行病学数据显示男女发病比例约为1∶1.2~1.3[2-3],本组患者男女发病比例为1∶1.22。ACC早期临床症状不典型,本组20例患者中,肿瘤分期(ENSAT)Ⅰ期1例,Ⅱ期12例,Ⅲ期6例,Ⅳ期1例。其中10例因体检发现肾上腺占位,9例患者主诉疼痛,另有1例患者因主诉食欲减退检查发现肾上腺占位。可见,ACC早期多无明显临床症状,到发现时多处于中晚期。
治疗ACC的手术方式主要包括开放肾上腺切除术(open adrenalectomy, OA)和腹腔镜肾上腺切除术(laparoscopic adrenalectomy, LA)。1992年Gagner首次提出LA,随着腹腔镜手术的普及,越来越多的证据表明,LA治疗局限性ACC患者与传统开放手术一样有效[4-5]。但是,ACC的腹腔镜手术治疗仍然存在一定争议[6-8]。LA与OA相比,初次手术的阳性切缘风险增加,术后腹膜腔复发的风险增加[7]。Zheng等[8]通过比较OA与LA的近期预后,发现接受OA治疗的ACC患者无病生存期(disease free survival, DFS)及2年DFS均优于接受LA治疗者。虽然对于肿瘤直径<10 cm且周围无明显浸润证据的Ⅰ期或Ⅱ期ACC,LA是一个可行选择[9],但当术中发现肿瘤浸润或操作比较困难时,应及时中转开放手术。本研究中OA 14例,LA 6例,2例由腹腔镜中转开放手术,单因素分析显示手术方式对预后的影响差异无统计学意义。
ACC患者即使行根治性切除后,约2/3的患者会出现局部复发或远处转移,最常见的复发部位是肿瘤床,最常见的转移部位为肺部和肝脏[7,10]。密妥坦是美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)批准用于晚期ACC治疗的药物,可使肿瘤缩小,控制激素分泌,缓解肾上腺皮质功能亢进状态,延长生存期。目前公认推荐的晚期ACC一线治疗是依托泊苷、阿霉素、顺铂(EDP)化疗和密妥坦联合治疗。但由于密妥坦在国内未上市,本组中有3例患者口服密妥坦药物均为香港或境外购买,价格昂贵,药物可及性差,且需定期复查血、尿皮质醇、血药浓度,调整药物剂量,患者依从性差,3例患者中有2例出现明显药物不良反应,如胃肠道不适伴腹泻、神经毒性,通过停药或减量后症状有所缓解。对于晚期ACC的化疗,由于不同医院、科室的差异性以及肿瘤多学科诊疗的不规范性,导致化疗方案不统一、疗程不足,这些均限制了密妥坦和EDP化疗在晚期ACC的使用。对于复发病例进行再次手术切除仍然是可行选择。多项研究显示,对于孤立性肿瘤,无病间隔期>12个月,其局部复发或肺部转移灶进行再次切除术,可延长患者生存期,而超过3次手术的患者预后无明显改善[7,11]。杨华安等[12]认为对ACC术后原位复发患者复发灶行扩大切除可改善患者生存,但远处转移患者原位复发病灶的切除对患者生存无获益。本组50%的ACC患者术后出现肿瘤局部复发或远处转移,2例行再次手术治疗;1例术后24个月局部复发予以再次手术切除,未予以辅助治疗,至今仍未见复发及转移,OS时间为42个月;另1例术后13个月出现腹膜后复发及肝脏转移,予以再次手术切除复发及转移病灶,2个月后复查发现肝脏新转移灶后予以介入微波消融、无水乙醇消融术及化疗,现转移病灶控制稳定,存活至今,OS时间为37个月。
由于ACC发病罕见,大样本量的临床研究较少,各项临床研究中ACC的预后因素有所不同。李少华等[13]研究发现,合并皮质醇高分泌、低钾血症的ACC患者预后不良,且在18例行根治性切除术的患者中,合并低钾血症的ACC患者肿瘤复发风险增加。本研究亦发现低钾血症与患者PFS及OS预后不良相关,这可能与以下因素有关:①ACC患者营养状态差,长期纳差导致低钾血症,导致术后预后差;②钾离子通道与肿瘤细胞的分化、增殖、凋亡密切相关[14-15],而血清钾离子浓度可通过钾离子通道调节细胞内外钾离子浓度,进而影响肿瘤的发生、发展;③约50%的ACC具有内分泌功能[16],该类患者术后预后差[13,17],其分泌的糖皮质激素及盐皮质激素,均有可能导致低钾血症。
ACC的预后与肿瘤分期密切相关。本研究单因素分析提示肿瘤分期晚的患者术后PFS、OS时间缩短,多因素Cox回归分析提示肿瘤分期与PFS相关,这与Ayala-Ramirez等[18]的研究结果相似。肿瘤分期越晚,意味着更高的肿瘤负荷以及手术阳性切缘可能性增大,导致患者术后更容易复发及转移。
Ki-67是一种参与细胞增殖和有丝分裂纺锤体调节的蛋白质,与有丝分裂活性和形态学指数相关[19],其不仅有助于区分肾上腺皮质腺瘤与皮质癌,且能预测肿瘤侵袭性和ACC患者的预后[20]。Ki-67表达的增加与ACC患者预后较差和生存期较短有关[21]。一项多中心关于局限性ACC预后标志物的研究证实,Ki-67是根治切除术后预测复发的最重要指标[22]。Zhang等[23]研究发现,Ki-67表达增加与ACC患者OS和无复发生存期(recurrence free survival, RFS)呈负相关,Ki-67指数以20%和3%作为OS和RFS的独立预后因素。本研究中影响PFS及OS预后的Ki-67最佳截断值分别为30%和40%,这可能与样本量相对少,且大部分肿瘤恶性度高、Ki-67值高有关。总之,Ki-67已广泛应用于肿瘤的诊断,是ACC患者可靠的预后指标。
综上所述,ACC是一种侵袭性很强的肿瘤,其治疗具有挑战性,根治性手术切除是治疗该病的有效方式。肿瘤分期晚、高Ki-67值、低钾血症的患者术后疾病进展快,且高Ki-67值、低钾血症的患者预后更差。针对此类ACC患者,应当制定更精准的肿瘤多学科诊疗方案。当然,本研究尚存在一定局限性,ACC临床罕见,本研究为单中心回顾性研究,样本量少,运用Cox回归模型进行多因素分析存在一定误差,尚需多中心大样本的临床研究进一步验证。
