BTH处理对火龙果采后抗病性及贮藏品质的影响
2022-06-01鲍远放张绿萍
鲍远放,张绿萍,郑 伟,王 彬
(1贵州大学农学院,贵阳 550025;2贵州省农业科学院果树科学研究所,贵阳 550006)
0 引言
火龙果(Hylocereus undulates)又名吉祥果、红龙果等,仙人掌科量天尺属植物,为典型的热带亚热带水果[1]。因果实中含有丰富的营养物质深受人们的喜爱[2-3]。随着火龙果种植面积的不断增加,采后病害呈现逐渐加重的趋势,其中以桃吉尔霉为致病菌的果腐病尤为突出,具有发病速度快、侵染能力强的特点,从而严重影响火龙果果实采后品质。红肉火龙果采后极易腐烂,鲜果供应期短,夏季一般采后3天鳞片黄化萎蔫,7天便开始腐烂,火龙果采后贮藏保鲜技术成为制约产业发展的一大难题[4]。目前,化学农药仍是控制火龙果采后病害的主要方法,但是长期使用化学药剂不但使病原菌产生抗药性,而且会对环境和人体健康产生一定影响。传统的杀菌剂使用具有一定的污染性,与绿色环保理念相悖,植物抗病诱导剂具有高效、无毒、无污染的特性,而BTH(benzothiadiazole,苯并噻二唑)是一种典型的植物抗病诱导剂,离体条件下无杀菌活性,但能够诱导植物的免疫活性,起到抗病、防病的作用,是火龙果的采后保鲜研究新方向[5-6]。前人对BTH 的研究涉及厚皮甜瓜[7]、苹果[8]、荔枝[9]、桃[10]、香蕉[11]、梨[12]等,但在火龙果上的应用暂未见报道。本研究以火龙果‘软枝大红’为试验材料,研究采后BTH处理对火龙果果实抗病性及贮藏品质的影响,以期提高火龙果采后贮藏品质,增强贮藏期抗病性,延长贮藏期,为BTH在火龙果采后贮藏期的应用提供理论支持。
1 材料与方法
1.1 材料
试验材料‘软枝大红’于2020年10月28日采于贵州省罗甸县罗悃镇,采后立即运到贵州省果树科学研究所实验室,选取大小均匀、无机械损伤、无病斑、色泽、成熟度基本一致的果实备用。
BTH购于Sigma-Aldrich公司,Tween-80购于Aladdin公司,分析纯。桃吉尔霉(Gilbertella persicaria)由贵州省农业科学院果树科学研究所提供。超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、过氧化物酶(POD)试剂盒、丙二醛(MDA)试剂盒、多酚氧化酶(PPO)试剂盒、苯丙氨酸解氨酶(PAL)试剂盒、几丁质酶(CHI)试剂盒、β-1,3-葡聚糖酶(GLU)试剂盒均购于上海桥杜生物科技有限公司。
1.2 方法
1.2.1 处理和接种 BTH设5个质量浓度,为0、50、100、150、200 mg/L(均含 0.05% Tween-80),其中以含0.05% Tween-80的清水为对照,火龙果于不同浓度的BTH溶液浸泡3 min,每个处理挑选150个果实,果面完全浸没,沥干后随机分成3组,分别用于接种、腐烂情况观察和取样。贮藏和取样的果实置于室温下贮藏。
经处理的火龙果果实进行表面消毒后,采用刺伤法接种,接种浓度为1×106CFU/mL桃吉尔霉孢子悬浮液10 μL,覆盖浸润的灭菌棉24 h,将火龙果置于室温下观察病斑情况。
1.2.2 病情指数和贮藏期腐烂率观察 每天观察其发病情况,自发病起,每2天采用十字交叉法记录病斑直径。每个处理接种15个火龙果,重复3次。

式中,d表示病斑直径。
自发病起,每2天记录病情指数。每个处理接种15个火龙果,重复3次。参照曾凯芳等[13]和弓德强等[14]的标准进行分级。0级,未发病;1级,病斑面积占果实面积≤5%;2级,5%<病斑面积占果实面积≤15%;3级,15%<病斑面积占果实面积≤30%;4级,30%<病斑面积占果实面积≤50%;5级,病斑面积占果实面积>50%。病情指数(disease index,DI)的计算如式(2)。

式中,X为病情级数(0~5),Nx为相应级别病果的个数。
以果实表面出现直径>0.5 cm的病斑或多个病斑为腐烂的标准,出现腐烂果后,每2天观察记录1次,并及时清理腐烂的果实。
1.2.3 品质测定及生化指标测定 从采收当天起,每3天取样测定1次。每次随机选取9个果实,以3个果实为1组重复,重复3次,分离果皮和果肉,切片后立即用液氮速冻处理,最后置于-80℃冰箱中保存用于品质及生化指标的测定。根据病斑直径、病情指数和贮藏期腐烂率的变化规律筛选出效果最佳的BTH处理浓度,随后测定对照和最佳的BTH浓度处理组的品质及生化指标来进一步检验该浓度对火龙果采后抗病性及贮藏品质的影响。
总糖含量采用蒽酮比色法测定。可滴定酸含量采用酸碱滴定法测定,以苹果酸计。SOD、CAT、POD、MDA、PPO、PAL、CHI、GLU采用酶联免疫法试剂盒,具体方法如下:称取0.1g的果皮冷冻粉末,加入0.9mLPBS(pH 7.4,浓度为0.05 mol/L)匀浆液匀浆,4℃ 3000 r/min离心15 min后取上清液,按试剂盒方法加入标准品和样品,加入100 μL酶标试剂,37℃恒温孵育60 min,随后洗板5次,加入50 μL底物A、50 μL底物B,在37℃恒温箱中避光孵育15 min,加入终止液50 μL,于15 min内在450 nm处测出OD值。在37℃下,以每克鲜样每分钟在反应体系中使OD450变化0.01为1个酶活单位(U),以上指标测定均重复3次。
1.3 数据统计与分析
采用Excel软件以及SPSS 19.0软件进行作图和统计分析。
2 结果与分析
2.1 采后BTH处理对火龙果病斑面积变化的影响
由图1A可知,BTH浸泡处理可以提高采后火龙果果实抗桃吉尔霉能力,降低火龙果的病斑面积,接种后1天时50、100、150 mg/L BTH处理组的病斑面积分别比对照低30.59%、47.62%、26.93%,200 mg/L BTH处理与对照无显著性差异;接种后3天时均呈显著性差异,处理组的病斑面积分别比对照低41.25%、60.57%、40.35%、36.23%;接种后5天时处理组与对照均呈显著性差异,此时处理组的病斑面积分别比对照低28.61%、60.57%、40.35%、36.23%;接种后7天时处理组的病斑面积分别比对照低22.63%、42.35%、21.45%、12.72%。除接种后1天时100 mg/L与50 mg/L BTH处理组无显著性差异,其余时期100 mg/L BTH处理与各处理组间均呈显著性差异。在接种期内综合来看,100 mg/L BTH处理对火龙果病斑面积扩大的抑制效果最好。
由图1B可知,采后BTH浸泡处理可以显著降低火龙果接种桃吉尔霉后的病情指数,50、100、150、200 mg/L BTH处理组在接种后3天时的病情指数分别比对照低21.15%、36.54%、19.23%、13.46%,5天时的病情指数分别比对照低20.80%、30.40%、19.20%、16.80%,7天时的病情指数分别比对照低22.00%、25.33%、12.00%、8.67%,9天时的病情指数分别比对照低19.39%、23.47%、18.88%、9.18%。100 mg/L BTH处理组仅在接种后7天和9天时与50 mg/L BTH处理组无显著性差异,其余时期与各处理组间均呈显著性差异。在接种期内综合来看,100 mg/LBTH处理对火龙果病情指数增加的抑制效果最好。

图1 采后BTH处理对火龙果果实接种桃吉尔霉后病斑面积和病情指数变化的影响
2.2 采后BTH处理对火龙果贮藏期间腐烂率变化的影响
由图2可知,采后适宜浓度的BTH浸泡处理能延后火龙果贮藏期间开始腐烂的时间、降低腐烂率以及延长贮藏时间。处理组比对照延后2天开始出现腐烂,于15天开始出现腐烂,贮藏期间其腐烂率均低于对照。200 mg/L BTH处理组比对照延后2天全部腐烂,50、100、150 mg/L BTH处理组均比对照延后4天全部腐烂。综合整个贮藏期的腐烂率变化情况,可以得出100 mg/LBTH处理效果最好。

图2 采后BTH处理对火龙果贮藏期间腐烂率变化的影响
2.3 采后BTH处理对贮藏期间火龙果果肉总糖含量及可滴定酸的影响
由图3A可知,对照和100 mg/L BTH处理火龙果果肉总糖含量在贮藏期间均呈先上升再下降的趋势。除贮藏9天和12天时,在整个贮藏过程中BTH处理组的果实总糖含量均显著高于对照。3天时,对照和处理组总糖含量均达到峰值,处理组总糖含量比对照高7.30%。至贮藏18天时,对照总糖含量下降了29.77%,处理组总糖含量下降了22.49%(P<0.05)。
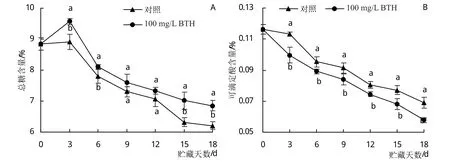
图3 采后BTH处理对火龙果贮藏期间总糖含量和可滴定酸含量变化的影响
由图3B可知,对照和100 mg/L BTH处理火龙果果肉可滴定酸含量在贮藏期间均呈下降趋势。在整个贮藏过程中BTH处理组的果实可滴定酸含量均显著低于对照组。至贮藏18天时,对照可滴定酸含量下降了40.62%,处理组可滴定酸含量下降了50.24%(P<0.05)。
上述结果表明,采后100 mg/L BTH处理可以提高贮藏期火龙果的总糖含量和降低可滴定酸含量。
2.4 采后BTH处理对贮藏期间火龙果果皮抗氧化酶活性的影响
火龙果贮藏期间果皮SOD活力的变化如图4A所示,对照和处理组均呈先上升后下降的趋势。BTH处理组火龙果果皮的SOD活力始终高于对照,对照在3天时SOD活力达到最大值,处理组在6天时SOD活力达到最大值,为136.80 U/mL,比同期对照高13.15%(P<0.05)。
火龙果贮藏期间果皮CAT活力的变化如图4B所示,BTH处理组的CAT活力始终高于对照,在整个贮藏期间,对照CAT活力呈先上升后下降的趋势,在6天时CAT活力达到峰值;处理组在3天时CAT活力达到峰值,9天时CAT活力达到最低值。贮藏18天时,对照组和处理组CAT活力差异最大,此时处理组CAT活力比对照高24.89%(P<0.05)。
火龙果贮藏期间果皮POD活力的变化如图4C所示,BTH处理组的POD活力显著高于对照,在整个贮藏期间,对照和处理组POD活力均呈先上升后下降的趋势,均在贮藏3天时达到峰值,此时处理组POD活力比对照高19.45%(P<0.05)。

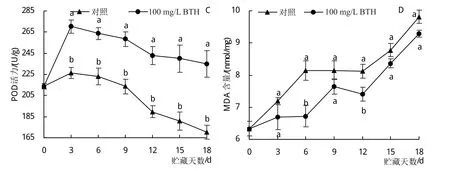
图4 采后BTH处理对贮藏期间火龙果果皮抗氧化酶活性的影响
火龙果贮藏期间果皮MDA含量的变化如图4D所示,BTH处理组的MDA含量始终低于对照,在整个贮藏期间,对照和处理组MDA含量均呈上升趋势。贮藏0~6天,对照MDA含量呈急速上升趋势。处理组在贮藏6~9天时才开始第一个急速上升趋势。贮藏6天时,处理组和对照MDA含量差异最大,其MDA含量比对照低17.49%(P<0.05)。
上述结果表明,采后100 mg/L BTH处理可以提高贮藏期火龙果果皮SOD、CAT、POD活力,降低其MDA含量,增强了其抗氧化能力。
2.5 采后BTH处理对贮藏期间火龙果果皮抗病相关酶活性的影响
火龙果贮藏期间果皮PPO活力的变化如图5A所示,对照组PPO活力在贮藏期间呈先上升再下降的趋势,处理组PPO活力在贮藏期间呈先下降再上升的趋势。在整个贮藏期间,除18天时,BTH处理组PPO活力均显著低于对照,对照在贮藏3天时达到峰值,处理组在贮藏9天时达到最低值。贮藏9天时,处理组和对照PPO活力差异最大,其PPO活力比对照低33.72%(P<0.05)。

图5 采后BTH处理对贮藏期间火龙果果皮抗病相关酶活性的影响
火龙果贮藏期间果皮PAL活力的变化如图5B所示。在整个贮藏期间,BTH处理组PAL活力均显著高于对照,对照在贮藏3天时达到峰值,处理组在贮藏6天时达到第一个峰值。贮藏12天时,处理组和对照的PAL活力均达到最低值,此时处理组的PAL活力比对照高23.63%(P<0.05)。
火龙果贮藏期间果皮CHI活力的变化如图5C所示,BTH处理组CHI活力在贮藏期间总体呈上升趋势。在整个贮藏期间,除6天时,处理组CHI活力均显著高于对照。贮藏18天时,处理组和对照CHI活力差异最大,其CHI活力比对照高96.98%(P<0.05)。
火龙果贮藏期间果皮GLU活力的变化如图5D所示,在整个贮藏期间,处理组的GLU活力均显著高于对照,BTH处理组GLU活力总体呈上升趋势,在6天时GLU活力达到第一个峰值,此时其GLU活力比对照高28.19%。对照GLU活力在6天时达到峰值,在9天时达到最低值,此时处理组GLU活力比对照高60.23%(P<0.05)。
上述结果表明,采后100 mg/L BTH处理可以提高贮藏期火龙果果皮PAL、CHI、GLU活力,增强其抗病能力,降低其PPO活力,抑制果皮褐变。
3 结论
本研究发现,100 mg/L BTH处理显著降低了刺伤接种Gilbertella persicaria后火龙果果实的病斑面积、病情指数和贮藏期间的果实腐烂率,诱导了果皮中CAT、SOD、POD、CHI、GLU、PAL等防御酶活性的增强,有效降低了MDA含量,显著钝化了PPO的活力,从而延缓火龙果果实采后衰老进程,提高了果实采后抗病性和贮藏品质。由此可见,采后适当浓度的BTH处理不仅能增强火龙果果实的抗病性,还能提高果实贮藏品质,延长果实贮藏期。
4 讨论
BTH作为植物抗病诱导剂,可通过诱导果实苯丙烷代谢相关酶活性及代谢产物来增强果实的抗性[15]。Zhou等[10]研究表明BTH处理桃果实能有效激活抗氧化酶活性,减少活性氧对植物细胞的损伤,并提高抗病相关酶活性,从而达到对褐霉病病菌的抑制作用。BTH处理对厚皮甜瓜黑斑病的抗性[7]、荔枝霜霉病的抗性[9]、香蕉炭疽病的抗性[11]等均有显著性的增强作用。本试验的研究结果也表明,BTH处理对火龙果采后由桃吉尔霉引发的果腐病具有显著抗性,也进一步验证了BTH的广谱抗病性。
总糖和可滴定酸的含量是衡量果实品质的重要指标之一,其含量的高低会直接影响果蔬的适口性。本试验结果表明,BTH处理可以显著降低火龙果贮藏期间的可滴定酸含量,这与葛永红等[12]对梨果实的研究结果一致。采后贮藏过程中,总糖含量先上升再下降,由于采时成熟度不够,于3天时达到峰值;随着贮藏时间的推移,呼吸不断消耗,糖含量逐渐降低,这与任亚琳等[16]对厚皮甜瓜的研究结果一致。
MDA含量反映细胞膜的稳定性,是衡量果实耐贮性的重要指标。本试验结果表明,BTH诱抗处理可减少火龙果采后贮藏期间MDA的积累,抑制细胞膜的降解;由于水因子在采后贮藏期间会降低细胞膜完整率,从而促进了贮藏后期MDA的积累,这与胡妍芸等[7]对厚皮甜瓜的研究结果一致。
李欣等[17]的研究结果表明,BTH能够有效降低贮藏过程中果实的病害,主要与增强果实活性氧代谢、苯丙烷代谢相关酶活性有关。CAT、SOD、POD等抗氧化酶的活力,是果实贮藏过程中清除自由基,延缓衰老进程的重要指标,同时,POD可催化酚类物质的前体聚合为木质素,起到加固植物细胞壁、抵抗病原物入侵的作用,同时清除细胞内的活性氧,避免其在植物体内产生和积累[18-19]。本试验结果表明,BTH处理可以显著提高CAT、SOD、POD的活力,增强抵抗病原菌入侵的能力。经 BTH 处理,梨[10]、厚皮甜瓜[13]、香蕉[20]、芒果[21]等果实中CAT、SOD、POD活力显著增强,与本研究结果一致。
PAL是苯丙烷类代谢中的关键酶和限速酶,由该途径合成的中间产物如酚类物质以及木质素和类黄酮类植保素等都是植物体内重要的抗菌物质[18,22]。几丁质酶(CHI)和β-1,3-葡聚糖酶(GLU)酶活性与植物抗病性有密切关系[23]。CHI和GLU是胞外水解酶,可以直接攻击病原菌,诱导植物的抗病性[24]。本试验结果表明,BTH处理可以显著增强PAL、CHI、GLU的活力,提升抗病能力,这与前人在苹果[8]、香蕉[20]等研究结果一致。PPO可以将酚类物质氧化为高毒性的醌类物质,从而毒杀入侵病原菌,还参与木质素的合成,使细胞壁变厚,形成木质素保护植物免受感染[25]。本研究结果表明,经BTH处理在贮藏前期可钝化PPO活力,抑制果皮褐变;在贮藏后期快速提升PPO活力,产生高毒性的醌类物质毒杀病菌,这与前人对荔枝[26]、甘薯[27]的研究结果一致。
本研究以‘软枝大红’为试验材料,分析了不同浓度BTH处理对火龙果采后贮藏期间果实品质及抗病、抗氧化酶活性的影响,填补了BTH在火龙果采后保鲜领域研究的空白。但在试验过程中,缺乏对更多果实品质指标和生理指标的测定,如失重率、电导率、总酚、黄酮类物质测定等,将更加全面地了解BTH处理对火龙果品质及生理指标的影响。此外,还可增加机理分析,从而明晰BTH在火龙果上的作用机理和抗菌机制。
