麝鼠香腺Elovl1基因生物信息学分析及表达研究
2022-06-01李天峰李嘉昊白素英
雷 行,李天峰,李嘉昊,满 欣,白素英,2
(1.东北林业大学野生动物与自然保护地学院,哈尔滨 150040;2.国家林业和草原局野生动植物检测中心,哈尔滨 150040)
麝鼠(Ondatrazibethicus)是一种资源分布广、适应性强、繁殖快的仓鼠科鼠类,其成年雄性麝鼠香腺在繁殖期会分泌麝鼠香,与麝香腺非分泌期也保有泌香状态不同[1]。麝鼠香腺发育及泌香呈现明显的周期性变化,分为香腺发育期、泌香盛期、泌香持续期和萎缩期。2~3月为麝鼠香腺发育期,4月为发育盛期进入泌香期,5~6月为泌香盛期,7~8月为泌香维持期,腺体在9月开始萎缩,并在10月萎缩到线状或豆状大小,到11月结缔组织逐渐取代了腺体[2]。对麝鼠香化学成分进行气相色谱-质谱分析显示,其含有烷类、醇类、大环酮类、甾体类化合物及脂肪酸类化合物,主要成分为大环酮类和脂肪酸类化合物[3-4],且脂肪酸类化合物中长链脂肪酸(long chain fatty acids,LCFA)及其化合物占比偏高,主要集中在16C~24C之间。
生物体内LCFA的合成是一个复杂且受多方面调控的过程,主要经过脂肪酸从头合成形成不超过16C的饱和脂肪酸,再经过脂肪酸碳链的延长和不饱和键的形成,其中脂肪酸碳链的延伸主要发生于内质网,以脂酰CoA(fatty acyl-CoA)作为起点合成大于16C的LCFA[5-6]。目前已在哺乳动物中发现7个超长链脂肪酸延伸酶(elongase of verylong chain fatty acids,Elovl)家族成员,分别为Elovl1~Elovl7,其催化构成长链脂肪酸延伸循环的4个反应中的第1个反应,即限速反应。Elovl1延长饱和C18∶0~C26∶0及单不饱和C20∶1、C22∶1、C24∶1的脂酰CoA,是主要的脂肪酸延伸酶[7],广泛存在于哺乳动物各个组织器官中。Elovl1为提供细胞自身LCFA需求起重要作用,分别对细胞中Elovl1进行敲除或抑制处理,检测到LCFA含量明显下调;反之对Elovl1进行过表达处理,检测到LCFA含量明显上调[8-9]。因此,Elovl家族成员可能与麝鼠香腺中的LCFA密不可分。鉴于此,本试验对Elovl1基因生物信息学及转录水平展开分析,以期为深入了解麝鼠泌香的规律及LCFA相关合成通路在麝鼠香腺泌香周期中起到的调控作用提供参考。
1 材料与方法
1.1 试验动物
2019年2月末,在黑龙江省哈尔滨市五常麝鼠养殖场购入体况相近的1岁麝鼠40只,分别在2、3、4、5、6、7、8、9月末随机挑选3只麝鼠,适应性饲养2 d后取其位于肌膜上腹部两侧的香腺,于液氮中速冻后放入冻存管中,-80 ℃保存备用。
1.2 主要试剂及仪器
TRIzol试剂、氯仿、无水乙醇均购自哈尔滨欣科瑞经贸有限公司;总RNA提取试剂盒、RNA酶抑制剂均购自Thermo Fisher Scientific公司;反转录试剂盒购自哈尔滨擎科生物有限公司;荧光染料SYBR Green购自湖南艾科瑞生物工程有限公司;高保真Mix酶购自南京诺唯赞生物科技股份有限公司;琼脂糖凝胶回收试剂盒(D2500 Gel Extraction Kit)购自Omega公司。
PCR扩增仪购自ABI公司;NanoPhotometer-N50紫外分光光度计购自Implen公司;JY300C通用型电泳仪购自北京君意东方电泳设备有限公司;荧光定量PCR仪购自Bio-Rad公司。
1.3 RNA提取与反转录
将麝鼠香腺组织放入研钵中加入液氮快速研磨,研磨充分后使用TRIzol法提取其总RNA,使用超微量分光光度计测定RNA的浓度与纯度,加入RNA酶抑制剂保存RNA。根据反转录试剂盒说明书对麝鼠香腺的总RNA进行反转录,-80 ℃保存备用。
1.4 PCR扩增及测序
麝鼠Elovl1基因序列根据转录组测序获得,由深圳华大基因公司完成,并进行PCR扩增测序检验。使用Primer Premier 6.0软件设计引物,引物序列为:片段Ⅰ,F:5′-GCCCAGCAGATGAGG-AAGT-3′,R:5′-GCCTTGACCTTGGTGATAGC-3′;片段Ⅱ,F:5′-CCCAGCAGATGAGGAAGTG-3′,R:5′-TTTATCATGGCATGGAAAGAGC-3′。
PCR反应体系50 μL:2×Phanta Max Buffer 25 μL,dNTP Mix 1 μL,10 μmol/L上、下游引物各2 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL,模板cDNA 5 μL,ddH2O补足体系。PCR反应程序:95 ℃预变性30 s;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸30 s,共30个循环;72 ℃延伸5 min。将PCR产物进行1.0%琼脂糖凝胶电泳,85 V恒压电泳50~60 min。鉴定正确的PCR产物使用琼脂糖凝胶回收试剂盒(D2500 Gel Extraction Kit)回收纯化,纯化后产物送哈尔滨擎科生物科技有限公司和吉林省库美生物科技有限公司测序。
1.5 系统进化树构建
将测序结果比对麝鼠全基因组库获得Elovl1基因CDS区序列,代码设为Ondz X1和Ondz X2。从GenBank数据库中下载啮齿目不同物种的Elovl1基因及其多转录本CDS序列(表1),以家犬Elovl1基因作为外群,使用MegaX软件进行多序列比对及系统进化树构建。

表1 各物种Elovl1基因CDS序列信息Table 1 CDS sequence information of Elovl1 gene in each species

续表
1.6 生物信息学分析
使用ProtParam(https:∥web.expasy.org/protparam/)和ProtScale(https:∥web.expasy.org/protscale/)在线软件分析蛋白理化性质和疏水性;使用TMHMM Server(https:∥services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测蛋白跨膜结构;使用SignalP-5.0(http:∥www.cbs.dtu.dk/services/SignalP-5.0/)预测蛋白信号肽;使用SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和Phyre2(http:∥www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)在线软件预测蛋白二级结构和三级结构;使用Hum-mPLoc 3.0(http:∥www.csbio.sjtu.edu.cn/bioinf/Hum-mPLoc3/)进行蛋白亚细胞定位。
1.7 Elovl1基因转录水平检测
使用实时荧光定量PCR方法检测麝鼠香腺Elovl1基因的mRNA表达水平,利用Primer Premier 6.0软件分别设计麝鼠不同CDS区的Elovl1基因通用引物和X2特异引物,引物序列为:通用引物,F:5′-CTCACTGCACATCAGCCAA-TACTACT-3′,R:5′-TGGAGAAGAGCACGAAG-AAGAAGGTA-3′;X2特异引物,F:5′-GACTGA-AGGTGAGCACTGGGAAG-3′,R:5′-TGATAC-AAGTTCACAACAGCCTCCAT-3′;内参基因β-actin引物[10],F:5′-TTGCTGATCCACATCTG-CT-3′,R:5′-GACAGGATGCAGAAGGAGAT-3′。 以Elovl1基因通用引物同时扩增X1+X2相同序列,以Elovl1基因X2引物特异性扩增X2序列。
PCR反应体系20 μL:SYBR Green 10 μL,模板cDNA 2 μL,10 μmol/L上、下游引物各1 μL,ddH2O补足体系。PCR反应程序:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环,退火时收集荧光信号。采用2-ΔΔCt法分析Elovl1基因在不同月份麝鼠香腺中的相对表达量。
2 结 果
2.1 麝鼠Elovl1基因序列分析
经转录组测序,并经PCR扩增及测序验证,麝鼠Elovl1基因2个转录本X1和X2的CDS区分别为942和840 bp,X2的5′-端缺失102 bp(图1),其余序列完全相同。
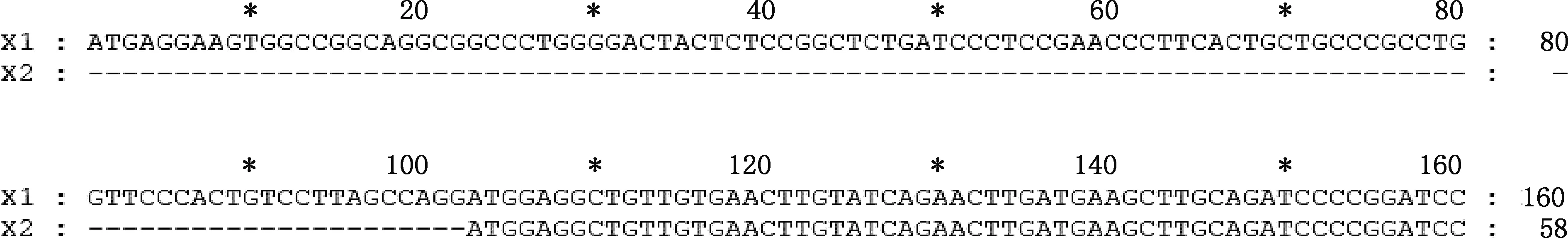
图1 麝鼠Elovl1基因转录本X1和X2 CDS序列差异部分Fig.1 Differences in the CDS sequence of transcripts X1 and X2 of Elovl1 gene in muskrat
2.2 Elovl1基因系统进化树构建
系统进化树结果显示,仓鼠科与鼠科聚在一起,二者与鼹形鼠科关系较近;八齿鼠科、毛丝鼠科、豚鼠科、滨鼠科亲缘关系较近聚为一支,且这些科间分支的置信值普遍较高;松鼠科、河狸科则与其他科间关系较远(图2)。同属物种间,亲缘关系较近各自聚为一支,仓鼠科中,麝鼠与水鼠平、缓行田鼠、草原田鼠亲缘关系最近;同一物种Elovl1基因的不同转录本间相对保守,均按物种聚在一起且置信值普遍较高,但旱獭例外,转录本间已出现进化分歧,其X3与黄腹旱獭聚在一起。
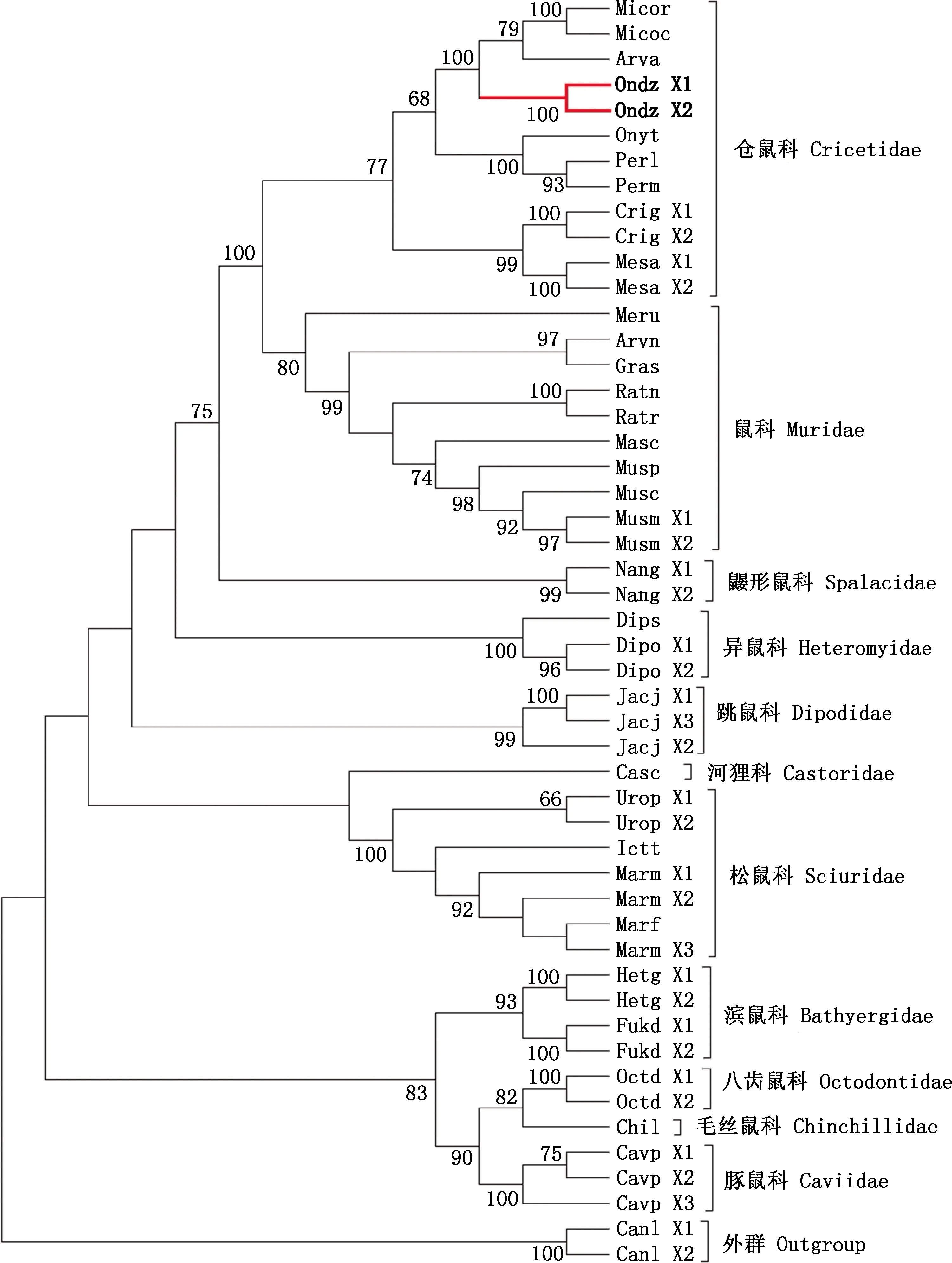
麝鼠用粗线记号标出Muskrat is marked with a bold line图2 Elovl1基因系统进化树Fig.2 Phylogenetic tree of Elovl1 gene
2.3 麝鼠Elovl1蛋白理化性质及亲/疏水性预测
Elovl1基因2个转录本X1和X2编码蛋白分别由313和279个氨基酸组成,X2比X1缺失了N-端34个氨基酸,其他序列相同。利用在线软件对麝鼠Elovl1基因编码蛋白X1和X2的理化性质进行分析,结果显示,蛋白分子质量分别为36.31和32.69 ku,分子式分别为C1732H2587N415O413S16和 C1558H2327N371O372S15,等电点分别为9.79和9.72,半衰期均为30 h,脂肪族氨基酸指数分别为102.43和105.09,不稳定指数分别为34.50和31.12,推测该蛋白可能为稳定碱性蛋白。蛋白包含20种氨基酸,带负电荷氨基酸残基(Asp+Glu)分别有10和9个,带正电荷氨基酸残基(Arg+Lys)分别有25和22个(表2),推测Elovl1蛋白整体带正电。
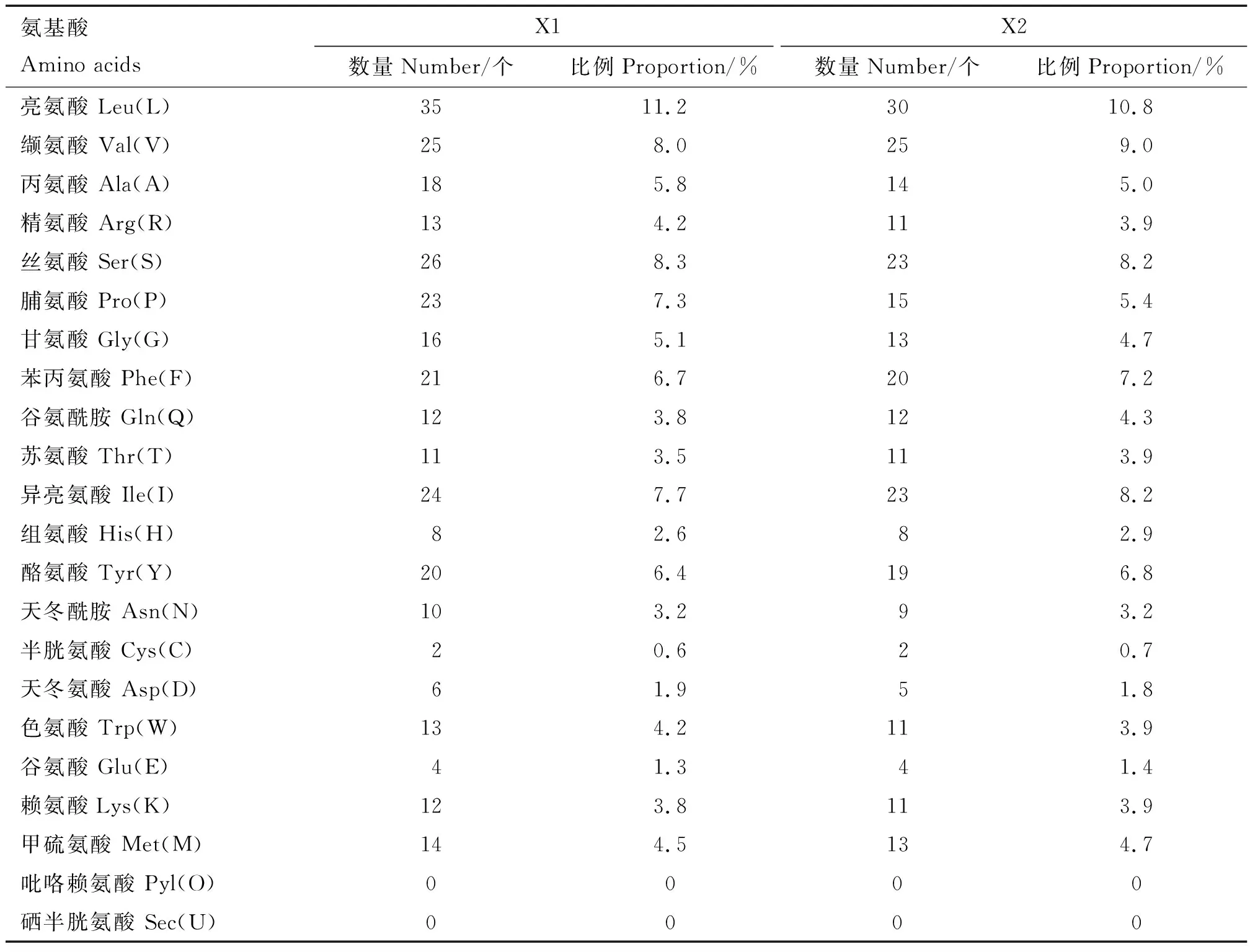
表2 麝鼠Elovl1蛋白X1和X2的氨基酸组成Table 2 Amino acid composition of X1 and X2 of Elovl1 protein in muskrat
亲/疏水性预测发现,麝鼠Elovl1蛋白X1、X2亲水性最强的分别是第290和256位氨基酸处的苏氨酸(-2.256),疏水性最强的分别是第107和73位氨基酸处的丝氨酸(2.856),肽链上的疏水性氨基酸多于亲水性氨基酸,提示整条肽链表现为疏水性(图3)。

A,X1蛋白;B,X2蛋白。下同A,X1 protein;B,X2 protein.The same as below图3 麝鼠Elovl1蛋白亲/疏水性预测Fig.3 Hydrophilicity and hydrophobicity prediction of Elovl1 protein in muskrat
2.4 麝鼠Elovl1蛋白信号肽分析
利用SignalP-5.0软件对麝鼠Elovl1蛋白X1和X2中信号肽进行分析,结果显示,C、S、Y值均未达到信号肽的要求,信号肽存在可能性分别为0.0114和0.0005,推断该蛋白不存在信号肽,为非分泌蛋白。
2.5 麝鼠Elovl1蛋白二级结构和三级结构
SOMPA在线软件预测结果显示,麝鼠Elovl1蛋白X1和X2的二级结构均由α-螺旋(46.45%和50.54%)、β-转角(3.83%和2.51%)、延伸链(15.97%和16.85%)及无规则卷曲(36.74%和30.11%)构成(图4),且Elovl1蛋白主要由α-螺旋和无规则卷曲构成。Phyre2在线软件预测结果显示,在Normol模式(同源建模法)下因缺少相关物种的该蛋白模型,均以人Elovl7为模板,预测的三级结构完全相同,由7个螺旋结构组成。遂采用Intensive模式(综合同源建模法和从头预测法)构建,结果显示,Elovl1蛋白X1和X2的三级结构与二级结构分析结果基本一致,主要由7个螺旋结构组成(图5),二者主要结构无明显区别。

e,延伸链;h,α-螺旋;c,无规则卷曲;t,β-转角e,Extended chain;h,Alpha helix;c,Random coil;t,Beta turn图4 麝鼠Elovl1蛋白二级结构预测Fig.4 Secondary structure prediction of Elovl1 protein in muskrat

图5 麝鼠Elovl1蛋白三级结构预测Fig.5 Tertiary structure prediction of Elovl1 protein in muskrat
2.6 麝鼠Elovl1蛋白的跨膜结构与亚细胞定位
利用TMHMM Server v 2.0分析发现,麝鼠Elovl1蛋白X1和X2跨膜螺旋数量均为7个(图6),与三级结构预测一致。运用Hum-mPLoc 3.0预测麝鼠Elovl1蛋白X1和X2的亚细胞定位发现,该蛋白分布于内质网。

图6 Elovl1蛋白跨膜结构预测Fig.6 Transmembrane structure prediction of Elovl1 protein in muskrat
2.7 麝鼠Elovl1基因转录水平检测
实时荧光定量PCR结果表明,Elovl1基因2个转录本在2~9月末的麝鼠香腺中均有表达,分别以X1+X2和X2的9月末表达量作为对照,结果显示,X1+X2表达变化规律与X2基本一致,即2~9月末Elovl1基因在麝鼠香腺中的表达量整体均呈先上调后下调的趋势(图7)。由图7可知,X1+X2在2、3、4、5、6、7、8月末的麝鼠香腺中的相对表达量分别为9月末的51.77、101.25、98.42、24.82、24.11、14.64和1.67倍,其中2~7月末的相对表达量均极显著高于9月末(P<0.01);X2在2、3、4、5、6、7、8月末的麝鼠香腺中的相对表达量分别为9月末的13.66、265.39、157.61、106.91、106.02、83.34和3.83倍,其中3~7月末的相对表达量均极显著高于9月末(P<0.01),2、8月末的相对表达量均显著高于9月末(P<0.05)。

①A,X1+X2总扩增;B,X2扩增。②与9月末相比,*,差异显著(P<0.05);**,差异极显著(P<0.01)①A,X1+X2 total amplification;B,X2 amplification.②Compared with the end of September,*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01)图7 不同月份麝鼠香腺Elovl1基因相对表达量Fig.7 The relative expression of Elovl1 gene in muskrat scent gland in different months
以X2各月表达量为对照,X1+X2与X2各月表达量倍数关系见图8。由图8可知,2和9月末的表达量最高,达131.33和134.01,各月平均倍数为74.6。说明X1+X2的表达量远远高于X2。

图8 X1+X2与X2不同月份相对表达量倍数关系Fig.8 The relationship of relative expression between X1+X2 and X2 in different months
3 讨 论
3.1 麝鼠Elovl1基因的可变剪接
Elovl1基因在麝鼠香腺中存在2个转录本,2个不同长度的CDS序列使用不同的5′-UTR,且转录本X2的CDS序列相比X1其5′-端缺失102 bp。在动物体中绝大多数基因存在可变剪切,通过产生不同的转录本极大程度地丰富了体内蛋白质的数量,且让同一蛋白各亚型表现出不同的生物学特性[11-12]。如Bcl-x基因,具有Bcl-xl和Bcl-xs 2种转录本,较长的Bcl-xl发挥抗凋亡的作用,而较短的Bcl-xs则能够促进凋亡[13]。不同转录本存在于不同组织器官中,能构成蛋白在不同组织器官中的功能差异[14];不同转录本也能表达在同一组织中,并因生长环境、发育阶段、病理状况等不同而发生改变[15-17]。通过对麝鼠Elovl1基因X1和X2的蛋白理化性质与结构分析发现,两者差异并不显著,均编码稳定的亲脂性蛋白,这是由于Elovl1蛋白有着相对含量较高的脂肪族氨基酸侧链(脂肪族氨基酸指数分别为102.43和105.09),增强了蛋白的疏水性和热稳定性。亚细胞定位均主要位于内质网,这与超长链脂肪酸及麝鼠香合成场所在内质网中相吻合[18]。X1和X2均在香腺组织中同时表达,暗示2个蛋白可能具有相同或相似功能,起到提高表达量的作用,但二者的具体功能还有待进一步研究验证。
可变剪接在物种的进化过程中也扮演着极为重要的角色,对从不同动物的多种器官中提取的RNA进行RNA-Seq测序分析后发现,即使在同种器官中,物种间大部分的可变剪接也并不保守,存在各自独特的剪接模式,甚至在极为相近的物种之间也存在明显的差别,如人和黑猩猩[19-20]。从进化的角度来看,可变剪接的进化速度远在基因本身的改变之上[21]。Elovl1基因多转录本编码不同CDS的现象在啮齿目其他物种中普遍存在,同一物种的Elovl1基因不同转录本间相对保守并聚在一起,但也存在不同转录本间已出现进化分歧的物种,如旱獭。麝鼠Elovl1基因2个转录本X1和X2具有物种特异性,但其是否像其他啮齿目物种(旱獭、非洲跳鼠和豚鼠)具有3个转录本仍有待后续试验检验。
3.2 Elovl1基因在麝鼠香腺中的作用
Elovl1是脂肪酸延伸过程中的关键酶,对多种饱和及单不饱和酰基CoA底物表现出高活性,参与不同LCFA的生产[22-23]。细胞中LCFA的含量随Elovl1表达变化呈正相关变化,随着妊娠后期向泌乳期转变,与香腺同为分泌腺的乳腺细胞中Elovl1基因表达量显著增高,且乳汁中LCFA含量显著增高[24]。因此,Elovl1基因在麝鼠香腺发育期和泌香盛期显著高表达,这与乳腺泌乳期的高表达相似,提示Elovl1基因参与了麝鼠香的分泌,这与LCFA及其化合物作为麝鼠香重要组成成分相符。
LCFA是各种脂质分子中的结构成分,如甘油磷脂、鞘脂及蜡和甾醇酯,根据它们的链长和不饱和度差异,其对膜的流动性和其他物理、化学性质有重要贡献,这些LCFA作为膜脂和脂质介质的前体也参与多种生物进程。研究发现,Elovl1基因以尾对尾双向方式与编码细胞周期蛋白CDC20基因相连[25]。这2个基因在不同类型细胞中都会非常紧密的连接,在特定的发育阶段,某些细胞可能同步表达Elovl1和CDC20,其在细胞周期中存在复杂的共同调节。Elovl1可将脂肪酸延长至26个碳原子,在正常情况下,大量LCFA与长链鞘氨醇相连形成神经酰胺,构成了鞘磷脂和其他鞘脂。鞘脂是真核细胞质膜的主要脂质成分,鞘脂对细胞增殖至关重要,鞘脂合成受损导致酵母和哺乳动物细胞中的细胞生长停止[26-27]。CDC20作为有丝分裂后期促进复合体的正调控因子,在细胞分裂周期中是必需的。同时,CDC20作为原癌因子,对细胞生长及肿瘤发育有促进作用[28]。因此,可能存在Elovl1和CDC20共同表达调控细胞生长发育。本研究中转录表达分析显示,香腺发育期(2、3、4月末)Elovl1基因的相对表达量明显高于其他时期,说明Elovl1参与了香腺细胞的生长发育。
研究表明,敲除Elovl1基因后,因HeLa细胞抗刺激性下降而增加细胞凋亡易感性[29],其原因是敲除Elovl1基因后C16以上LCFA生成途径会减少,C16的鞘脂补偿性增加。而鞘脂酰基链长度组成的变化可能影响细胞膜环境,导致细胞凋亡(Caspase-3/7)信号通路的活化,因此,鞘脂链的长度改变可能会影响质膜上调节的抗凋亡信号[30];线粒体中的鞘脂可能会影响线粒体外膜通透性,从而调节细胞色素释放以响应细胞凋亡信号[31]。麝鼠作为季节性多发情动物,香腺细胞在发育期大量增殖生长。研究发现,在香腺发育期至泌香持续初期,香腺中多种介导细胞生存或增殖的基因表达量上调;而泌香持续末期至香腺萎缩期,则多种介导细胞凋亡或自噬的基因表达量上调[32-33]。因此,Elovl1或许通过调控膜脂成分从而间接参与香腺细胞凋亡通路。
4 结 论
麝鼠Elovl1基因CDS编码的蛋白是稳定的亲脂性蛋白,主要定位于内质网,且具有7个跨膜螺旋区,无信号肽。Elovl1基因在麝鼠香腺中表达2个转录本,其表达量随月份增加整体呈先上调再下调的趋势。
