CRISPR/Cas9技术在畜禽育种中的研究进展
2022-06-01江美祺丁向彬郭益文胡德宝张林林
徐 景,杨 光,江美祺,丁向彬,郭益文,胡德宝,李 新,郭 宏,张林林
(天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津 300384)
成簇规律间隔短回文重复序列/Cas关联蛋白9(clustered regularly interspersed short palindromic repeat/CRISPR associated protein 9,CRISPR/Cas9)基因编辑技术为DNA基因沉默提供了更直接的基因敲除方式,不需要同源重组(homologous recombination,HR)和中间介质(如胚胎干细胞或成纤维细胞),可直接应用于受精卵。它还可以在细胞或胚胎中进行更高效的HR以实现特定位点的DNA序列敲入[1]。CRISPR/Cas9系统具有设计简单、筛选精准、可编程性、合成高效及同时敲除多个基因等优点[2-4],目前已被广泛应用于畜禽的基因编辑及其相关研究,包括基因功能研究、遗传改良、抗病育种、生产功能性畜产品及制药等[5-7]。随着对畜禽产品需求的增加和相关疾病的防控[8-11],CRISPR/Cas9基因编辑技术在畜禽遗传改良和抗病育种方面的研究和应用仍需不断发展。作者主要对CRISPR/Cas9技术的原理及其在畜禽育种中的应用进展进行综述,以期为推进CRISPR/Cas9技术在畜禽育种中的研究提供参考依据。
1 CRISPR/Cas9技术的原理
CRISPR/Cas9基因编辑技术是由细菌和古细菌中的Ⅱ型CRISPR/Cas获得性免疫系统经人工改造而成的DNA基因编辑技术[1]。CRISPR是在一些细菌基因内呈簇状排列的短DNA重复序列,每个重复序列都被原间隔序列(protospacer)隔开。原间隔序列是与靶DNA结构相似的短重复序列,决定基因序列的识别位点[3]。每个原间隔序列始终与保守的原间隔序列相邻基序(protospacer adjacent motif,PAM)相邻,PAM对于靶DNA的识别具有重要作用。最初CRISPR/Cas系统是根据与靶DNA或RNA配对的Cas蛋白不同分为3类[1]。2015年,根据Cas编码复合物的不同将CRISPR系统分为5个类型和16个亚型[12]。2020年,CRISPR/Cas系统的最新分类包括2个纲、6个类型和33个亚型[13],即根据CRISPR基因的组成分为两类:Ⅰ类系统的CRISPR RNA(crRNA)效应器复合物由多个亚基组成;Ⅱ类系统的crRNA效应器复合物仅由单一的Cas基因编码[14]。对这两类进一步分类,其中Ⅰ、Ⅱ、Ⅳ和Ⅴ型是通过靶向外源DNA来保护细胞,Ⅲ和Ⅵ型则是靶向入侵的RNA。在细菌基因组中发现95%以上的CRISPR/Cas系统是Ⅰ、Ⅱ或Ⅲ型之一[15],而Ⅱ类系统几乎是细菌所独有的,且仅依赖一种Cas蛋白,即Cas9蛋白。
CRISPR/Cas9系统主要由crRNA[16]、反式激活crRNA(transactivating crRNA,tracrRNA)[17]和核酸酶Cas9组成(图1)。当靶DNA上的PAM序列被CRISPR/Cas9系统识别后,CRISPR序列在前导序列的调控下转录为pre-crRNA,在Cas9和RNase Ⅲ作用下加工成成熟的crRNA,与tracrRNA形成双链互补,形成crRNA-tracrRNA与Cas9的RNP复合体。RNP复合体在crRNA引导下特异性识别外源基因序列上的CRISPR序列,由核酸酶Cas9切割识别的DNA序列生成双链断裂(double strand break,DSB)[18]。生成的DSB通过同源定向修复(homology-directed repair,HDR)和非同源末端连接(non-homologous end joining,NHEJ)两种机制进行修复[2]。NHEJ修复途径常伴随着随机插入或删除碱基突变,导致较小片段的随机插入、缺失或染色体重排。当CRISPR靶点位于特定基因的开放阅读框(open-reading frame,ORF)内或随机插入或删除碱基数不是3的倍数时会发生移码突变,破坏ORF,产生基因敲除模型。HDR修复途径可以重组原始序列,或利用提供的重组模板插入给定修饰的序列,产生基因敲入模型。之后模拟crRNA和tracrRNA的作用机理,在体外人工合成单导向RNA(single guide RNA,sgRNA)[19-21],从而代替crRNA-tracrRNA复合体引导Cas9到达目标位点发挥作用。这不仅可以将系统简化成仍能在靶标位点上产生所需的替换、插入或删除的仅含Cas9和sgRNA 2个组分的系统,而且增加了通过修改sgRNA就能改变Cas9切割位点的便捷性的特点,使得CRISPR/Cas9基因编辑技术得以更加广泛地应用。
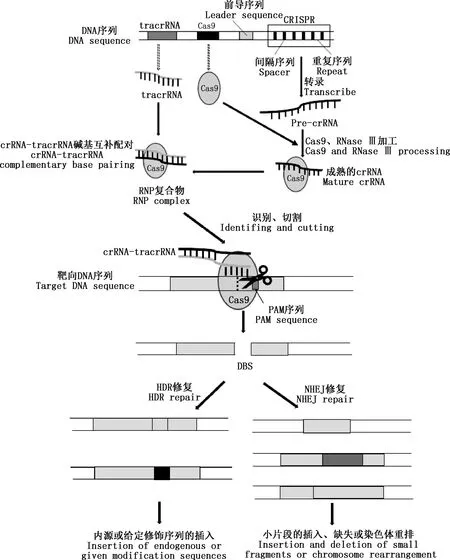
图1 CRISPR/Cas9系统的位点结构及作用机制Fig.1 The site structure and mechanism of CRISPR/cas9 system
2 CRISPR/Cas9技术在畜禽育种中的应用
作为第3代基因编辑技术,CRISPR/Cas9技术已在牛、羊、猪、鸡等畜禽的遗传、繁殖和营养等方面得到了广泛研究应用,在提高现代畜禽的生产力、改善肉蛋生产、优化牛羊奶成分以改良现代畜禽育种体系方面展现出巨大潜力。下面总结了CRISPR/Cas9编辑技术在畜禽育种中的最新研究应用,重点阐述了该技术在猪、牛、羊、鸡遗传改良和抗病育种方面的研究进展。
2.1 CRISPR/Cas9编辑技术在猪育种上的应用
猪作为中国重要的食品家畜和大型模式动物,CRISPR/Cas9技术在其育种中的应用比较广泛[22],尤其是在遗传改良和抗病育种方面,较多应用于提高猪的产肉性能和瘦肉率或增强抗高致病性、致死性病毒能力,对获得高产优质或抗病新品种的猪展现出巨大的应用潜力和经济价值。
在遗传改良方面,最典型的一个例子是猪肌生长抑制素(myostatin,MSTN)基因的敲除。MSTN基因能够负向调节生长激素家族,抑制骨骼肌生长。Wang等[23]借助CRISPR/Cas9技术成功制备了敲除MSTN的基因编辑猪,这种猪的肌间沟、舌、背和臀等部位的肌肉明显增多。此外,线粒体中的解偶联蛋白1(uncoupling protein-1,UCP1)能将仔猪体内的棕色脂肪转化为热能来维持体温,提高瘦肉率[24]。侯连杰[24]、Zheng等[25]利用CRISPR/Cas9技术将UCP1基因插入到猪染色体上,成功获得能抵制肥胖、增强抗寒能力的瘦肉猪。
在抗病育种方面,密集化的饲养会导致猪新旧疫病的继发,给产业化养猪造成重大的经济损失。目前研究人员主要是通过编辑宿主基因来抑制病毒,培育抗病的转基因猪,其中最成功的一个应用是制备抗猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的基因编辑猪。PRRSV是一种囊膜单链正义RNA病毒[26],增殖复制过程不产生dsDNA中间产物,而CRISPR/Cas9技术主要是DNA基因编辑,故病毒感染和增殖所必需的宿主基因成为CRISPR/Cas9基因编辑技术靶向的优先选择。Whitworyh等[27]研究发现,PRRSV受体和门控蛋白CD163(cluster of differentiation 163)基因敲除猪对PRRSV感染具有抗性;进一步应用CRISPR/Cas9技术构建了CD163基因第7外显子SRCR5(scavenger receptor cysteine-rich domain 5)敲除猪,成功阻断了生长猪和妊娠母猪及其胎儿的PRRSV感染[28]。此后的研究也证实了对PRRSV受体CD163基因进行CRISPR/Cas9基因编辑可以防止PRRSV感染和与感染相关的繁殖障碍[29-31]。
CRISPR/Cas9技术在猪其他高致死性疾病的抗病育种方面也取得了一定的进展。猪瘟病毒(Classical swine fever virus,CSFV)是一种囊膜单链正义RNA病毒,利用CRISPR/Cas9技术成功构建以特定的靶向病毒序列的短发夹RNA(short hairpin RNA,shRNA)为突变体的抗CSFV转基因猪[32],有效限制了CSFV在体内外的复制,且其抗病特性可以稳定地传递给F1代。Oh等[33]利用CRISPR/Cas9技术编辑PRRSV受体CD163,同时结合RNAi技术将靶向口蹄疫病毒(Foot and mouth disease virus,FMDV)的RNA聚合酶3D基因和PRRSV的开放阅读框7(ORF7)基因的shRNA整合到CD163编辑的细胞中,抑制了病毒的复制,成功培育出对FMDV和PRRSV的多重抗病毒转基因猪细胞系。综上所述,在大多数RNA病毒(如PRRSV、CSFV和FMDV)的增殖复制过程中都不产生dsDNA中间产物,故应用CRISPR/Cas9基因编辑培育抗病猪,主要是通过靶向病毒感染所必需的宿主基因,即敲除或替换病毒感染所涉及的细胞因子或受体,从而抑制RNA病毒复制。
2.2 CRISPR/Cas9编辑技术在牛育种上的应用
大型反刍家畜牛是中国优质肉制品和奶制品的重要来源,CRISPR/Cas9技术在其遗传改良方面已开展了大量的研究。β-乳球蛋白(β-lactoglobulin,BLG)基因是基于牛奶的营养价值进行研究的一个热门靶标。BLG是牛奶中主要的过敏原,过去主要是借助核移植(SCNT)、转录激活样效应因子核酸酶(TALEN)和显微注射等手段干扰BLG基因的表达,但是过程较为复杂。2020年,Yulia等[34]利用CRISPR/Cas9技术敲除了奶牛BLG基因,培育出可分泌不含致敏性BLG基因牛奶的高营养奶牛品种。在肉质方面,通过CRISPR系统成功敲除了牛MSTN基因,不仅获得了肌肉发达的牛品种[35],还为后续的肌肉发育调控机制研究提供了MSTN敲除牛的骨骼肌卫星细胞模型。以上研究证实了CRISPR/Cas9基因编辑大型反刍动物的有效性和培育优质家畜的可能性,为提高反刍动物的经济效益提供了方向。
CRISPR/Cas9技术在研究牛的抗病育种方面得到了广泛的关注。针对病菌性疾病,特别是利用CRISPR/Cas9基因编辑培育抗溶血性支原体肺炎牛的相关研究较多,但是相对较分散。如由溶血性曼氏杆菌引起牛的肺脏组织损伤和急性炎症,该杆菌能分泌白细胞毒素。利用CRISPR/Cas9精准编辑病菌毒素的受体基因,如白细胞表面的黏附蛋白CD18等位基因[36],影响了白细胞毒素与CD18信号肽结合,阻止了由白细胞毒素诱导的白细胞溶解,避免了肺脏组织损伤和急性炎症。研究发现,利用CRISPR/Cas9敲入或敲除肺脏相关的免疫内源性功能基因,如敲入天然抗性相关巨噬蛋白1(natural resistance-associated macrophage protein-1,NRAMP1)基因,提高奶牛对结核分枝杆菌的抵抗力[37];敲除抗炎细胞因子白细胞介素10受体α(interleukin-10 receptor alpha,IL-10RA)基因,促进促炎细胞因子的表达,增强对由副结核分枝杆菌引起的抗炎反应[38]。这些应用CRISPR/Cas9技术培育出的具有抗炎性的功能细胞系,不仅有助于深入研究抗炎反应的网络调节机制,而且还可作为抗炎药物的抗炎效果评价的细胞模型发挥作用。针对病毒性疾病,研究最多的是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的牛病毒性腹泻。BVDV是一种单链、有囊膜的RNA病毒,增殖复制过程不存在dsDNA中间产物。利用CRISPR/Cas9技术靶向病毒感染所必需的宿主基因,敲除该RNA病毒的受体基因,如低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)[39]、1型跨膜糖蛋白CD46[40]、紧密连接蛋白(occludin,OCLN)[41]基因;敲除该病毒RNA复制所需的细胞因子,如α2抗纤溶酶(serpin peptidase inhibitor clade F member 2,SERPINF2)[42]及猪Jiv(J-domain protein interacting with virus,DNAJC14)[43]基因,都能有效防治由BVDV引起的繁殖障碍和免疫功能紊乱等疾病。另外,利用CRISPR/Cas9技术敲除病毒感染后的差异基因为疾病防控和机制研究提供了一种新的策略。史慧君等[44]利用CRISPR/Cas9技术敲除BVDV感染后细胞内的差异基因,如UDP-葡萄糖糖蛋白糖基转移酶1(UDP-glucose glycoprotein glucosyltransferase 1,UGGT1)基因,抑制了BVDV的复制。由此可见,对于已知的感染机制,CRISPR/Cas9技术主要是通过编辑宿主基因(如病菌毒素受体基因、免疫相关的内源性功能基因和影响RNA病毒复制相关的基因)来实现对牛病菌性和病毒性疾病的防控;对于未知的感染机制,CRISPR/Cas9技术主要是通过敲除筛选出的差异基因进一步提高对疾病的机制研究,因此,创新CRISPR/Cas9基因编辑抗病牛的研究方法和应用势在必行。
2.3 CRISPR/Cas9编辑技术在羊育种上的应用
小型反刍家畜羊是中国重要的优质肉、奶、毛制品的重要来源。CRISPR/Cas9技术用于生产基因编辑的绵羊和山羊,主要是从产肉、绒、毛、奶性状相关的重要基因功能进行研究。在肉质方面,MSTN是首批CRISPR/Cas9目标基因,通过在肉用绵羊[5,45]和肉用山羊[5,46]中应用Cas9/gRNA介导的基因靶向编辑工具促进了肌肉生长发育。Zhou等[47]利用CRISPR/Cas9技术在绵羊细胞因子信号抑制蛋白2(suppressor of cytokine signaling 2,SOCS2)基因抑制子中引入点突变,其对绵羊体重、大小和产奶量均有影响。Niu等[48]敲除β-胡萝卜素加氧酶2(β-carotene oxygenase 2,BCO2)基因实现了绵羊羊肉黄色脂肪的增加。Wang等[49]利用CRISPR/Cas9技术敲除绵羊MSTN基因和刺豚鼠信号蛋白(agouti-signaling protein,ASIP)、BCO2 2个重要的经济性状基因,实现了肌纤维增大和体重增加的多重基因编辑,表明大多数重要的经济性状是由多个基因座控制。因此,通过CRISPR/Cas9技术能在家畜育种中有效地多重靶向是非常重要的。在绒毛品质方面,重点研究对象是成纤维细胞生长因子5(fibroblast growth factor 5,FGF5)基因。作为毛发生长的调节因子,该基因成为CRISPR/Cas9基因编辑羊的首选靶向基因。Li等[50]应用了CRISPR技术将无意义的密码子渗入FGF5基因中阻断了FGF5基因活性,提高了山羊产绒量。Zhang等[51]研究证实,绵羊FGF5基因的CRISPR/Cas9基因编辑破坏可导致羊毛长度和平均羊毛生长率的增加,同时建立的FGF5和Wnt/β-catenin等下游信号通路为改善羊毛品质提供了新思路。冯新宇[52]研究发现,分泌型糖蛋白Wnt2基因在次级毛囊形态发生诱导期表达量差异显著,利用CRISPR/Cas9技术在绵羊细胞水平上敲除Wnt2基因后,FGF5基因表达显著上调,推测Wnt2基因对FGF5基因的表达存在抑制作用,为应用CRISPR/Cas基因编辑技术改善羊毛品质提供了理论支撑。提高羊奶质量是羊基因改造计划的主要目标之一。运用CRISPR/Cas9技术靶向山羊BLG基因[53],培育了敲除BLG基因编辑山羊,生产出无BLG的羊奶。另外,通过CRISPR/Cas9技术敲除绵羊乳腺细胞中的硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)[54]、前脂肪细胞中的乙酰辅酶A酰基转移酶2(acetyl CoA acyltransferase 2,ACAA2)[55]基因对脂肪酸代谢产生影响,这些基因与羊奶性状直接或间接相关,有助于开发一个天然低脂或功能性乳制品的牛奶市场。综上所述,应用CRISPR/Cas9技术能培育出具有特定生产特性的基因修饰绵羊和山羊,有利于促进功能性羊产品的研究和大规模生产。
在增强抗病力方面,最具代表性的是利用CRISPR/Cas9系统对细胞朊病毒蛋白(prion protein,PrP)和病毒受体透明质酸酶2(hyaluronidase 2,HYAL2)基因的敲除。PrP基因与山羊传染性海绵状脑病的发病机制直接相关,利用CRISPR/Cas9技术靶向山羊成纤维细胞中PrP基因,产生PrP基因敲除供体细胞,能用于SCNT生产PrP基因抗性山羊[56-57]。Menchaca等[58]运用CRISPR/Cas9系统诱导HYAL2基因功能丧失,使绵羊肺腺癌综合征得以防治。这些疾病相关基因敲除羊的产生验证了CRISPR/Cas9系统应用于基因编辑小型反刍动物的有效性和培育抗病毒家畜的可能性。
2.4 CRISPR/Cas9编辑技术在鸡育种上的应用
由于鸡的受精卵结构特殊,无法直接通过SCNT获得基因编辑个体[59-60],所以CRISPR/Cas9基因编辑技术在鸡育种上发展较为缓慢。传统选育的重点是筛选出饲料转化效率高、生长快、产蛋多的优质种鸡,但是该过程操作繁琐、耗时耗力且效果差。作为一种新型的解决方案,利用CRISPR/Cas9基因编辑技术寻找生长速度快、饲料转化效率高和其他理想特性(如抗病性)的遗传标记得到了积极的应用[61]。
在肉鸡行业,提高肉品产量是实现经济效益的重要因素,Kim等[62]利用突变的CRISPR/Cas9的Cas9-D10A nickase对MSTN基因进行了有效的调控,首次建立了在鸡DF-1细胞中敲除MSTN基因的方法;其次为了提高饲料利用率,可以通过减少体内脂肪来实现所需的营养物质分配,利用CRISPR/Cas9技术通过PGC介导产生的G0/G1开关基因2(G0/G1 switch gene 2,G0S2)敲除鸡,解除了脂肪甘油三酯脂肪酶的活性抑制,引发甘油三酯分解,加速脂肪分解代谢,减少脂肪积累,使得腹部脂肪含量显著降低[63],这有利于研究鸡的脂质代谢,为CRISPR/Cas9技术在工业饲料方面的实际应用和基础研究奠定基础。
在蛋鸡产业养殖过程中生产的雏鸡约一半是雌性雏鸡,之后留作产蛋种鸡,而另外一半雄性雏鸡则会被淘汰,造成蛋鸡养殖业巨大的经济损失和优质潜能种鸡的错过。通过CRISPR/Cas9技术将表达绿色荧光蛋白(green fluorescent protein,GFP)的基因插入鸡的Z染色体中,使用荧光设备鉴定表达GFP的ZW雌性与野生型ZZ雄性交配的后代,能实现高效的性别筛选,降低孵化成本[64]。另外,利用CRISPR/Cas9系统敲除鸡Stra8(stimulated by retinoic acid 8)[65]和C1EIS(chromosome 1 expression in SSC)[17]基因,阻止了胚胎干细胞转化为雄性生殖细胞,为产蛋种鸡的育种研究提供了新的参考,也为利用CRISPR/Cas9技术从蛋白和蛋黄营养质量方面的研究和应用提供了新的策略,从而提高鸡蛋的营养品质,降低人类患病的风险[66]。
马立克氏病病毒(Marek’s disease virus,MDV)和J型禽白血病病毒(Avian leucosis virus subgroup J,ALV-J)是主要的免疫抑制病毒,给养鸡业造成了巨大的经济损失[67]。传统的选择育种难以获得抗病性,而CRISPR/Cas9技术提供了另一种选择,即通过编辑病毒受体的宿主基因增强基因编辑家禽的抵抗力,如通过修饰ALV-J的功能性细胞受体的Na+/H+交换子类型1(Na+/H+exchanger type 1,chNHE1)基因,使得NHE1受体活性的关键氨基酸W38缺失,使鸡对ALV-J产生抗性[68-71]。但是ALV-J和MDV共感染在养殖场普遍存在,MDV作为一种鸡疱疹病毒,可增强ALV诱导的淋巴白血病。Liu等[67]利用ALV-J和MDV的重叠感染特性,使用MDV作为CRISPR/Cas9载体在体内切除ALV-J基因,首次使用疱疹病毒作为体内用于各种基因治疗目的的CRISPR/Cas9系统的载体,为防治鸡慢性病毒感染的研究和临床试验提供了新的方向。此外,火鸡疱疹病毒(Herpesvirus of turkeys,HVT)[72]是马立克氏病的活疫苗,更是一种重要的生产禽类疾病的CRISPR/Cas9重组疫苗载体,如传染性法氏囊病(infectious bursal disease,IBD)和禽流感(avian influenza,AI)等禽类疾病。Tang等[73]应用CRISPR/Cas9基因编辑IBDV的VP2基因敲入到HVT基因组中,得到了基于HVT的快速、高效地表达IBDV VP2蛋白的新型重组疫苗。 Li等[72]利用CRISPR/Cas9基因编辑将H7N1型禽流感病毒的血凝素(hemagglutinin,HA)基因敲入到HVT基因组中,获得了一种重组HVT(rHVT-H7HA)的多价疫苗载体,可诱导产生HA特异性抗体,为受到高致病性H7N1-AIV攻击的免疫雏鸡提供保护,同时也对MDV攻击具有保护作用。Liu等[74]利用CRISPR/Cas9系统构建了含H9N2-AIV的HA基因的重组HVT(rHVT-H9),诱导鸡体内发生强烈的体液免疫和细胞免疫,对H9N2-AIV具有有效的保护作用。综上所述,CRISPR/Cas9基因编辑技术为快速开发新型重组载体疫苗提供了一种有效的潜在方法,将有助于预防多种家禽疾病。
3 小 结
CRISPR/Cas9系统已成为现代畜禽遗传育种基础研究必不可少的工具,已经被广泛利用产生了很多有价值的畜禽动物或细胞模型,拓宽了对相关基因及其相应的表型和功能的理解。但是将CRISPR/Cas9技术用于家畜遗传育种也面临着一些问题,首先是主要表现在CRISPR/Cas9技术本身存在脱靶效应、sgRNA设计及载体的运载效率等限制因素;其次,通常利用CRISPR/Cas9技术抑制病毒主要有两种方法,即靶向病毒感染所必需的宿主基因和靶向病毒DNA以直接阻止病毒复制。但是CRISPR/Cas9系统在畜禽中抗RNA病毒感染的应用障碍为系统针对的是dsDNA而不是RNA[75]。因为CRISPR/Cas9基因编辑技术是一种dsDNA病毒基因组工程,缺乏RNA靶向活性,从而限制CRISPR/Cas9基因编辑畜禽抗RNA病毒的能力。另外,CRISPR/Cas9介导的dsDNA病毒靶向可能会在引导RNA靶向位点引入突变、插入或缺失[75],从而导致病毒变体,这些变体可能更具致病性或抵抗力,这是CRISPR/Cas9基因编辑畜禽在抗病毒治疗中存在的问题。但不可否认的是,CRISPR/Cas9基因编辑技术创新推进了畜禽育种现代化,且其在畜禽育种中的研究仅仅是起步阶段,其巨大潜力将在更多的CRISPR/Cas9基因编辑畜禽中得以显现。
