体外膜肺氧合救治多发伤并发创伤性湿肺致急性呼吸窘迫综合征及弥漫性肺泡出血患者1例的护理▲
2022-05-31侯璐蒙李汉斌屈敬婷黄霜霞
侯璐蒙 钟 娟 李汉斌 屈敬婷 黄霜霞
(广西医科大学第一附属医院EICU,南宁市 530021,电子邮箱:799352699@qq.com)
【提要】 通过回顾性分析1例创伤性湿肺致急性呼吸窘迫综合征(ARDS)合并弥漫性肺泡出血的患者的临床资料,总结此类病例的护理难点,包括镇静镇痛的管理、创伤性湿肺的机械通气管理、克服体外膜肺氧合(ECMO)管路等困难实施俯卧位通气、创伤患者的ECMO抗凝管理、皮肤护理、并发症观察等。ECMO应用于创伤性湿肺致ARDS及弥漫性肺泡出血的患者有效可行,但ECMO的运行涉及多方面,护理难度较高,完善的监护技术、严密的病情观察和有效的护理是提高ECMO技术救治率不可缺少的因素,团队合作、目标化、精细化、专业化的高质量护理是改善此类患者预后的重要保障。
创伤性湿肺又称休克肺,是指胸部受到钝击、挤压、爆炸、气浪冲击等创伤,引起肺实质微血管受损,致肺泡内充血、渗出、出血、间质水肿所形成的一种综合征,在胸部钝性伤患者中的发生率为30%~75%[1-2]。重型创伤性湿肺往往同时合并血胸、气胸,导致通气和换气功能障碍,而肺动脉压和肺循环阻力增高,是引起胸部外伤后急性呼吸衰竭的最常见因素[3]。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是利用人工心肺技术将严重缺氧和/或二氧化碳蓄积的静脉血引出体外进行氧合并清除二氧化碳,再通过动脉或静脉系统回输患者的手段,主要用于严重心肺衰竭患者的体外生命支持,当肺部病变进行性加重但传统药物和机械通气手段不能改善时,可以考虑使用ECMO治疗[4-5]。采用ECMO治疗创伤性湿肺致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)合并弥漫性肺泡出血的相关研究报告不多见,本研究报告1例采用静脉-静脉(vein-vein,VV)-ECMO 治疗多发伤并发创伤性湿肺致ARDS及弥漫性肺泡出血的病例,分享护理经验,探讨其疗效和安全性。
1 临床病史
患者男性,30岁,既往健康。患者于2020年4月16日被重物砸伤致全身多处疼痛,右大腿畸形、活动受限,伤后短暂性昏迷,醒后无逆行性遗忘;伤后随即送至当地医院就诊,诊断为“失血性休克、右股骨颈、股骨中段粉碎性骨折、右锁骨骨折、多发颈椎横突骨折”,在ICU住院,给予补液、支具固定患肢等对症处理后生命体征稳定,因手术难度高,为求进一步手术治疗于4月18日转诊至我院创伤骨科手外科。
4月19日夜间患者突然极度烦躁,伴呼吸困难,指脉氧进行性下降,给予雾化、止咳化痰等处理后症状无明显好转,行胸部CT检查,结果提示两肺渗出性病变(炎症?肺挫伤?肺水肿?)。患者病情较危重,随时可能并发心脑肺功能障碍,故给予气管插管、深静脉穿刺置管术,随后转急诊ICU治疗。转入时一般查体:体温36.1℃,脉搏145次/min,血压128/63 mmHg;全身可见多处皮下出血点,颈托固定,双肺呼吸音清,可闻及散在湿性啰音,未闻及胸膜摩擦音。专科查体:全身多处擦伤,右肩部皮肤擦伤,无明显渗出;右锁骨处可触及骨擦音或骨擦感,右肩肿胀,右上肢肢端血运好,活动感觉可;右侧腰部、肋部及右大腿可见皮下散在淤血瘀斑,右髋及右膝关节活动障碍,患肢远端血运可,可触及足背动脉搏动,右踝关节及足趾活动正常;骨盆挤压痛不能配合,患肢肿胀、瘀斑,局部畸形明显,可触及骨擦感及异常活动。转入时血气结果(面罩给氧气10 L/min下检测)提示pH 7.230,PaCO245.3 mmHg,PaO267.9 mmHg,HCO3-28.2 mmol/L,剩余碱-1.7 mmol/L,钾4.11 mmol/L,钠136.6 mmol/L,乳酸1.83 mmol/L。修正诊断:(1)创伤性失血性休克;(2)创伤性湿肺并ARDS、Ⅰ型呼吸衰竭;(3)多发性损伤—右股骨中段粉碎性骨折、右股骨颈骨折、右锁骨近端骨折、颈椎和胸椎多发横突骨折(C7、T1~T2、T5~T6)、T6椎体骨折、右肩胛骨骨折;(4)肺炎;(5)低蛋白血症。转入后给予呼吸机辅助通气、镇痛镇静、抗感染等治疗,并行心电监护。
4月20日凌晨血气分析[吸入氧浓度(fractional concentration of inspired oxygen,FiO2)为100%、呼气终末正压为5 cmH2O下检测]结果提示:pH 7.373,PaCO248.3 mmHg,PaO239.5 mmHg,HCO3-27.5 mmol/L,剩余碱1.9 mmol/L,K+3.84 mmol/L,Na+136.3 mmol/L,乳酸1.31 mmol/L。患者经治疗后病情未见好转,存在严重呼吸衰竭,经ECMO团队评估,患者有行VV-ECMO治疗指征,无治疗禁忌证,于床旁行VV-ECMO置管后开始ECMO转机,转速2 700 r/min,流速4.0 L/(min·m2),气流量4 L/min,氧浓度100%。患者于ECMO治疗第2天开始出现血性痰,量较多,输血治疗后血红蛋白仍处于低水平,血气分析提示PaO2仍较低,指脉血氧饱和度波动在90%~95%,且指脉血氧饱和度与体位改变关系明显,给予纤支镜检查治疗,镜下见肺泡大量渗出及弥漫性出血。由于下肢血运好,无明显大出血,考虑出血部位以肺部为主,使用垂体后叶素持续静脉泵入,2~8 U/h,治疗4 d,并行俯卧位通气等治疗,密切监测凝血功能及动态精确调整肝素泵入速度。于ECMO治疗第4天,患者的氧合指标明显改善,肺泡出血量显著减少,吸出的痰液由鲜红逐渐转为淡红,至ECMO治疗第5天,患者无气道出血,痰液为浅白色。其间继续给予机械通气、镇静镇痛、抗感染、输血、血液透析、患肢固定等治疗;由于患者存在肾功能损伤及心肌酶明显升高,故同时接受床旁连续肾脏替代治疗(continuous renal replacement therapy,CRRT)。经过以上治疗后患者呼吸循环功能好转、血红蛋白逐渐上升、肾功能恢复,4月28日(ECMO治疗第9天)血气分析结果(FiO2为40%下检测)提示:pH 7.401,PaCO235.6 mmHg,PaO2104.5 mmHg,HCO3-23.5 mmol/L,剩余碱0.7 mmol/L,K+4.05 mmol/L,Na+139.3 mmol/L,乳酸1.24 mmol/L。当日成功撤除ECMO,5月3日拔除气管插管,5月8日转普通病房。转出后患者分别于5月11日、6月19日行复杂骨折内固定术,术后随访6 个月,患者恢复良好。
2 ECMO的护理措施
2.1 重症监护 成立ECMO管理小组,成员包括科室主任、主治医生、护士长、呼吸治疗师各1名,主管护师3名、护师2名,给予患者全程、连续、密切的病情观察和护理。按照重症监护护理常规给予心电监护、动脉血压监测、指脉氧监护,密切观察神志、瞳孔、生命体征等病情变化。制定并使用“ECMO护理交接班清单”进行规范交接班,确保患者护理安全。见表1。

表1 ECMO护理交接班清单
2.2 镇静镇痛管理 遵医嘱使用咪达唑仑镇静和芬太尼镇痛,每隔2 h进行1次镇静评分、镇痛评分,其中分别采用Richmond躁动镇静量表(Richmond Agitation and Sedation Scale,RASS)[6]、重症监护疼痛观察工具(Critical-Care Pain Observation Tool,CPOT)[7]评估镇静、疼痛情况,在ECMO运行的前5 d给予较深程度的镇静、镇痛,使得RASS评分维持在-4~-3分,CPOT评分<2分;后期根据相关指南[8]推荐的深镇痛、浅镇静原则,使得RASS评分维持在-3~-1分,CPOT评分<3分。根据评分遵医嘱动态调节镇静镇痛药物用量。
2.3 呼吸支持及气道管理
2.3.1 呼吸支持:ECMO运行过程中严格采取保护性肺通气策略[5,9],即平台压<30 cmH2O,呼气末正压5~15 cmH2O,FiO2<50%,呼吸频率10~12次/min。呼吸机参数由呼吸治疗师(由经过规范培训的护士兼任)根据患者病情遵医嘱每日进行调整。严密监测呼吸机参数,每小时记录相关参数及监测值,尤其需注意观察气道压、气道峰压、平台压,避免压力过大发生气压伤,以减少呼吸机相关肺损伤的发生,改善预后[10]。此外,保持呼吸道通畅,按需吸痰,吸痰时动作轻柔,观察记录痰液颜色、量、性质。密切监测血氧饱和度、混合静脉血氧饱和度(mixed venous oxygen saturation,SvO2)、血气分析结果、乳酸值,维持目标值为SvO2>65%、PaCO235~45 mmHg、PaO2200 mmHg左右[5]。ECMO运行期间患者的氧合指标变化趋势见表2。
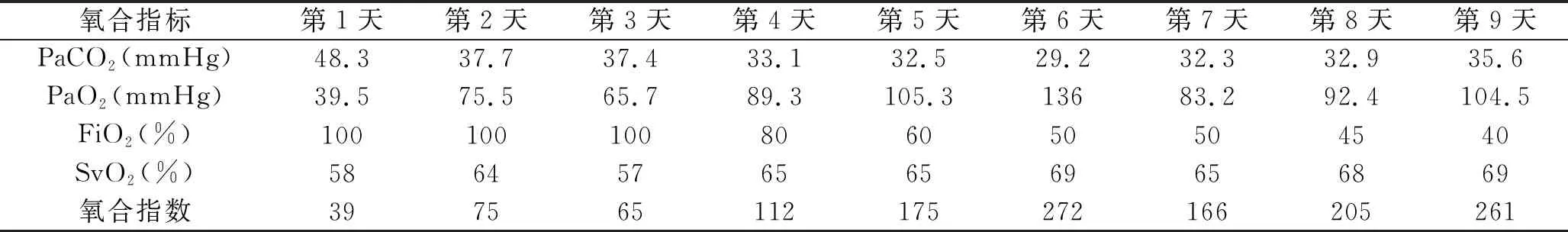
表2 ECMO运行期间患者的氧合指标变化趋势
2.3.2 俯卧位通气及其护理要点:俯卧位通气可以改善 ARDS 患者通气/血流比例,促进肺复张,有利于气道分泌物的引流[11]。本病例有俯卧位通气指证,于ECMO第3~5天进行俯卧位通气,共3次,每次持续4 h。在俯卧位通气开始前0.5 h暂停肠内营养,防止胃内容物反流导致误吸;充分吸痰,确保气囊压力在25~30 cmH2O之间;妥善固定人工气道、ECMO置管、中心静脉置管等各个管路;暂时除去患者的心电监护,使用便携式血氧监测探头监测经皮血氧饱和度及脉搏。负责俯卧位通气的人员共7名,包括呼吸治疗师1名、护士4名、主治医师2名。具体方法:呼吸治疗师站在患者头部位置,负责搬动头部并保护气管插管,2名护士站在患者左侧,1名护士和1名医生站在右侧,1名护士负责观察各管路的连接状态及放置俯卧位软枕,1名主治医师站床尾,负责观察患者的整体情况及ECMO仪器的运行情况;准备就绪后,由床尾的医师发号指令,使用“包饺子”俯卧位翻身法,先将患者平移至右侧,患者身上盖床单,与其身下床单对齐后将右侧床单一并向上卷起,直至贴近患者;左侧向下卷起后卷至患者身下,沿患者身体纵轴向床的左侧翻转90°至侧卧位,右侧人员拉起之前卷至左侧的床单,继续翻转至俯卧位。翻身时,患者头偏向一侧,并保证脊柱平直位置,即头、脊柱、下肢三点成一直线。该病例右下肢股骨骨折,故搬动时需借助床单均衡受力。俯卧位完成后立即检查患者生命体征,确认患者是否耐受,严密观察患者血流动力学状态、血氧饱和度、血气分析等结果,及时观察患者俯卧位通气治疗时的反应,以及有无压力性损伤、导管滑脱、低血压、心律失常等并发症发生。其间每2 h为患者调整头部及双上肢位置,评估易受压部位皮肤情况[12]。使用密闭式吸痰管为患者吸痰,及时有效清除呼吸道分泌物。
2.4 容量管理 患者创伤后失血性休克需大量输血及补液,随着病情进展出现创伤性湿肺、肺泡出血,此时需控制液体入量,减轻肺循环负荷[13]。此外,患者需行床旁CRRT,因此对液体出入量具有特殊要求,ECMO护士需每小时记录和计算出入量,精确动态平衡调控出入量,尽量维持出入量负平衡,血压稳定下减少肺部负荷,维持血流动力学稳定。ECMO期间,患者出入量及其相关监测指标(平均动脉压、血常规相关指标)的情况见表3。
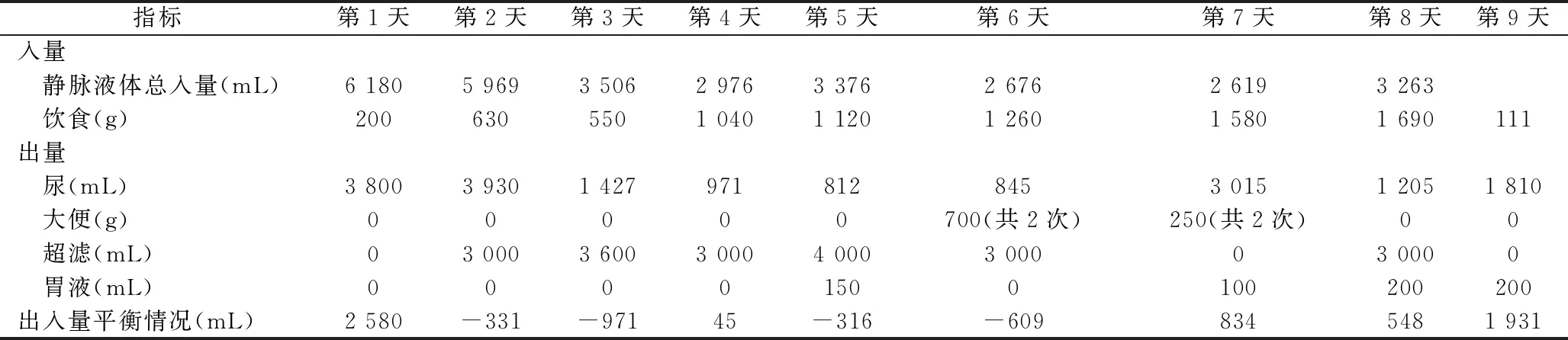
表3 ECMO治疗期间患者的液体出入量及其相关监测指标的变化趋势

续表3
2.5 ECMO管路护理 持续监测ECMO血流量,保持转速、流速和血流量稳定。在膜肺监测方面,观察有无气体以预防空气栓塞,并观察有无血浆渗漏、膜前膜后血液的颜色及膜肺前后压力,如发生膜肺渗漏、气体栓塞、血栓等,须立刻报告医生,经综合评估后决定是否更换膜肺。妥善固定所有管道,尤其是ECMO管路,使用纱布垫于管路下,避免管路直接压迫皮肤,然后使用弹力棉柔胶布缠绕固定管道出口处(位于左侧腹股沟处)并用棉柔胶布将管路与左大腿缠绕固定在一起,对管道外露的刻度进行标记,使用记号笔对管道与皮肤划一直线。每班护士检查该直线是否有移位,如发生管路移位须立即汇报医生,同时立刻核查流量是否在正常范围,检查置管部位有无血肿;必要时立即使用管道钳夹闭引血端与回血端,待医生排除故障后再运行ECMO,以免发生大出血或气体进入环路。
2.6 抗凝管理 遵医嘱动态调节抗凝剂,每2 h监测ACT值1次,每日监测凝血四项指标,视情况监测血栓弹力图,维持ACT在160~180 s之间、APTT在60~80 s之间,有活动性出血时维持ACT在140~160 s之间,APTT在40~60 s之间[5]。预防过度抗凝,可通过观察患者皮肤黏膜有无瘀斑、伤口处有无活动性出血、气道、尿液出血情况,了解是否抗凝过度可观察瞳孔以及早发现脑出血[14];预防抗凝不足,包括每班检测ECMO管路及血泵,观察有无栓子沉积。本例患者在ECMO运行第2~4天出现弥漫性肺泡出血,评估骨折部位并无活动性出血,且监测ACT、APTT无明显异常,因此在加用垂体后叶素止血的同时,并未停止使用肝素抗凝。凝血指标变化趋势见表4。

表4 ECMO治疗期间患者凝血指标变化趋势
2.7 皮肤护理 (1)定时翻身,每2~4 h翻身1次,由6名医护人员合作进行轴线翻身,1人负责扶稳管路,防止管路牵拉和脱出,1人位于头部,固定头部轴线翻身并发号指令,左、右各2人共同翻身。 (2)在管路压迫部位使用柔软棉垫保护皮肤,背部、骶尾部皮肤给予安普贴保护性护理,颈托部位给予棉垫保护受压部位,密切观察并每班交接皮肤情况,包括有无皮肤瘀斑、出血、皮肤压力性损伤、皮肤破损等。观察石膏固定处、患肢牵引处皮肤情况。在ECMO运行第8天,患者右下肢石膏固定处皮肤出现张力性水疱,大小约6 cm×3 cm,用无菌注射器将水疱中的渗液抽净,对疱皮进行保留处理,无菌棉球对水疱部位的浮皮进行轻压,使之和创面处于紧贴状态,每日3次用葡萄糖酸氯己定消毒,保持局部干燥,石膏与皮肤贴合处垫软棉垫以保护皮肤。
2.8 患肢护理 保持肢体功能位,遵嘱给予妥善石膏固定,观察患者皮温、皮肤压力、足动脉搏动情况,以及早识别骨筋膜室综合征。每班测量行骨牵引的情况,防止牵引过度和患肢畸形。在康复师指导下进行下肢锻炼,保护患肢及预防下肢深静脉血栓。
2.9 预防感染 遵医嘱根据药敏试验调整抗生素治疗方案,保持穿刺部位清洁干燥,定时监测血常规;落实预防呼吸机相关性肺炎相关措施[15],包括抬高床头30°~45°,监测气囊压并保持在25~30 mmHg,及时倾倒冷凝水防止倒流,给予呼吸机气体加温加湿,密闭式吸痰,每日规范进行两次口腔护理/气切护理等;实施保护性隔离,接触患者前严格执行手卫生,穿隔离衣,进行有创操作时严格遵循无菌原则,避免交叉感染。
3 讨 论
创伤性湿肺是创伤后早期呼吸衰竭的主要原因,其进展快、病情重,当出现传统药物和机械通气手段不能改善的低血氧时,ECMO是其最终救命手段。但目前采用ECMO治疗创伤性湿肺致ARDS合并弥漫性肺泡出血的相关报告较少。回顾该病例的治疗及护理过程,其护理难点有:镇静镇痛、创伤性湿肺的机械通气、克服ECMO管路等困难实施俯卧位通气、创伤患者的ECMO抗凝、皮肤护理。
镇静镇痛是ECMO管理中非常重要的一环[5]。镇静镇痛不仅可以减轻ECMO患者的应激和不适,以减少氧耗、促进人机同步,还有利于免疫稳定。镇静镇痛不足会使患者烦躁,生命体征不稳定,增加患者痛苦及管道滑脱、意外拔管、坠床等风险;而镇静镇痛过度有可能延长患者机械通气时间,造成患者呼吸机依赖、肌肉无力、ICU获得性衰弱等不良后果。本例患者为严重创伤后ARDS,对镇痛的需求较大,因此对于此类患者,可在早期(ECMO运行24 h内)实施深镇静镇痛,而后可以实施每日唤醒,根据患者情况调节镇静镇痛程度,兼顾治疗需要及早期康复原则逐渐减轻镇静程度。有条件的医院还可以使用红外组织血氧参数无损监测仪监测脑组织氧饱和度[16],或者监测脑电双频指数[17]来指导镇静镇痛方案。
创伤性湿肺的特点是伴随肺部渗出液,而本例患者在ECMO治疗的第2~4天出现弥漫性肺泡出血。此时,护理上要注意及时清理呼吸道,吸出痰液的颜色、量是观察患者肺泡出血情况的重要指标,应如实观察记录;同时,吸痰动作需轻柔、迅速,避免损伤气道。抗凝相关并发症的观察是护理的重点,该患者的抗凝治疗需要考虑的因素包括创伤后血液高凝状态容易形成血栓、下肢骨折出血(失血性休克)、大量输血、肺泡出血以及ECMO作为体外循环所需的常规抗凝等,抗凝过度会加重出血情况、诱发新部位出血,而抗凝不足会导致膜肺血栓、肺栓塞、脑梗等[18]。因此,护理上尤其要重视出/凝血的观察,每班次须检查患者瞳孔、置管穿刺部位有无出血、尿液颜色,使用手电筒观察管路及膜肺有无血栓附着;严格执行医嘱,ECMO治疗早期每2 h测定ACT/APTT 1次,作为调节肝素泵入速度的参考指标,后期凝血功能稳定后,可以6~8 h测定1次。并发肺泡出血也是抗凝方案需要重新考量的因素之一,该患者下肢骨折部位并无活动性出血,且监测ACT、APTT无明显异常,因此在加用垂体后叶素止血的同时,并未停止肝素抗凝。
相关研究表明,在使用VV-ECMO治疗期间联合俯卧位治疗可改善肺组织的静态顺应性,减少呼吸机相关肺损伤发生,促进肺部渗出的排出和吸收,缩短ECMO撤离所需时间。但在实际操作过程中,应充分考虑ECMO 管路的维护[19],在开始操作前,必须检查所有管路(ECMO、中心静脉、动脉和呼吸机回路)是否保持适当长度,防止出现脱管、打折、置管处出血等情况的发生。此外俯卧位期间应适当下调呼气末正压防止肺泡过度扩张。根据团队的经验和患者的体质指数,需要4~8人进行俯卧位翻身,其中应由1人负责观察全局和发号指令,1人负责管理患者头部和人工气道,床两侧各有1至3名人员作为主要发力者进行体位改变,同时注意分工,保护好各管道。
随着ECMO技术的应用越趋成熟,皮肤护理也已经成为ECMO护理中的常规项。本例患者右下肢骨折,须行支具固定、牵引、制动,这成为皮肤护理的难点之一。后期右下肢石膏固定处皮肤出现张力性水泡,分析原因是石膏压迫导致,未执行每班次拆开支具查看皮肤,导致未能及时发现皮肤问题。经过无菌抽吸、消毒、减压、保护等措施后患者皮肤恢复正常。
综上所述,ECMO应用于创伤性湿肺致ARDS及弥漫性肺泡出血的患者有效可行,但ECMO的运行涉及多方面,护理难度较高,对护士技术水平的要求较高,完善的监护技术、严密的观察和有效的护理是提高ECMO 技术救治率不可缺少的因素[20]。团队合作、目标化、精细化、专业化的高质量护理是本例患者顺利度过危险期、赢得生机的重要保障。未来仍应加强ECMO团队的多学科建设,完善各项流程制度,加强医护人员理论知识学习,提高临床观察能力,预防和尽早识别相关并发症,只有通过不懈地提高医疗、护理质量才能保证ECMO患者的安全,降低病死率,减少并发症,改善预后。
