GDF15、TK1在卵巢癌患者血清中的表达及与预后的Cox回归分析
2022-05-31王庆玲李秋芬易莉莎
王庆玲,王 斌,李秋芬,易莉莎*
(1.广东省广州市妇女儿童医疗中心生殖内分泌妇科,广东 广州 510000;2.山东省菏泽市中医医院影像科,山东 菏泽 274000)
卵巢癌发病机制与环境、内分泌、饮食习惯、年龄有关,是女性生殖系统常见恶性肿瘤,由于发病隐匿,确诊时大多已进入中晚期,容易引发盆腔、腹腔广泛转移,病死率较高,故需尽早诊疗,挽救患者生命[1]。而寻找可靠的肿瘤标志物显得尤为重要。细胞质胸苷激酶(thymidine kinase 1,TKI)与细胞增殖存在密切关联,是胸苷激酶在细胞内存在的一种表现,可反映机体异常增殖类病变[2],但关于其与卵巢癌关系仍有待探索。生长分化因子15(recombinant growth differentiation factor 15,GDF15)是一种分泌性细胞因子,属于转化生长因子β超家族成员,在细胞受到炎症刺激或压力信号时,可诱导细胞凋亡及介导细胞生长阻滞,有研究表明,GDF在结肠癌[3]、冠心病[4]等多种疾病中有异常升高表达,因此GDF15有可能成为恶性病变的典型生物标志物,但目前关于其与卵巢癌相关性研究报道较少。对此本文不仅深入探索了GDF15、TK1在卵巢癌患者中表达情况以及潜在临床意义,还分析了GDF15、TK1与预后的关系,以便为日后治疗、预后鉴定提供科学依据。
1 资料与方法
1.1一般资料 前瞻性选取2017年3月—2019年4月入院的卵巢癌患者(卵巢癌组)51例、卵巢良性疾病组(良性组)52例、接受血清检测的健康体检者(对照组)50例作为研究对象,卵巢癌组均为已婚女性,平均年龄(57.13±3.63)岁,平均体重(60.13±5.36)kg。良性组均为已婚女性,平均年龄(57.46±3.59)岁,平均体重(60.22±5.41)kg。对照组均为已婚女性,平均年龄(57.89±3.52)岁,平均体重(60.45±5.47)kg,三组比较年龄、体重比较差异无统计学意义(P>0.05)。符合《赫尔辛基宣言》的伦理审查。纳入标准:①卵巢癌组符合卵巢癌诊断标准[5];②受检者均签署书面知情同意书。排除标准:①合并感染性疾病者;②合并其他恶性肿瘤者;③合并严重内分泌疾病、肝肾功能异常者。
1.2方法 血清检测:抽取受检者3 mL空腹肘静脉血,收集至真空促凝管内,血清分离,离心15 min,3 000 r/min速率,离心半径10 cm,放于低温(-80 ℃)冰箱内保存,使用厦门科豪自动化有限公司提供的ZX-6020型号全自动生化分析仪检测血清水平,GDF15予以酶联免疫吸附测定法,TK1予以酶免疫点印迹发光法。
1.3治疗方法 所有卵巢癌患者均接受化疗干预,第1天静脉滴注175 mg/m2紫杉醇(齐鲁制药;H20023461)、50~70 mg/m2顺铂(德州德药制药;H20023236),每个周期21 d,连续治疗三个周期。随访2年,统计患者生存时间,并根据是否生存分为两组,即生存组(n=41)、死亡组(n=10)。
1.4统计学方法 应用SPSS 22.0统计分析软件处理数据,预测价值评估采用ROC曲线分析;计数资料比较采用χ2检验;计量资料比较采用t检验、单因素方差分析和SNK-q检验;生存曲线运用Kaplan-Meier分析;多因素分析运用Cox回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1三组血清表达比较 卵巢癌组血清GDF15、TK1表达情况高于对照组、良性组(P<0.05),良性组GDF15、TK1表达情况高于对照组(P<0.05),见表1。
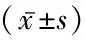
表1 三组血清表达情况比较
2.2ROC曲线分析 经ROC曲线分析,GDF15、TK1预测卵巢癌的AUC分别为0.879、0.813。将两项指标纳入Logistic回归分析,根据回归结果中的回归系数值拟合两项联合诊断的数值计算公式:两项联合=GDF15+(-1.297)/(-0.015)×TK1,两项联合预测的AUC为0.884。见表2。ROC曲线见图1。
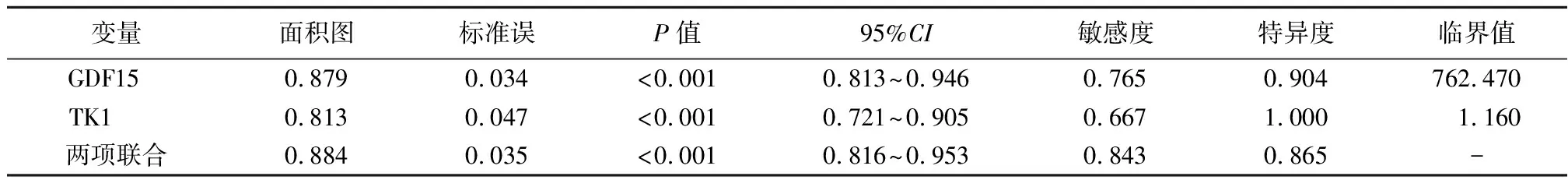
表2 分析各项指标预测卵巢癌的AUC值
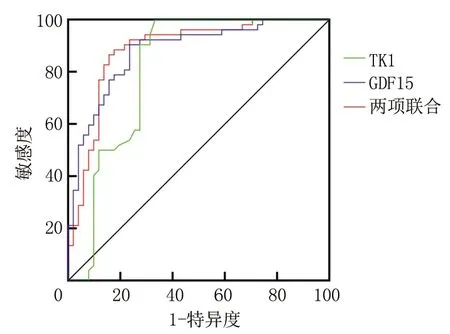
图1 GDF15、TK1及两项联合预测卵巢癌的ROC曲线
2.3卵巢癌患者预后生存情况 患者接受2年随访,生存组41例患者随访生存时间(22.56±1.15)个月高于死亡组10例随访的生存时间(14.16±2.65)个月(t=15.473,P<0.001),见图2。
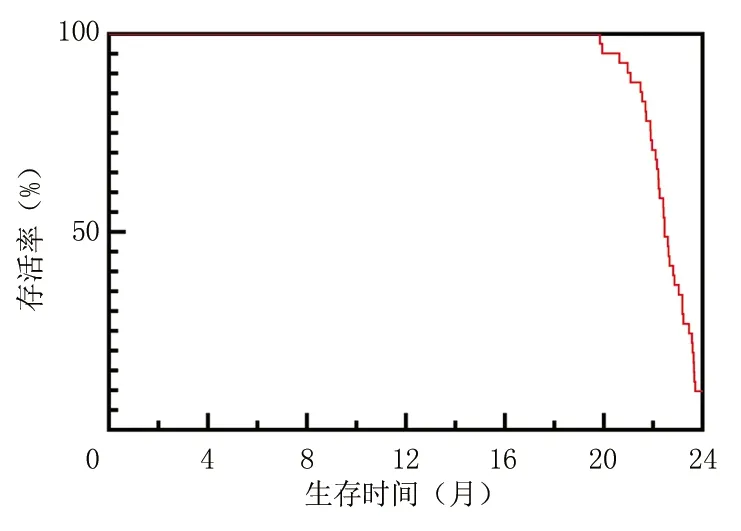
图2 卵巢癌患者生存曲线
2.4两组临床病理特征比较 两组年龄、淋巴结转移、腹腔积液、绝经状态、肿瘤直径差异无统计学意义(P>0.05),但FIGO分期、GDF15、TK1表达情况比较差异有统计学意义(P<0.05)。见表3。

表3 两组临床病理特征比较
2.5Cox回归模型分析 在列出变量赋值后,进行分析。如表4所示。将FIGO分期、GDF15、TK1共3项作为自变量进行Cox回归研究,模型公式为:ln[h(t,X)/h0(t)]=3.059×FIGO分期-1.687×GDF15-2.208×TK1[ln代表取对数,h0(t)代表基准风险率]。最终具体分析可知:FIGO分期共1项会对生存时间产生显著的正向影响关系,GDF15、TK1共2项会对生存时间产生显著的负向影响关系。见表5。

表4 生存情况Cox回归模型赋值表
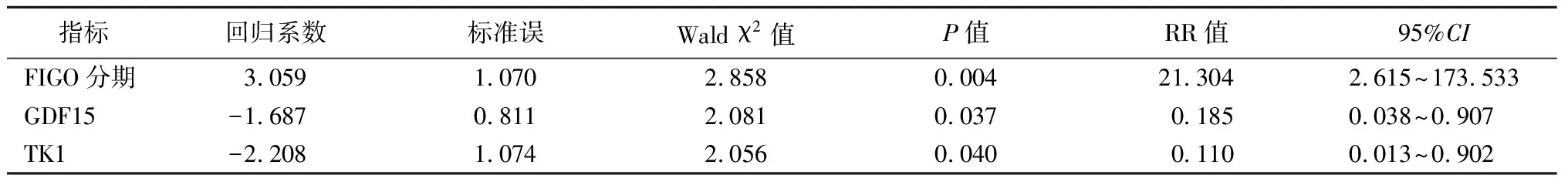
表5 Cox回归模型分析结果汇总
2.6PH假定检验结果 Cox回归模型时通常需要数据满足PH假定检验P>0.05,P<0.05说明未通过PH检验。针对表5Cox回归模型进行PH假定检验。该模型通过PH假定检验,可直接使用Cox回归模型结果进行分析。见表6。

表6 PH假定检验结果
3 讨 论
卵巢癌是妇科常见恶性肿瘤,经流行病学调查[6],发病率占妇科肿瘤的4%,病死率位居第五位,由于卵巢位于盆腔深度,早期症状不具有特异性表现,临床也无有效筛查手段,导致初诊时已为进展期,加之晚期也缺乏有效治疗手段,导致5年生存率仅达到15%~30%,晚期治愈率更低,因此寻找可靠的血清标志物已迫在眉睫[7]。但临床关于卵巢癌可靠的预测生物标志物相对缺乏,因此长期以来学者一直在寻找能够有效评估卵巢癌发生、发展、预后的肿瘤标志物。
GDF15属于转化生长因子β超家族成员,相对分子质量约为17 000,前体包含308个氨基酸,即112个氨基酸的成熟序列、167个氨基酸前肽、29个氨基酸信号肽。GDF15蛋白前体在细胞中被水解后,可通过二硫键将修饰后前体连接为二聚体,再送入内质网,之后被特定的二聚体前体蛋白转换为剪切修饰,从而分泌至细胞外基质中[8]。有研究表明[9],成熟的GDF15蛋白能够行使生物学功能,在细胞外基质释放和储存,能够调控外周血GDF15浓度,影响细胞应答功能和生物学活性。本研究结果中,卵巢癌组血清GDF15表达情况更高于良性组和对照组,说明GDF15水平可受恶性病变影响,呈现高表达状态。原因在于一方面GDF15可受到遗传突变、炎症刺激、细胞应激等影响,出现信号通路改变,被异常激活,导致GDF15表达升高;另一方面GDF15作为分泌性细胞因子,能够通过ERK1/2通路上调UPA系统,增强肿瘤细胞侵袭性,且可激活Akt活性,促进磷酸化,在加速肿瘤细胞DNA增殖中发挥着重要作用[10]。经ROC曲线分析结果显示,GDF15预测卵巢癌AUC为0.879,具有较高预测价值,说明血清GDF15极有可能成为很好的肿瘤预测分子。
TK1是在DNA合成嘧啶补救期间形成的一种激酶,属于合成关键酶,主要作用是参与DNA前体合成[11]。由于TK1参与细胞分裂,正常人体TK1含量较少,但在癌变人群中可检出,与肿瘤细胞增殖有关,同时也是预测健康人群发生癌变风险重要指标之一[12]。本研究结果中,卵巢癌组TK1含量高于健康人群和良性病变者,说明TK1在评估癌变增殖活性中具有一定效能。TK1作为细胞异常增殖标志物,能反映体内癌细胞的增殖情况,在卵巢癌疗效、预后判定中均具有一定作用[13]。且本研究经ROC预测评估显示,TK1的AUC值为0.813,再次证实了TK1是诊断卵巢癌的敏感指标。王春阳等[14]学者也佐证了本次研究结果。此外,经Cox回归模型分析,GDF15、TK1会对生存时间产生显著的负向影响关系,TK1、GDF15增加一个单位时,生存时间的变化(减少)幅度分别为0.110倍、0.185倍,说明GDF15、TK1参与了卵巢癌的发生、发展全过程,高表达状态是影响卵巢癌预后独立因素,有望成为卵巢癌预后评估重要指标[15]。GDF15、TK1作为促细胞增殖的关键因子,在癌细胞转移、侵袭期间发挥着重要作用,若长时间处于高表达状态,可通过改变卵巢癌患者体内内分泌环境,抑制抑癌基因发挥作用,从而促进卵巢上皮细胞侵袭、迁移、增殖[16]。
综上所述,GDF15、TK1在卵巢癌预判中具有较高特异性和敏感性,联合预测可降低误诊、漏诊率,且两项指标与卵巢癌发生、预后均具有一定相关性,有望成为新型分子标志物。
