利多卡因预处理减轻阿霉素引起的小鼠急性心肌损伤的效果及机制研究
2022-05-31刘海波刘岳鹏刘文涛何学明
刘海波,刘岳鹏,朱 霞,刘文涛,程 月,何学明*
(1.蚌埠医学院附属连云港东方医院老年科,江苏 连云港 222042;2.蚌埠医学院附属连云港东方医院转化医学中心,江苏 连云港 222042;3.南京医科大学药理学实验室,江苏 南京 211100;4.南京医科大学康达学院,江苏 连云港 222000)
阿霉素(doxorubicin,DOX)是一种临床上常用的化疗药物,对于多种癌症(如肺癌、乳腺癌等)有比较好的疗效,但其心脏毒性严重限制了其在临床上的应用。DOX心损伤的机制不明,目前最流行的假说是氧化应激假说[1]。然而,已经有研究者提出,氧化应激可能不是DOX引起的心脏损伤的核心,因为铁螯合剂,如右丙亚胺,应该可以减少氧化应激,但有研究表明其治疗效果仍存在争议[2]。此外DOX可引起心脏传导异常,导致心律失常。目前机制尚不明确。心律失常的两个分支,包括心脏起搏和传导的异常,这可能在阿霉素诱导的心脏病中同时存在。在DOX心肌损伤小鼠模型中,引起的急性心脏毒性表现为异常传导,包括心动过缓、QT间期延长[3]。磷酸化缝隙连接蛋白43(phosphorylated connexin 43,p-Cx43)是完整的膜蛋白,在心肌细胞间形成间隙连接,介导相邻细胞之间的信息和物质交换,心脏动作电位的传播和规则搏动节律的维持是由缝隙连接参与介导的[4]。目前已有研究表明在阿霉素心脏毒性模型中p-Cx43明显升高,这将导致其构象改变,并随之产生电和化学解偶联,使细胞间的缝隙连接通讯中断,并最终引起心率及心功能异常[5]。此外炎症反应也参与在阿霉素心肌损伤,近期文献报道在阿霉素心肌损伤模型中白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子明显升高[6]。因此,调节Cx43磷酸化水平以及减轻炎症反应可能是改善DOX引起的传导异常及心脏损伤的潜在策略。利多卡因(lidocaine,LIDO)是一种临床上常用的局部麻醉药,对心脏缺血再灌注损伤具有保护作用[7],本研究的预实验发现LIDO具有保护DOX引起的心脏损伤的作用。本实验首先观察LIDO预处理对DOX引起的心脏毒性的影响,进而通过观察心肌组织中磷酸化磷酸腺苷活化蛋白激酶(phosphorylated adenosine phosphate activated protein kinase,p-AMPK)以及p-Cx43在DOX导致的小鼠心肌损伤模型中的变化及LIDO对其影响,来探究LIDO保护心肌损伤的可能机制。
1 材料与方法
1.1实验动物与分组 体重 20~23 g,6 周龄,雄性,SPF 级 ICR 小鼠,购买自上海西普尔-必凯实验动物有限公司。小鼠可以自由获取食物和水,环境温度21~25 ℃,相对适度50%~60%,每笼 5~6只,下有柔软的垫层。实验中小鼠饲养及取材均符合相关规定。30 只小鼠随机分为3组(n=10),分别为对照组、DOX 组、DOX+LIDO 组。
1.2主要试剂和仪器 盐酸多柔比星(即DOX)购自深圳万乐药业有限公司(生产批号1912E1),LIDO购自湖北天药药业股份有限公司(生产批号D32001021),p-AMPK 抗体购自Abcam公司,p-Cx43抗体购自CST公司,酶联免疫吸附剂测定(enzyme linked immunosorbentassay,ELISA)试剂盒购自上海碧云天生物技术有限公司;Western 一抗稀释液购自上海碧云天生物技术有限公司(货号 P0023A)Western 二抗稀释液购自上海碧云天生物技术有限公司(货号P0023D)小鼠cTn-T检测试剂盒购自上海雅酶生物医药科技有限公司公司(货号H149-4),小动物心电图机购自成都泰盟软件有限公司(型号 BL-420S)。
1.3模型建立 30只小鼠随机分为3组,每组10只,分别为对照组(单次腹腔注射生理盐水1 mL/100 g)、DOX组(单次腹腔注射 DOX 10 mg/kg建立模型)、DOX+LIDO组(尾静脉注射 LIDO 6 mg/kg,间隔30 min后腹腔注射DOX 10 mg/kg,然后每24 h尾静脉注射一次LIDO,连续7 d)LIDO给药剂量参照文献[8]。每天观测小鼠体重及病死率并记录。
1.4心电图检测 分别于小鼠注射DOX前2 h和注射后7 d用气麻机麻醉小鼠(麻药是七氟烷)后进行心电图心率分析。将电极置于右后肢、右前肢和左后肢的皮肤下,使用小动物心电图机器记录结果,待小鼠心率稳定后开始记录,每次记录的持续时间至少为2 min。
1.5心肌细胞损伤评估 7 d提取小鼠中血液样本,制备成血浆并储存在 80 ℃下以供进一步分析。按照使用说明书分别准备试剂、样品和标准品,加入准备好的样品和标准品及生物素抗原,37 ℃孵育30 min,洗涤5次;再加入亲和素继续孵育30 min,最后洗涤加入显色液及中止液并于10 min之内读取OD值。制作标曲计算出cTn-T值。
1.6ELISA试剂盒 检测血浆IL-1β、IL-6、TNF-α分泌量7 d提取小鼠血液样本并制备成血浆待用。按照ELISA试剂盒说明书完成检测步骤。最终通过标曲计算出血浆IL-1β、IL-6、TNF-α分泌量。
1.7Western blot 法 测定心肌组织中蛋白的表达7 d提取样品(心脏组织)在放射免疫沉淀分析(radio immunoprecipitationassay,RIPA)裂解缓冲液中进行裂解。蛋白质浓度由 BCA 蛋白质测定法测定。装载蛋白质并通过聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)分离后在电泳转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上。膜在室温下用 5%牛血清白蛋白封闭 2 h,在 4 ℃下用一级抗体孵育过夜,洗涤3次每次10 min,使用的主要抗体包括p-AMPK(1∶1 000)、p-Cx43(1∶1 000)、GAPDH(1∶1 000);然后用辣根过氧化物酶偶联的二级抗体孵育。洗膜3次,加增强型化学发光试剂(enhanced chemiluminescence,ECL)显色,并进行图像采集。用ImageJ软件对进行灰度分析并统计。
1.8统计学方法 应用SPSS25.0软件处理数据。计量资料采用单因素方差分析、Tukey法和重复测量方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠体重及存活率比较 三组小鼠7 d内体重的差异。DOX组和DOX+LIDO组较对照组体重均呈逐渐降低趋势,但是DOX组降低的更多,组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.01),接受不同的处理措施的小鼠在体重上存在差异。采用Tukey校正的两两比较中,DOX组小鼠体重比对照组小鼠体重低4.50 g,差异有统计学意义(t=8.066,P<0.01);DOX+LIDO组小鼠体重比DOX组小鼠体重高1.50 g,差异有统计学意义(t=2.689,P=0.050),见表1。造模后7 d,DOX 组死亡5只小鼠,DOX+LIDO 组死亡1只,对照组无死亡。LIDO 预处理后小鼠体重及存活率显著改善(P<0.01),见表 2。
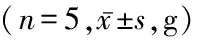
表1 造模后7 d时各组小鼠体重
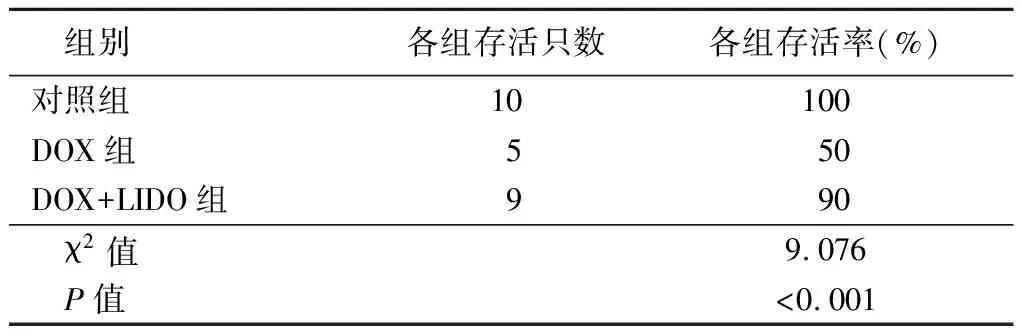
表2 造模后7 d各组小鼠存活情况
2.2造模后7 d各组小鼠心率比较 心电图显示 DOX 降低了小鼠的心功能,表现为心率明显减慢,与对照组相比DOX组心率降低(P<0.01);而用 LIDO 预处理有效地防止了 DOX 诱导的心率减慢,与DOX组相比心率增加(P<0.01),见图1,表 3。

图1 各组小鼠典型心电图比较
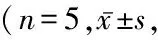
表3 造模后7 d小鼠心率比较
2.3各组小鼠cTn-T变化血浆 cTn-T结果显示 DOX 明显损害小鼠心肌细胞,与对照组相比DOX组cTn-T明显增高(P<0.01);而用 LIDO 预处理有效地防止了 DOX 诱导的心肌损害,与DOX组相比血浆cTn-T降低(P<0.01),见表4。

表4 各组小鼠cTn-T变化
2.4各组小鼠血浆中IL-1β、IL-6、TNF-α变化血浆 IL-1β、IL-6、TNF-α结果显示 DOX 明显增加小鼠血浆中炎症因子分泌,与对照组相比DOX组IL-1β、IL-6、TNF-α明显增高(P<0.01);而用 LIDO 预处理有效地防止了 DOX 诱导的炎症因子升高,与DOX组相比血浆IL-1β、IL-6、TNF-α降低(P<0.05),见表5。

表5 各组小鼠血浆中IL-1β、IL-6、TNF-α变化
2.5心肌组织中p-AMPK和p-Cx43表达水平比较 DOX组p-AMPK表达量明显较其他组明显降低(P<0.01)而LIDO预处理后明显升高(P<0.05)而p-Cx43表达量较对照组明显增高(P<0.05),LIDO预处理后明显降低(P<0.05),见图2,表6。
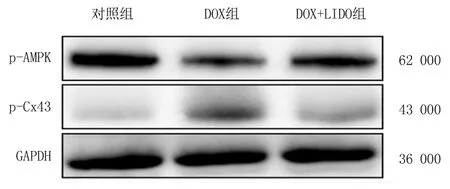
图2 各组心肌组织中p-AMPK、p-Cx43表达水平
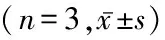
表6 各组小鼠心肌组织中p-AMPK、p-Cx43表达水平比较
3 讨 论
在目前癌症的临床治疗中,尽管各组靶向药物已经广泛应用,但化疗仍占有重要地位。蒽环类化疗药物是一类重要的化疗药物,DOX是其中的代表药物。是治疗各种成人和儿童癌症(乳腺癌、霍奇金病、淋巴母细胞白血病)的最有效药物之一。然而,其严重的心脏毒性(如心律失常、充血性心力衰竭)严重限制其使用[9]。目前临床上对于DOX心脏毒性仍没有较好的药物预防或者治疗[10],因此临床上亟需一种药物来预防或者治疗DOX的心脏毒性。本研究首次报道了LIDO预处理可以预防DOX心脏毒性,为临床化疗过程中预防DOX心脏毒性提供了参考。
LIDO预处理可以预防DOX引起的心脏毒性。LIDO是一种临床上常用的麻醉剂,有研究表明在心肌缺血和再灌注的动物模型中,利多卡因可以减少心肌梗死面积和肌钙蛋白的释放[11]。另一项研究报道利多卡因在缺血再灌注损伤模型中可以减少心肌细胞凋亡从而改善心肌功能[7]。此外,在本研究显示LIDO预处理显著提高了小鼠的存活率和体重,降低了血浆cTn-T、IL-1β、IL-6、TNF-α的水平以及缓解小鼠缓慢性心律失常,表明LIDO能够减轻DOX引起的心脏毒性。
LIDO预处理减轻DOX引起的心脏毒性的机制还不清楚。有报道提示DOX小鼠损伤模型中AMPK的活性被抑制[12],而二甲双胍激活AMPK已被证实对 DOX 心脏毒损伤具有保护作用[13]。最近研究证实 LIDO 可以激活AMPK对炎症起到保护作用[14]。此外还有研究表明LIDO可以降低TNF-α等炎症因子水平达到改善炎症目的[8]。基于这些结果,认为LIDO减轻DOX心脏损伤的机制可能是LIDO预处理抑制了DOX对AMPK活性的抑制。作为证据支持,本实验发现LIDO+DOX组的AMPK的活性高于DOX组。另外,Cx43是缝隙连接通道主要成分,缝隙连接是心脏细胞间直接电和分子信号传输的基础,可确保同步心肌收缩[4]。缝隙连接的作用依赖于Cx43的磷酸化状态,连接蛋白磷酸化是蛋白激酶和磷酸酶之间的相互作用,但确切的途径尚不清楚[15]。刺激Cx43磷酸化可降低心肌细胞缝隙连接通透性,Cx43磷酸化改变也可能导致心力衰竭、传导速度减慢和心律失常的缝隙连接功能障碍[3]。研究表明DOX化疗可导致p-Cx43的上调,被认为是DOX引起心脏毒性的关键因素之一[16]。而DOX心肌损伤过程与高度保守的细胞内AMPK蛋白有关[12]。本实验中观察到,DOX可以引起p-Cx43表达的上调,而LIDO预处理可以减少p-Cx43表达的上调,提示抑制p-Cx43表达可能是LIDO预处理减轻DOX心脏毒性机制中重要的环节之一。此外DOX化疗导致IL-1β、IL-6、TNF-α增加,已有研究表明炎症因子参与心肌细胞的凋亡等反应,降低炎症因子水平有助于改善心肌功能[17]。而LIDO预处理有效降低了血浆IL-1β、IL-6、TNF-α的分泌量,提示降低炎症因子水平可能是LIDO改善心肌损伤的另一个重要环节。在人体内,静脉注射利多卡因的常见不良反应包括低血压和血管扩张,这两种情况在肿瘤患者中都值得关注,虽然有证据表明低剂量利多卡因已被证明对无严重心脏病的患者是安全的[18],但临床上对于LIDO预处理方面的研究较少,仍需要近一步探究。
预处理可以改善DOX诱导的缓慢性心律失常等心脏毒性,其机制可能是LIDO预处理减轻了DOX对AMPK活性的抑制,进而减轻了DOX引起的 p-Cx43上调及降低IL-1β、IL-6、TNF-α来减轻DOX诱导的心脏毒性,所以,在应用DOX治疗肿瘤之前进行LIDO预处理可能是一种有效缓解DOX心脏毒性的方法,但这种新的治疗策略在临床上的潜在价值有待进一步分析。
