褪黑素基于线粒体保护治疗心肌梗死的研究进展
2022-05-31张子睿吕婷婷李尚孙岚
张子睿, 吕婷婷, 李尚, 孙岚
(中国医学科学院北京协和医学院药物研究所药物筛选中心,北京 100050)
近年来,急性心肌梗死早期的再灌注治疗显著提高了患者的生存率,然而心肌梗死患者的预后仍不理想。当缺血区域再灌注时,氧气的突然恢复会造成氧化应激,导致心肌代谢紊乱与结构受损[1],是心肌缺血再灌注损伤的主要机制。而在心肌梗死后期心脏修复的过程中,心室容易发生不良重构,部分心肌超负荷与功能心肌丢失,最终导致心肌梗死后的心力衰竭[2]。
心脏需要大量ATP以维持收缩功能和离子转运,因此线粒体占心肌细胞体积高达30%,以持续且快速地供应能量[3]。经大量研究证实,线粒体在心肌缺血再灌注与心肌梗死后心室重构中都发挥着至关重要的作用,保护线粒体功能和维持线粒体稳态能够改善心肌代谢功能,减少心肌梗死面积并抑制心室不良重构[4]。
褪黑素(melatonin)是一种由哺乳动物松果体分泌的吲哚类激素,在线粒体中有着较高的浓度,其对线粒体的作用已在先前的研究中得到广泛探索。褪黑素已被证明可以改善心肌梗死诱导的线粒体氧化应激、膜电位变化、线粒体动力学和线粒体自噬的紊乱[5],并作为一种有吸引力的心肌梗死治疗策略引起了人们的关注。
1 褪黑素-线粒体轴降低心肌梗死损伤
研究表明,褪黑素能够通过抑制心肌梗死后线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)开放[6]与抑制线粒体活性氧生成[7]以降低线粒体氧化应激,维持线粒体膜电位稳定性并提升ATP产量,抑制心肌梗死后的线粒体裂变升高并增强线粒体融合以维持线粒体动力学的动态平衡[8],从而抑制线粒体自噬,保护线粒体功能,降低心肌缺血再灌注损伤并抑制心肌梗死后不良重构(图1)。
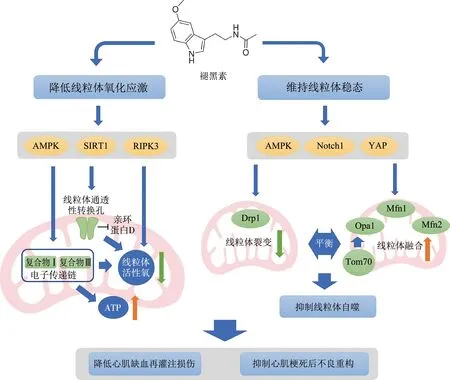
AMPK:腺苷酸活化蛋白激酶;SIRT1:沉默信息调节因子1;RIPK3:受体相互作用蛋白3;YAP:Yes相关蛋白;Drp1:线粒体动力相关蛋白1;Opa1:视神经萎缩蛋白1;Mfn1:线粒体融合蛋白1;Mfn2:线粒体融合蛋白2
1.1 褪黑素降低线粒体活性氧
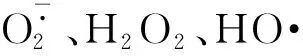
褪黑素作为一种天然的强效抗氧化剂,能够提高缺血心肌线粒体中复合物Ⅰ和复合物Ⅲ的活性,加速电子通过ETC的速度并减少了电子的泄漏,抑制活性氧的产生,降低氧化应激产生的心肌损伤[10]。褪黑素清除活性氧并降低心肌缺血再灌注损伤的治疗作用已得到多方验证,其具体机制仍在探究中。褪黑素能够通过上调SIRT3,减轻H2O2诱导的H9c2细胞死亡和细胞内活性氧聚集,并在小鼠缺血再灌注模型中以SIRT1依赖性激活SIRT3信号通路,降低线粒体中的酶促超氧化物清除剂SOD2的乙酰化,减少线粒体活性氧的产生[7]。腺苷酸活化蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)是一种重要的心脏能量传感器,能够在生理病理状态下维持线粒体能量稳态。褪黑素治疗缺血再灌注心肌显著增强了AMPK的磷酸化,降低线粒体的活性氧生成,增加了Nrf2的核转位,维持氧化反应平衡[11],并通过激活AMPK/mTOR通路降低心肌缺血再灌注后的微血管损伤[12]。
线粒体解偶联蛋白(uncoupling protein,UCP)的激活通常对线粒体功能产生有益作用,包括平衡膜电位、加速电子传输、减少活性氧形成和细胞的氧化损伤。Aslan等[20]在大鼠缺血再灌注模型中敲除UCP3显著增加了活性氧的生成,梗死面积扩大2倍,褪黑素的使用有效提高了UCP3的表达量,并对缺血后损伤有着明显的保护作用。
1.2 褪黑素抑制mPTP的开放
mPTP是位于线粒体内外膜之间的非选择性通道,具有维持线粒体膜电位和细胞内外离子平衡的作用。当心肌缺血时mPTP关闭,而当再灌注发生时,氧气供给突然恢复导致活性氧累积和Ca2+超载,促使mPTP开放。病理性的mPTP开放会导致累积的活性氧爆发性外流引起氧化应激、膜电位消散抑制ATP生成和凋亡因子大量外流细胞质引起细胞凋亡,是心肌缺血再灌注造成心肌损伤的重要原因[21]。研究表明[22],褪黑素治疗心肌缺血再灌注时,心肌中mPTP的开放程度会明显下降,说明褪黑素很有可能通过抑制mPTP的开放从而降低缺血再灌注带来的损伤。mPTP的开放在结构上受亲环蛋白D(cyclophilin D,CypD)的磷酸化调控,Zhou等[6]发现在心肌损伤12 h前腹腔给药褪黑素(20 mg/kg)能够抑制受体相互作用蛋白激酶3(ripk3)和丝氨酸蛋白磷酸酶5(PGAM5)的上调,抑制CypD磷酸化,从而使mPTP开放正常化。除此之外,线粒体电压依赖阴离子通道将细胞质己糖激酶2与线粒体紧密结合,通过抑制Bax/Bad与线粒体的相互作用来防止 mPTP 开放,褪黑素通过激活AMPK促进己糖激酶2迁移到线粒体,使己糖激酶2与线粒体结合从而抑制mPTP的开放,并改善了膜电位[23]。心磷脂是mPTP的重要组成部分,心磷脂或线粒体连接蛋白 43(mitochondrial connexin 43,mtCx43)信号通路调节线粒体膜流动性,可在氧气利用率降低的条件下维持心肌能量。Petrosillo等[24]使用过氧化叔丁醇(t-BuOOH)处理大鼠心脏中的线粒体使心磷脂过氧化,发现使用褪黑素可防止和逆转过氧化的进行从而保护心磷脂,10 μmol/L褪黑素基本可以完全阻止Ca2+/t-BuOOH引起的膜电位降低,从而防止细胞色素c从膜上脱离和 mPTP的开放,同时褪黑素不影响线粒体对Ca2+的累积。mPTP开放是再灌注损伤的后期阶段,在H9c2细胞上的研究表明,褪黑素后处理保护H9c2细胞免受缺血再灌注损伤的治疗时间窗较大,再灌注开始后15~30 min内给药都能有效降低mPTP的开放[25]。
1.3 褪黑素调节线粒体裂变与融合
线粒体是一种动态的细胞器,能够通过线粒体裂变和融合不断改变形态,以此控制线粒体质量并调控线粒体自噬。研究发现线粒体裂变能将线粒体分裂成更小的形态,产生适当大小的线粒体碎片以能够被自噬体吞噬;反之线粒体融合能使两个线粒体融合成一个更长的线粒体并抑制线粒体自噬。线粒体融合与裂变蛋白在心脏中广泛表达,线粒体融合主要由外膜融合蛋白 Mfn1 和 Mfn2 以及内膜融合蛋白Opa1完成,线粒体裂变主要由Drp1 和 Fis1 蛋白完成[26]。
在正常生理过程中,线粒体融合与裂变处于动态平衡的状态。而在心肌缺血、心肌细胞受损以及缺血再灌注时,由于线粒体裂变被过度激活,而线粒体融合能够使破碎的线粒体重新融合,因此抑制线粒体裂变与促进线粒体融合是降低心肌梗死损伤的可能机制。褪黑素能够调节线粒体裂变与融合以维持线粒体的稳态[27]。心肌细胞的线粒体裂变主要由Drp1调控。在大多数情况下,褪黑素能够降低Drp1的表达从而减少线粒体裂变,并降低Drp1的丝氨酸616磷酸化,以抑制线粒体Drp1移位[28],从而起到减少心肌细胞凋亡,改善线粒体功能和心脏功能[29],抑制血管钙化的功效[30]。在心肌缺血再灌注时,心肌中Drp1被显著激活,而再灌注时使用褪黑素治疗也被证明能够降低磷酸化Drp1的表达[8]。褪黑素抑制Drp1的具体机制仍在探究中,Chen等[30]在主动脉粥样硬化的实验中证明褪黑素对Drp1的抑制作用基于对AMPK的激活。但在心肌梗死治疗中更加深入的机制研究仍然缺乏。
线粒体融合分为外膜融合与内膜融合,主要由内膜融合蛋白Opa1与外膜融合蛋白Mfn1和Mfn2介导。Opa1与Opa1相关的线粒体融合有助于维持心肌缺血再灌注应激条件下的线粒体稳态,褪黑素已被证明能够通过调控并激活Opa1的表达以减轻心肌缺血再灌注损伤。Zhang等[31]使用心脏特异性敲除Opa1模型小鼠,证实褪黑素对心肌缺血再灌注时炎症反应、钙超载与氧化应激的抑制作用以及对线粒体融合的激活作用都需要Opa1介导,在H9c2缺氧复氧模型中也证明了Opa1在褪黑素治疗过程中的必要性[32]。褪黑素介导Opa1激活的机制有多种说法,研究发现AMPK、ERK和Yes相关蛋白(Yes-associated protein,YAP)可以调节Opa1的表达以减少缺氧诱导的心肌细胞死亡[33],更加深入的机制研究也在逐步开展中。如Ma等[34]发现在小鼠再灌注损伤模型中,褪黑素能够逆转由于心肌损伤导致的YAP和Opa1下调,且使用YAP拮抗剂维替泊芬后抑制了褪黑素导致的Opa1上调;Zhang等[31]证明AMPK是Opa1的上游信号,褪黑素能够促进AMPK的磷酸化,并通过AMPK-Opa1轴抑制细胞色素c的释放,从而抑制线粒体的凋亡。
线粒体融合蛋白Mfn1和Mfn2位于线粒体外膜上,是外膜融合所必需的蛋白[26]。褪黑素能够显著升高心肌细胞中Mfn1和Mfn2的表达,逆转缺氧导致的H9c2细胞中Mfn1和Mfn2的降低,增强了缺氧心肌的线粒体融合[34]。据报道Mfn2缺失会显著恶化小鼠心肌缺血引起的心脏损伤,但褪黑素治疗后能逆转这一效果,减少了缺血后的心肌细胞凋亡与心肌纤维化,抑制了心肌梗死后心肌的不良重塑[2]。Notch1是褪黑素调控Mfn2的关键因子,能通过调控线粒体自噬关键通路Pink1/Parkin维持线粒体稳态[27],并促进Mfn2和Opa1的表达,抑制过度的线粒体裂变[35]。干扰Notch1降低了褪黑素的治疗效果,且使用褪黑素受体抑制剂luzindol处理后证明了Notch1上调Mfn2依赖于褪黑素受体。褪黑素处理增加了线粒体中Notch1、Notch1胞内结构域、Hes1、Bcl-2的表达和p-Akt/Akt比值,降低了凋亡因子Bax和Caspase-3的表达[36]。Notch1也被证明通过上调RBP-Jk激活Mfn1并抑制Drp1,从而抑制心肌缺血再灌注损伤,并提高线粒体膜电位恢复线粒体产能[37]。但有趣的是,有报道显示Mfn1和Mfn2缺失反而在心肌细胞应对损伤时具有正面效果,Mfn2缺失的成人心肌细胞对Ca2+超载耐受能力更强,在再灌注损伤后表现出更好的恢复能力[38];而Mfn1敲除会使线粒体呈小球状但不影响线粒体正常的呼吸功能,反而能够提高线粒体对活性氧诱导的功能障碍的耐受性,对mPTP开放导致的线粒体功能障碍具有更大的抵抗力[39]。这与之前所述的研究结果相矛盾,有待进一步研究与讨论。
1.4 褪黑素靶向线粒体转运蛋白
线粒体转运蛋白是大多数前体蛋白进入线粒体的入口,负责识别细胞质基质中的前体蛋白,包括Tom复合体、Tim复合体等。Tom70是Tom中的重要组成部分,缺血或缺氧损伤会降低心肌细胞中的Tom表达。心肌肥大是心肌梗死后不良重构中的重要标志之一,能够进一步引发心力衰竭。研究发现在病理性心肌肥大中Tom70下调,且在体内外实验中敲低Tom70均能够诱导显著的病理性心肌肥大。进一步探究证明了Tom70能够通过调控Opa1促进线粒体融合,对维持线粒体形态至关重要,且用腺病毒介导的Tom70过表达完全消除了异丙肾上腺素诱导的心肌肥大[40]。Tom70在心肌缺血再灌注中的作用也被证实,Tom70在缺血再灌注30 min后表达显著降低,Tom70的缺乏会降低线粒体钙离子摄入蛋白1(MICU1)的定位并增加Ca2+含量与线粒体碎片化,额外补充Tom70能够减少梗死面积,抑制心肌肌钙蛋白T(cTnT)泄漏[41]。Pei 等[42]研究了 Tom70 在小鼠体内永久冠状动脉结扎心肌梗死模型和培养的新生鼠心肌细胞缺血模型中的作用,结果表明褪黑素预处理 (10 mg/kg/d) 上调PGC-1α 表达并减轻心肌损伤,但在 Tom70缺乏的小鼠中褪黑素的作用被抑制了,且褪黑素对Tom70的调控为褪黑素受体依赖性。
1.5 褪黑素抑制心肌梗死后的心肌细胞焦亡
焦亡是近年来发现的一种细胞程序性死亡方式,主要由Gasdermin家族中的GSDMD和GSDME调控,其能够诱导细胞凋亡向细胞焦亡转换,并诱导炎症的发生。GSDMD诱导的心肌细胞焦亡是心肌缺血再灌注损伤中的关键因素,缺血再灌注激活caspase-11、切割GSDMD为GSDMD-N并诱导凋亡,因此抑制GSDMD是降低心肌缺血再灌注损伤的有效手段[43]。研究发现,褪黑素能够抑制GSDMD的表达,从而抑制脂多糖诱导的心肌细胞焦亡[44]。线粒体活性氧被证明能够激活NLRP3炎症小体的表达[45],而Wen等[46]在小鼠心肌梗死模型中发现,褪黑素通过TLR4/NF-κB通路抑制NLRP3炎症小体诱导的心肌细胞焦亡。除此之外,GSDME诱导的焦亡与线粒体有着重要的关系,GSDME-N能够透化线粒体膜,使其释放细胞色素c并促进凋亡[47],且线粒体mPTP促使Apaf-1与caspase-4结合为新型蛋白复合物,并通过此复合物激活caspase-3-GSDME导致快速的细胞焦亡[48]。但目前尚缺乏褪黑素针对GSDME诱导的细胞焦亡相关研究,有待更深入的机制探索。
2 结论
褪黑素作为一种天然的强效线粒体保护剂,对心肌梗死的急性期治疗和后期心脏重构的改善都有明显的优势和潜力。除了本文关注的线粒体保护作用外,研究证明褪黑素还具有抑制凋亡和抗炎的作用[49],对调节血脂、血小板功能和微循环有着潜在的益处。褪黑素作为一种内源性分子,具有较高的生物安全性。但同时褪黑素具有强昼夜节律性,在体内具有完整的调节与代谢机制,外源性补充褪黑素难以达到稳定的血药浓度。临床研究发现,与健康者相比,急性心肌梗死患者心脏中的褪黑素水平在白天没有较大的差异,但在夜晚会显著降低[50]。因此,外源补充褪黑素应该更多考虑昼夜节律的影响,其给药方式、给药时间与给药剂量需要进一步的临床探究。
