黄芩总黄酮对大鼠膝骨性关节炎软骨组织Camk2d、Ppp3r2表达的影响
2022-05-31刘大凯郑希福李安石
刘大凯, 郑希福, 李安石
(1. 大连市第二人民医院关节外科,辽宁 大连 116011; 2. 大连医科大学附属第一医院骨外科,辽宁 大连 116011)
膝骨性关节炎(knee osteoarthritis,KOA)是一种临床常见的慢性、进行性膝关节软骨疾病[1]。研究认为在膝关节损伤过程中,炎症因子如白细胞介素1β (IL-1β)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)在软骨细胞及细胞外基质(extracellular matrix,ECM)的分解代谢中发挥重要作用,从而导致KOA的发展[2]。然而,炎症因子如何将信号转导到软骨细胞并调节炎症基因仍不清楚。钙/钙调蛋白依赖性蛋白激酶Ⅱδ(calcium/calmodulin-dependent protein kinaseⅡdelta,Camk2d)与ECM分解和软骨降解密切相关[3]。蛋白磷酸酶3调节亚基2(protein phosphatase 3 regulates subunit 2,Ppp3r2)可以特异性地抑制基质金属蛋白酶(matrix metallo proteinase, MMP)的活性,维持健康软骨内环境的稳定[4]。软骨细胞在受促炎因子刺激后,合成并分泌大量的Camk2d,同时抑制Ppp3r2的表达[5]。非甾体抗炎药可减轻KOA的相关症状,但长期使用会导致某些不良反应,替代药物仍需进一步研究[6]。目前,植物源药物作为一种可靠、有效的KOA替代药物已经引起了广泛的关注。黄芩总黄酮是从中药黄芩中提取的主要有效成分,可以减轻炎症反应来改善类风湿关节炎[7],但其对KOA的作用研究较少。因此,本研究观察黄芩总黄酮对大鼠KOA软骨组织中Camk2d和Ppp3r2表达的影响,探讨黄芩总黄酮治疗KOA的可能机制。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠购自大连医科大学实验动物中心,动物生产许可证号:SCXK(辽)2021-0010,体重(220±20)g,在环境温度(23±2)℃、相对湿度60%~70%、光照12 h明暗交替的环境中适应性喂养1周后进行实验。
1.2 主要试剂与仪器
黄芩总黄酮(南京泽郎医药科技有限公司);塞来昔布(美国辉瑞制药公司);注射用戊巴比妥(上海上药新亚药业有限公司);木瓜蛋白酶(上海蓝季生物有限公司);苏木素染色液(上海碧云天生物技术研究所);TNF-α、IL-1β和IL-6 ELISA试剂盒(欣博盛生物科技有限公司);RIPA裂解液(上海生工生物工程有限公司);Camk2d、Ppp3r2和β-肌动蛋白抗体(美国Santa Cruz公司);HRP标记亲和纯化山羊抗鼠IgG二抗(武汉艾美捷科技有限公司);ECL化学发光试剂(美国GE公司);EG1150型包埋机、ASP300S型组织脱水机和RM2255型全自动轮转切片机等病理配套设备(德国Leica公司);奥林巴斯CX43显微镜(日本奥林巴斯公司);HBS-1096B型酶标仪(南京德铁实验设备有限公司);Bio-Rad垂直电泳仪(美国BD公司);电泳仪(北京市六一仪器厂);MicroPublisher 成像系统(美国Q-IMAGING 公司)。
1.3 分组及造模
将大鼠均分为阴性对照组、模型组、黄芩总黄酮低剂量组、黄芩总黄酮中剂量组、黄芩总黄酮高剂量组和阳性对照组,每组10只。阴性对照组大鼠在第1天、第4天和第7天向膝关节腔内注射生理盐水(0.3 mL/只),其他组大鼠分别在相同时点向膝关节腔内注射4%木瓜蛋白酶(0.3 mL/只)制备KOA模型。造模2周后,阴性对照组和模型组大鼠灌胃给予生理盐水(1 mL/100 g),黄芩总黄酮低剂量组、中剂量组和高剂量组大鼠灌胃给予黄芩总黄酮,剂量分别为12.5、25和50 mg/kg[8],阳性对照组大鼠灌胃给予塞来昔布(10 mg/kg)[9],1次/d,连续14 d后进行相关检测。
1.4 病理学观察
麻醉处死大鼠,切开左侧膝关节皮肤及皮下组织,不打开关节囊,剔除周围的肌肉组织,通过保留胫骨端近端和股骨远端以截取整个膝关节,进行甲醛固定24 h,用乙二胺四乙酸脱钙4周,经脱水、包埋、切片(3 μm),进行苏木素-伊红(HE)染色,用显微镜观察组织病理改变。按 Makin′s评分标准对膝关节病理变化进行评分,评分得分越高,病变越严重。
1.5 ELISA法检测大鼠膝关节软骨组织中TNF-α、IL-1β和IL-6含量
分离右侧膝关节,剪取部分关节软骨组织,用预冷生理盐水冲洗3次,制成匀浆,超低温冷冻后,高压成粉末,按1 mL/100 mg的比例加入生理盐水,离心取上清液,然后将相应一抗稀释至10 μg/mL,加入到96孔板中(0.1 mL/孔),4 ℃孵育过夜,洗涤3次,加上清液0.1 mL于上述反应孔中,37 ℃孵育1 h;加入新配置相对应的二抗(0.1 mL/孔),孵育1 h;加入新配置的3,3′,5,5′-四甲基联苯胺底物溶液(0.1 mL/孔)进行显色20 min;加入0.05 mL硫酸终止反应,于450 nm处测各孔光密度(D)值,计算软骨组织中TNF-α、IL-1β和IL-6的含量。
1.6 蛋白质印迹法检测膝关节软骨组织中Camk2d和Ppp3r2的蛋白表达
剪取部分关节软骨组织,用预冷生理盐水冲洗3次,制成匀浆,按1 mL/100 mg的比例加入RIPA裂解液,离心后取上清液,调整蛋白浓度,加入1/5体积的5×缓冲液,沸水变性,进行电泳(20 μg/孔),蛋白质经8% SDS-PAGE分离后转移到PVDF膜上,然后用5%脱脂牛奶封闭,将膜与Camk2d和Ppp3r2抗体4°C孵育过夜,洗膜后与HRP标记亲和纯化山羊抗鼠IgG二抗孵育30 min,显色后用MicroPublisher 成像系统分析蛋白条带的灰度强度(以β-肌动蛋白作为内参对照)。
1.7 统计学分析
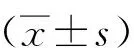
2 结果
2.1 各组大鼠膝关节软骨组织HE染色结果
阴性对照组大鼠膝关节结构完整, 软骨表面光滑;模型组大鼠膝关节软骨纤维结缔组织增生,结构不清,伴炎症细胞浸润;黄芩总黄酮低剂量组大鼠关节软骨纤维结缔组织增生,细胞排列无规则,炎症细胞浸润,但较模型组明显改善,随着黄芩总黄酮剂量的增加,病变改善越明显;其中黄芩总黄酮高剂量组和阳性对照组大鼠关节软骨结构、层次明显改善,炎症细胞显著减少。见图1。
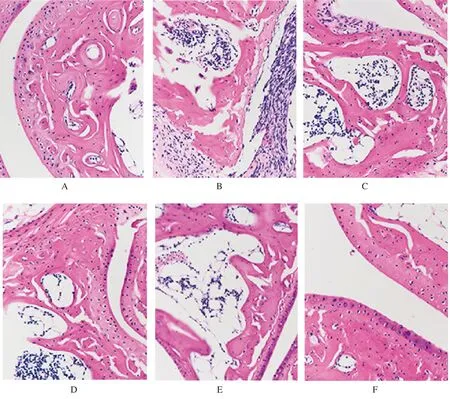
A:阴性对照组;B:模型组;C:黄芩总黄酮低剂量组;D:黄芩总黄酮中剂量组;E:黄芩总黄酮高剂量组;F:阳性对照组
2.2 各组大鼠膝关节Makin′s评分比较
与阴性对照组比较,模型组大鼠膝关节软骨组织Makin′s评分明显升高(P<0.05);与模型组相比,黄芩总黄酮各剂量组及阳性对照组大鼠软骨组织Makin′s评分明显降低,且黄芩总黄酮各剂量组效应呈剂量依赖性(P<0.05);黄芩总黄酮高剂量组和阳性对照组Makin′s评分差异无统计学意义(P>0.05)。见图2。
2.3 各组大鼠膝关节软骨组织中TNF-α、IL-1β和IL-6含量比较
与阴性对照组比较,模型组大鼠膝关节软骨组织中TNF-α、IL-1β和IL-6含量明显升高(P均<0.05);与模型组相比,黄芩总黄酮各剂量组及阳性对照组大鼠膝关节软骨组织中TNF-α、IL-1β和IL-6含量明显降低,且黄芩总黄酮各剂量组效应呈剂量依赖性(P<0.05);黄芩总黄酮高剂量组和阳性对照组间各指标差异无统计学意义(P均>0.05)。见表1。
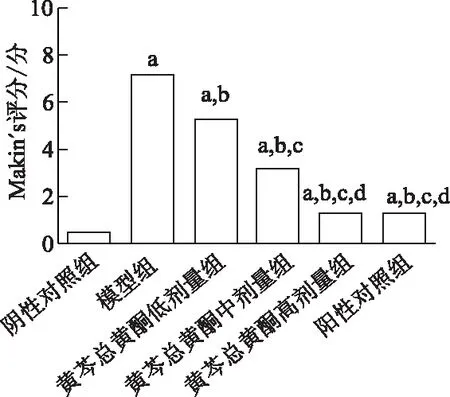
a: P<0.05,与阴性对照组比较;b: P<0.05,与模型组比较;c: P<0.05,与黄芩总黄酮低剂量组比较;d: P<0.05,与黄芩总黄酮中剂量组比较
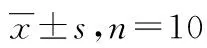
表1 各组大鼠膝关节软骨组织中TNF-α、IL-1β和IL-6含量
2.4 各组大鼠膝关节软骨组织中Camk2d和Ppp3r2蛋白表达比较
与阴性对照组比较,模型组大鼠膝关节软骨组织中Camk2d表达水平明显升高(P<0.05),Ppp3r2表达水平明显降低(P<0.05);与模型组相比,黄芩总黄酮各剂量组及阳性对照组大鼠膝关节软骨组织中Camk2d表达水平明显降低,Ppp3r2表达水平明显升高,且黄芩总黄酮各剂量组效应呈剂量依赖性(P<0.05);黄芩总黄酮高剂量组和阳性对照组间Camk2d和Ppp3r2表达水平差异无统计学意义(P>0.05)。见图3和表2。

①:阴性对照组;②:模型组;③:黄芩总黄酮低剂量组;④:黄芩总黄酮中剂量组;⑤:黄芩总黄酮高剂量组;⑥:阳性对照组
表2 各组大鼠膝关节软骨组织中Camk2d和Ppp3r2蛋白相对表达
3 讨论
KOA是一种慢性关节炎,其特点是关节软骨退行性变和缺乏,软骨下骨和关节边缘骨质增生,表现为生化代谢紊乱和关节软骨结构的损伤,局部结构软骨损伤合并滑膜炎症和关节囊纤维增生,最终导致膝关节疼痛、肿胀和功能障碍,可能导致残疾[10-11]。本研究中病理结果和Makin′s评分结果均显示,黄芩总黄酮对大鼠KOA具有治疗作用,且黄芩总黄酮治疗效果与塞来昔布相当,表明黄芩总黄酮对临床治疗KOA具有一定的潜力。
核转录因子-κB(nuclear factor-kappa B,NF-κB)是一种重要的转录因子,在静止状态下,NF-κB与NF-κB抑制蛋白(nuclear factor-kappa B inhibitor,IκB)结合后以非激活状态存在于细胞质中。当细胞受到各种因素如IL-1β和TNF-α的刺激时,所产生的信号级联反应迅速激活了细胞质中IκB激酶的磷酸化,最终导致IκB的泛素化和随后的降解。抑制因子IκB的降解可导致NF-κB的活化,NF-κB易位至细胞核。这一过程最终导致MMP-13的激活,这被认为是KOA治疗的潜在靶点[12]。IL-1β在软骨细胞中诱导miR-146a表达[13],同时,机械压力损伤和滑膜或半月板分泌的促炎细胞因子可能参与了miR-146a在KOA软骨中的诱导。 miR-146a被认为是炎症的负调控因子,通过促进miR-146a的表达可抑制小鼠的关节破坏,而Camk2d和Ppp3r2是miR-146a的调控靶点[14]。ECM降解是导致KOA发生和发展的关键过程。Camk2d对软骨ECM降解作用巨大,Camk2d与软骨胶原溶解密切相关,软骨胶原溶解是关节疾病中关键的蛋白水解事件,本质上是不可逆的[15]。Camk2d可以通过细胞外间隙的蛋白水解来激活MMP-13。MMP-13是最有效的胶原Ⅱ降解酶,其过表达会导致关节软骨损伤。进一步的实验表明,骨关节炎模型大鼠膝关节软骨组织中Camk2d水平升高[16]。体外实验表明,IL-1β可显著提高人软骨肉瘤SW1353细胞中MMP-13的mRNA和蛋白水平[17]。Ppp3r2是Camk2d的抑制剂,在正常软骨中,Camk2d和Ppp3r2之间的平衡至关重要。Ppp3r2的降低可以增加Camk2d的活性,加速ECM的降解。Ppp3r2/Camk2d平衡可被软骨组织中的炎症因子破坏,最终导致骨关节炎[18]。Ppp3r2在骨关节炎软骨细胞中表达降低,导致软骨细胞的Ppp3r2/Camk2d平衡失调,Ppp3r2表达增加可缓解骨关节炎模型大鼠膝关节软骨的病理变化[19]。本研究结果显示,黄芩总黄酮增加KOA模型大鼠膝关节软骨组织中Ppp3r2的蛋白表达,降低Camk2d的蛋白表达,对KOA发挥治疗作用。
综上所述,黄芩总黄酮对KOA大鼠具有治疗作用,其机制可能是黄芩总黄酮增加软骨组织中Ppp3r2表达,降低Camk2d表达,抑制了软骨组织的炎症反应。研究结果为黄芩总黄酮治疗KOA提供了理论基础。
