指纹图谱结合一测多评法的栀子质量控制方法研究
2022-05-31罗家敏
罗家敏,高 雯,李 萍*
指纹图谱结合一测多评法的栀子质量控制方法研究
罗家敏1, 2,高 雯2,李 萍1, 2*
1. 广东药科大学中药学院,广东 广州 510006 2. 中国药科大学 天然药物活性组分与药效国家重点实验室,江苏 南京 210009
建立栀子的指纹图谱,并同时建立其中6个主要成分含量的一测多评分析方法,以期对栀子药材进行整体质量控制。基于高效液相色谱结合紫外变波长分段检测,在各类化合物的最大吸收波长下,建立包含环烯醚萜苷类(240 nm)及二萜类(440 nm)成分信息的栀子指纹图谱。在此基础上,分别以栀子苷和西红花苷I为内标,计算4个环烯醚萜苷类成分(山栀苷、山栀子苷B、京尼平龙胆双糖苷和栀子苷)和2个二萜类成分(西红花苷I和西红花苷II)的校正因子,通过4台高效液相色谱仪及4根不同色谱柱进行耐用性考察,并与外标法测定结果比较,验证一测多评方法的准确性。19批栀子的指纹图谱共标定20个共有峰,相似度为0.981~0.999;在240 nm下,以栀子苷为内标,山栀苷、山栀苷B、京尼平龙胆双糖苷和栀子苷的校正因子分别为1.15、1.36、1.54和1.00;440 nm下,以西红花苷I为内标,西红花苷II的相对校正因子为1.11,且耐用性较好。应用一测多评法测定6个成分的含量,与外标法测定结果比较,含量准确度均值为100.14%,RSD<3%,无明显差异。19批栀子中6个待测成分的质量分数范围分别为0.09%~0.35%、0.28%~0.82%、0.31%~1.00%、4.60%~7.78%、0.62%~1.64%和0.07%~0.26%。所建立的指纹图谱结合一测多评法简便可行,可为栀子药材整体质量控制提供一定参考和依据。
栀子;指纹图谱;一测多评法;相对校正因子;山栀苷;山栀子苷B;京尼平龙胆双糖苷;栀子苷;西红花苷I;西红花苷II
中药栀子系茜草科植物栀子Ellis的成熟果实[1],是东亚三国广泛应用的传统药物。栀子的化学成分主要包括环烯醚萜苷类、二萜类、有机酸类及黄酮类4大类[2-5]。其中环烯醚萜苷类具有保肝利胆、抗炎、神经保护等功效[6-8];二萜类化合物具有显著的调血脂和抗氧化活性[9-11]。
《中国药典》2020年版对栀子药材在含量仅规定了栀子苷“不得少于1.8%”。目前针对栀子中的多种活性成分建立了(MSPD-)HPLC- PAD[12]、HPLC-DAD-MS[13]、UFLC-MS/ MS[14]等多种定量分析方法,然而这些方法由于受到仪器或对照品用量等的限制,难以推广至栀子药材质控的实际应用中。一测多评法采用单一对照品同时测定多个成分的含量[15-16],是实现中药多成分质控的一种经济、简便的分析方法。而中药指纹图谱是中药整体质量控制的核心技术之一,可以反映不同样品质量的均一性[17-18]。目前已有学者建立了栀子指纹图谱、多成分含量测定或一测多评分析方法,并结合多变量数学模型等手段对不同产地栀子药材进行了质量评价[19-24]。本实验基于紫外变波长检测手段,建立了色谱指纹图谱结合一测多评的栀子质量评价方法,可兼顾不同类型组分的最佳响应,在较全面表征栀子化学成分整体轮廓、评价栀子药材整体质量的基础上,同时对其中的主要成分进行定量控制。考虑到两类成分结构类型差异较大,根据一测多评技术指南[25],分别选择栀子苷和西红花苷I作为内标物建立环烯醚萜苷类和二萜类成分的校正因子,为栀子多指标质量控制推广奠定基础。
1 仪器与试药
1.1 仪器
HPLC色谱仪(1290型、1260型和1100型,美国Agilent公司;Shimadzu LC-20A型,日本Shimadzu公司);Quintix系列分析天平(赛多利斯科学仪器有限公司);KH-500DB型超声仪(昆山禾创超声仪器有限公司)。
1.2 试药
乙腈,色谱纯,德国Merck公司;甲醇,分析纯,上海泰坦科技股份有限公司;磷酸,优级纯,国药集团化学试剂有限公司;超纯水来自Milli-Q系统。对照品栀子苷(批号110749-201718,质量分数97.1%)、西红花苷I(批号111588-201704,质量分数88.4%)、西红花苷II(批号111589-201705,质量分数92.2%)均购自中国食品药品检定研究院;山栀苷(批号PS011214,质量分数≥98%)、京尼平龙胆双糖苷(批号PS011212,质量分数≥98%)购自成都普思生物科技股份有限公司;山栀子苷B(批号B21138-20MG,质量分数≥98%)购自上海源叶生物科技有限公司。19批栀子药材(表1)购自全国各地,经中国药科大学天然药物活性组分与药效国家重点实验室主任李萍教授鉴定为栀子Ellis的干燥成熟果实。
表1 19批栀子药材产地信息
Table 1 Origin information of 19 batches of Gardeniae Fructus
编号产地/收购地编号产地/收购地 S1江西吉安S11湖南长沙 S2江西萍乡S12河南南阳 S3江西樟树S13安徽亳州 S4江西新干S14广西玉林 S5江西宜春S15浙江温州 S6江西丰城S16陕西汉中 S7福建福鼎S17山西太原 S8福建福鼎S18四川广元 S9广西钦州S19四川泸州 S10广西钦州
2 方法与结果
2.1 对照品和供试品溶液制备
2.1.1 对照品溶液制备 分别精密称取山栀苷、山栀子苷B、京尼平龙胆双糖苷、栀子苷、西红花苷I和西红花苷II对照品适量,加入50%甲醇制成含山栀苷122.32 μg/mL、山栀子苷B 300.66 μg/mL、京尼平龙胆双糖苷323.40 μg/mL、栀子苷1830.40 μg/mL、西红花苷I 348.48 μg/mL和西红花苷II 49.44 μg/mL的混合对照品储备液。
2.1.2 供试品溶液制备 称取栀子粉末(过四号筛)0.5 g,精密称定,置于100 mL具塞锥形瓶中,精密加入50%甲醇50 mL,称定质量,超声提取40 min(500 W,40 kHz),放冷,用甲醇补足减失质量,摇匀,13 000 r/min离心10 min,取上清,过0.22 μm微孔滤膜,取续滤液,即得。
2.2 色谱条件
色谱分析采用Waters XSelect HSS C18(250 mm×4.6 mm,5 μm)色谱柱,柱温设置为35 ℃;以0.1%磷酸水溶液(A)-乙腈(B)作为流动相,保持1.0 mL/min进行梯度洗脱,洗脱梯度:0~12 min,6%~9% B;12~30 min,9%~23% B;30~33 min,23%~30% B;33~37 min,30% B;37~40 min,30%~35% B;40~46 min,35%~50% B;46~48 min,50%~90% B;48~53 min,90% B;后运行时间7 min,进样量5 μL。紫外检测采用分段变波长检测,具体为0~32 min,240 nm;32~53 min,440 nm。
2.3 指纹图谱的建立
2.3.1 精密度试验 称取栀子粉末(S1),按“2.1.2”项方法制备供试品溶液,并按“2.2”项色谱条件进样6针,以8号峰为参照峰,计算其余共有峰的相对保留时间和相对峰面积的RSD值,结果显示20个共有峰的相对保留时间和峰面积的RSD值均小于3.0%。
2.3.2 重复性试验 称取栀子粉末(S1)适量,按上述方法平行制备供试品溶液6份,进样分析后以8号峰为参照,测得各共有峰的相对保留时间RSD值低于1.0%,相对峰面积RSD值低于3.0%,表明方法重复性好。
2.3.3 稳定性试验 取同一份供试品溶液(S1),分别于0、2、4、8、12、24 h进样分析,以8号峰为参照,测得各共有峰的相对保留时间RSD在0.01%~0.08%,相对峰面积RSD在0.13%~2.30%,表明该法24 h内稳定。
2.3.4 指纹图谱建立及相似度评价 取19批栀子药材按“2.1.2”项方法制备成供试品溶液,进样分析后将数据以AIA格式导入“中药色谱指纹图谱相似度评价软件”(2012版)。S1样品设为参照图谱(中位数法、时间窗0.1),经多点校正和自动峰匹配后生成对照图谱(R),共标定20个共有峰,见图1。通过与对照品比对,指认出6个共有峰(图2),其中1号峰为山栀苷,3号峰为山栀子苷B,6号峰为京尼平龙胆双糖苷,8号峰为栀子苷(参照峰S),13号峰为西红花苷I,16号峰为西红花苷II。对照指纹图谱与各批次样品图谱进行相似度评价,结果见表2,19个样品相似度均大于0.980,说明不同产地栀子共有峰相似度很高,药材质量较均一。
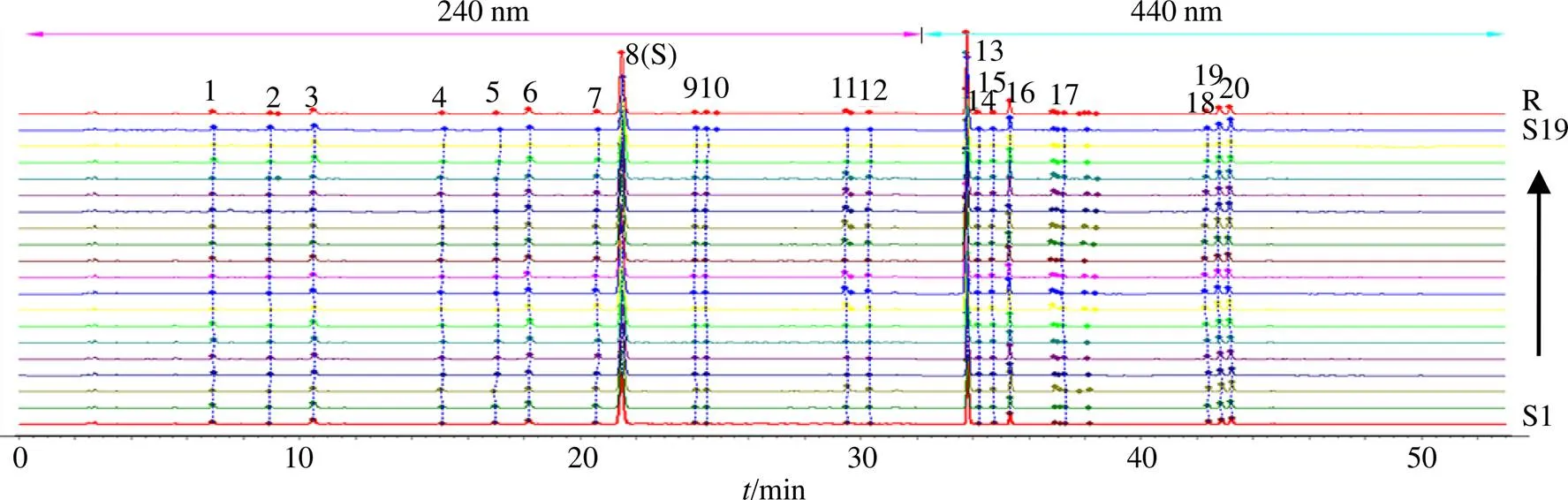
图1 19批栀子指纹图谱和对照图谱(R)

1-山栀苷 3-山栀子苷B 6-京尼平龙胆双糖苷 8-栀子苷 13-西红花苷I 16-西红花苷II
表2 19批栀子的相似度结果
Table 2 Similarities of 19 batches of samples
样品相似度样品相似度 S10.999S110.998 S20.981S120.998 S30.996S130.997 S40.998S140.986 S50.998S150.997 S60.997S160.983 S70.998S170.998 S80.991S180.995 S90.997S190.998 S100.998
2.4 多成分含量测定
2.4.1 线性关系 精密吸取混合对照品储备液,用50%甲醇依次稀释得到8个浓度梯度的工作溶液。按“2.2”项每个浓度进样5 μL,重复进样3针,记录6个待测物的峰面积,绘制标准曲线,其中纵坐标为峰面积(),横坐标为进样浓度()。结果显示(表3),6个成分在各自浓度范围内有良好的线性关系。
2.4.2 检测限与定量限 将对照品溶液进一步稀释后进样分析,以信噪比(/)分别为3和10时的浓度计为该化合物的检测限(LOD)和定量限(LOQ),结果见表3。
2.4.3 精密度试验 精密吸取“2.1.1”项下某一浓度的混合对照品溶液,按“2.2”色谱条件于同一日内连续进样分析6次,记录6个目标化合物的峰面积,计算RSD值评价日内精密度;连续3 d、每日进样分析3次,记录各成分峰面积,计算RSD值作为日间精密度。结果显示,日内、日间精密度RSD值均低于1.50%。
表3 各成分线性、LOD和LOQ考察结果(n=3)
Table 3 Results of linearity, LOD and LOQ for each component (n=3)
成分线性回归方程r线性范围/(μg·mL−1)LOD/(μg·mL−1)LOQ/(μg·mL−1) 山栀苷Y=6.225 2 X-1.778 80.999 90.61~110.090.0610.153 山栀子苷BY=5.427 9 X-5.943 90.999 81.50~270.600.0750.250 京尼平龙胆双糖苷Y=4.652 3 X-0.510 60.999 81.62~291.060.0810.253 栀子苷Y=7.316 4 X+2.687 90.999 8 8.89~1 599.590.0440.139 西红花苷IY=31.943 0 X-19.231 00.999 8 0.77~277.250.0040.023 西红花苷IIY=29.060 0 X-3.774 70.999 70.23~41.030.0070.023
2.4.4 重复性试验 取同一批次栀子粉末(S1)按“2.1.2”项平行制备6份供试品溶液,按“2.2”项色谱条件分析,记录各成分峰面积,计算6个待测成分的含量及RSD值。结果显示,RSD值低于1.29%,表明该方法重复性良好。
2.4.5 稳定性试验 按“2.1.2”项下制备供试品溶液,分别于0、2、4、6、8、12、24 h进样,记录6个待测物的峰面积并计算RSD值。结果表明样品溶液在24 h内稳定性良好。
2.4.6 加样回收率试验 取已知含量的栀子药材粉末(S1)9份,每份称取0.25 g,精密称定,6个化合物分别按50%、100%和150%的水平精密加入对照品,按“2.1.2”项制备后同法分析,记录山栀苷、山栀子苷B、京尼平龙胆双糖苷、栀子苷、西红花苷I和西红花苷II的峰面积,计算加样回收率及RSD值,结果显示,6个化合物的加样回收率在94%~105%。
2.5 一测多评方法建立
2.5.1 相对校正因子的计算 8个浓度的工作溶液每份分析3次,记录峰面积,按下列公式计算相对校正因子。其中4个环烯醚萜苷类以栀子苷为内标物,2个二萜类以西红花苷I为内标物,分别计算相对校正因子(),结果见表4。
=(A/C)/(A/C)
A为内标峰面积,C为内标浓度;A为待测物峰面积,C为待测物浓度
2.5.2的耐用性考察 采用不同厂家、型号的液相色谱仪和不同品牌的色谱柱(规格均为250 mm×4.6 mm,5 μm)进行校正因子耐用性考察。结果表明,校正因子RSD<3%(表5),表明各成分的相对校正因子耐用性良好。
2.5.3 样品含量测定 采用一测多评法和标准曲线外标法对19批栀子药材中的6个主要成分进行含量测定,结果见表6。采用检验对外标法和一测多评法的结果进行评价,>0.05,表明2种方法测定的含量结果无明显差异;进一步以准确度对4个环烯醚萜苷总含量和2个二萜类总量进行准确性评价。
表4 各成分对照品的相对校正因子
Table 4 Relative correction factor of each component reference
序号f山栀苷/栀子苷f山栀子苷B/栀子苷f京尼平龙胆双糖苷/栀子苷f栀子苷/栀子苷f西红花苷I/西红花苷If西红花苷I/西红花苷II 11.121.411.561.001.001.16 21.121.311.521.001.001.10 31.151.461.551.001.001.11 41.161.371.541.001.001.11 51.151.311.541.001.001.11 61.201.371.531.001.001.10 71.141.321.531.001.001.10 81.141.301.531.001.001.10 平均值1.151.361.541.001.001.11 RSD/%2.174.090.880.000.001.79
表5 相对校正因子的耐用性考察
Table 5 Durability of relative correction factors
仪器色谱柱f山栀苷/栀子苷f山栀子苷B/栀子苷f京尼平龙胆双糖苷/栀子苷f西红花苷I/西红花苷II Agilent 1290Waters XSelect HSS C181.151.361.541.11 Agilent Plus C181.191.391.531.11 Agilent SB C181.091.371.561.12 Thermo AQUASIL C181.181.371.571.13 Agilent 1260Waters XSelect HSS C181.161.351.561.12 Agilent Plus C181.101.301.511.12 Agilent SB C181.171.311.551.12 Agilent 1100Waters XSelect HSS C181.111.311.531.08 Agilent Extend C181.151.361.561.08 Agilent SB C181.171.341.501.08 Shimadzu LC-20AWaters XSelect HSS C181.171.381.561.11 Agilent Plus C181.161.381.571.11 Agilent SB C181.181.391.581.09 Thermo AQUASIL C181.151.381.571.12 平均值 1.151.361.551.11 RSD/% 2.682.251.551.56
准确度=e/s
e为外标法测定结果,s为一测多评法测定结果
计算得到2类成分准确度在99.82%~100.50%,且RSD<3%,说明所建立的一测多评法用于栀子药材的多成分含量测定与外标法测定结果较为一致。
3 讨论
本实验根据6个成分的总量进行计算,比较了超声和回流2种提取方式对提取结果的影响,结果表明两种方法无显著差异,且西红花苷I长时间高温加热回流会发生降解[26],故选择超声提取。结合参考文献[22-23],优化了提取溶剂、提取时间、料液比及提取次数,确定供试品溶液的制备条件为0.5 g样品粉末加入50%甲醇50 mL超声提取40 min,提取1次。
环烯醚萜苷类和二萜类成分是栀子的主要成分,也是其活性成分。通过对相关成分进行全波长扫描,发现这2大类成分紫外吸收光谱差异较大,最大吸收波长分别在240 nm和440 nm附近。因此,栀子药材在指纹图谱和多成分含量测定时,需采用多个检测波长。本研究在建立色谱分析方法中,通过色谱条件的优化,发现栀子中主要的环烯醚萜苷类和二萜类成分峰时间没有交集,因此采用分时段采集不同吸收波长色谱图的方法建立指纹图谱,即色谱条件前32 min检测波长为240 nm,用于检测环烯醚萜苷类成分;32 min后检测波长为440 nm,用于测定二萜类成分,在同一张图谱上可得到两类成分,所建立的栀子指纹图谱共标定20个共有峰,经对照品确证了其中6个成分。根据一测多评法的指导原则,内标物应选择药材中的有效成分或指标成分,且应与待测成分为同类成分或母核相同,光谱特性基本一致。因此分别以栀子苷和西红花苷I作为内标,在各自最大吸收波长下,对环烯醚萜苷类和二萜类成分进行含量测定,既降低了实验中对照品、仪器的投入成本,同时保证了检测的灵敏度和准确性。
表6 一测多评法和外标法含量结果
Table 6 Content results of SSDMC and ESM
序号栀子苷/%山栀苷/%山栀苷B /%京尼平龙胆双糖苷/%西红花苷I/%西红花苷II/% 外标法外标法一测多评法外标法一测多评法外标法一测多评法外标法外标法一测多评法 S15.020.250.240.710.700.600.590.850.140.14 S25.550.310.300.760.760.950.930.620.140.14 S37.750.150.140.500.500.530.511.520.260.26 S45.110.320.310.590.590.560.540.810.150.15 S55.340.330.320.700.690.690.671.020.180.18 S65.150.350.330.750.740.770.760.780.150.15 S75.470.360.350.790.791.021.000.950.160.16 S86.810.140.130.420.410.700.691.450.250.25 S97.780.160.150.500.490.670.651.280.190.19 S107.110.180.170.440.430.710.691.220.160.16 S115.020.340.330.760.760.740.720.820.180.18 S126.840.160.160.440.430.710.701.210.160.16 S137.540.160.160.400.390.590.571.420.190.19 S146.770.200.200.290.280.780.770.840.070.07 S157.340.140.130.470.460.730.711.380.230.23 S166.780.100.090.380.370.520.511.640.230.23 S175.170.350.340.820.820.700.690.840.180.18 S184.600.240.230.770.760.320.310.680.130.13 S195.320.260.250.660.650.450.440.940.160.16
本研究采用高效液相色谱结合紫外变波长技术,建立了栀子的指纹图谱结合一测多评的质量控制方法,在一次分析中,可同时分析栀子中的环烯醚萜苷类和二萜类成分。19批栀子药材中共标定了20个共有峰,所有样品的相似度均高于0.980,表明栀子药材的整体质量一致性较好,所建立的指纹图谱方法可用于栀子药材的整体质量评价。通过对照品确认了6个共有峰,并同时建立了一测多评的含量测定方法。以栀子苷为内标,山栀苷、山栀苷B、京尼平龙胆双糖苷和栀子苷在240 nm下的校正因子分别为1.15、1.36、1.54和1.00;440 nm下,以西红花苷I为内标,西红花苷II的相对校正因子为1.11。以校正因子(一测多评法)和标准曲线(外标法)计算得到的含量结果之间无明显差异(准确度在99.82%~100.50%),表明所建立的一测多评方法准确,可用于栀子药材的多成分含量测定。19个批次栀子药材中山栀苷、山栀子苷B、京尼平龙胆双糖苷、栀子苷、西红花苷I和西红花苷II的含量分别为0.09%~0.35%、0.28%~0.82%、0.31%~1.00%、4.60%~7.78%、0.62%~1.64%和0.07%~0.26%。所建立的指纹图谱结合一测多评方法在减少对照品使用的情况下,可实现栀子药材的多成分、多指标质量控制,在中药整体质量评价模式中具有良好的应用前景。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 259.
[2] 李海波, 马金凤, 庞倩倩, 等. 栀子的化学成分研究 [J]. 中草药, 2020, 51(22): 5687-5697.
[3] Ni Y, Li L, Zhang W Y,. Discovery and LC-MS characterization of new crocins in gardeniae fructus and their neuroprotective potential [J]., 2017, 65(14): 2936-2946.
[4] 闫光军, 范建伟, 苏瑞强, 等. 不同采收期栀子有机酸类成分HPLC指纹图谱 [J]. 中国实验方剂学杂志, 2015, 21(11): 39-41.
[5] 张忠立, 左月明, 杨雅琴, 等. 栀子中的黄酮类化学成分研究 [J]. 中国实验方剂学杂志, 2013, 19(4): 79-81.
[6] Chen H, Huang X T, Min J B,. Geniposidic acid protected against ANIT-induced hepatotoxity and acute intrahepatic cholestasis, due to Fxr-mediated regulation of Bsep and Mrp2 [J]., 2016, 179: 197-207.
[7] Hu Y Y, Liu X, Xia Q,. Comparative anti-arthritic investigation of iridoid glycosides and crocetin derivatives fromEllis in Freund's complete adjuvant-induced arthritis in rats [J]., 2019, 53: 223-233.
[8] Zhang H Y, Lai Q, Li Y,. Learning and memory improvement and neuroprotection of() extract on ischemic brain injury rats [J]., 2017, 196: 225-235.
[9] Sheng L, Qian Z Y, Zheng S G,. Mechanism of hypolipidemic effect of crocin in rats: Crocin inhibits pancreatic lipase [J]., 2006, 543(1/2/3): 116-122.
[10] Shirali S, Zahra Bathaie S, Nakhjavani M. Effect of crocin on the insulin resistance and lipid profile of streptozotocin-induced diabetic rats [J]., 2013, 27(7): 1042-1047.
[11] Yaribeygi H, Mohammadi M T, Sahebkar A. Crocin potentiates antioxidant defense system and improves oxidative damage in liver tissue in diabetic rats [J]., 2018, 98: 333-337.
[12] Wang H L, Li J, Gao X M,. Ionic liquid-simplified matrix solid-phase dispersion for the simultaneous determination of terpenoids, crocins, quinic acid derivatives and flavonoids in Gardeniae fructus by UHPLC [J]., 2019, 42(10): 1886-1895.
[13] Han Y, Wen J, Zhou T T,. Chemical fingerprinting ofEllis by HPLC-DAD-ESI-MS combined with chemometrics methods [J]., 2015, 188: 648-657.
[14] Shan M Q, Wang T J, Jiang Y L,. Comparative analysis of sixteen active compounds and antioxidant and anti-influenza properties offruits at different times and application to the determination of the appropriate harvest period with hierarchical cluster analysis [J]., 2019, 233: 169-178.
[15] 王智民, 高慧敏, 付雪涛, 等. “一测多评”法中药质量评价模式方法学研究 [J]. 中国中药杂志, 2006, 31(23): 1925-1928.
[16] Liu W, Zhang J S, Han W,. One single standard substance for the simultaneous determination of 17 triterpenes inLingzhi and its related species using high-performance liquid chromatography [J]., 2017, 1068/1069: 49-55.
[17] 陶晓赛, 龚海燕, 谢彩侠, 等. 基于UPLC指纹图谱结合化学计量学评价不同产地盾叶薯蓣药材质量 [J]. 中草药, 2021, 52(1): 227-233.
[18] Sun M M, Wu H W, He M,. Integrated assessment of medicinal rhubarb by combination of delayed luminescence and HPLC fingerprint with emphasized on bioactivities based quality control [J]., 2020, 15: 72.
[19] 徐鑫, 戚华文, 高德嵩, 等. 基于化学模式识别的栀子UPLC定量指纹图谱研究 [J]. 中国中药杂志, 2020, 45(18): 4416-4422.
[20] 李苏运, 李佟拉嘎, 于欢, 等. 15种成分结合化学计量学方法综合评价不同产地栀子质量 [J]. 中华中医药学刊, 2021, 39(5): 192-197, 292.
[21] 王琪, 李晓琦, 黄萌萌, 等. 基于指纹图谱及多成分含量的化学模式识别法评价不同产地栀子药材的质量 [J]. 中草药, 2019, 50(11): 2690-2699.
[22] 曹虹虹, 严维花, 郭爽, 等. 基于多成分测定及指纹图谱评价不同产地栀子质量 [J]. 中国中药杂志, 2019, 44(18): 4026-4033.
[23] 姚超, 辛华, 陆兔林, 等. 不同产地栀子的超高效液相色谱指纹图谱及模式识别研究 [J]. 中国药学杂志, 2017, 52(1): 63-67.
[24] 林绍霞, 张清海, 席培宇, 等. 一测多评法同时测定栀子中6种成分 [J]. 中药材, 2015, 38(3): 531-535.
[25] 王智民, 钱忠直, 张启伟, 等. 一测多评法建立的技术指南 [J]. 中国中药杂志, 2011, 36(6): 657-658.
[26] 付小梅, 吴志瑰, 裴建国, 等. 栀子药材中西红花苷-1的化学稳定性研究 [J]. 时珍国医国药, 2015, 26(3): 525-527.
Study on quality control method ofby fingerprint combined with single standard for determination of multiple components
LUO Jia-min1, 2, GAO Wen2, LI Ping1, 2
1. School of Traditional Chinese Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China 2. State Key Laboratory of Active Components and Pharmacodynamics of Natural Medicines, China Pharmaceutical University, Nanjing 210009, China
To establish the fingerprint of Zhizi () and a single standard for determination of multiple components (SSDMC) method to determine the content of six main components simultaneously, in order to control the overall quality of.High performance liquid chromatography (HPLC) combined with ultraviolet (UV) variable wavelength detection was established. Under the maximum absorption wavelength of various compounds, the fingerprints ofwith the composition information of iridoid glycosides (240 nm) and diterpenoids (440 nm) were established. On this basis, with geniposide and crocin I as internal standards, calculating relative correction factors of four iridoid glycosides (shanzhiside, gardenoside B, genipin-1-β--gentiobioside and geniposide) and two diterpenoid components (crocin I and crocin II) to establish SSDMC method. Durability inspection through four high performance liquid chromatographs and four different chromatographic columns, and compared with the results of external standard method (ESM) to verify the accuracy of this method.A total of 20 common peaks were calibrated in fingerprints of 19 batches of, the similarities of each batch were 0.981—0.999. At 240 nm, with geniposide as the internal standard, the correction factors of shanzhiside, gardenoside B, genipin-1-β--gentiobioside and geniposide were 1.15, 1.36, 1.54 and 1.00, respectively; at 440 nm, with crocin I as the internal standard, the relative correction factor of crocin II was 1.11, with good durability. The determined results of six components using SSDMC method were compared with the results of the ESM, and the results showed that the mean value of the accuracy of the content was 100.14% with RSD<3%, without significantly different. The content range of six components in 19 batches ofwere 0.09%—0.35%, 0.28%—0.82%, 0.31%—1.00%, 4.60%—7.78%, 0.62%—1.64% and 0.07%—0.26%, respectively.The established fingerprint combined with SSDMC method are simple and feasible, which can provide some reference and basis for the overall quality control of.
Ellis; fingerprint; SSDMC; relative correction factor; shanzhiside; gardenoside B; genipin-1-β--gentiobioside; geniposide; crocin I; crocin II
R286.2
A
0253 - 2670(2022)11 - 3480 - 07
10.7501/j.issn.0253-2670.2022.11.026
2021-12-03
国家重点研发计划项目(2018YFC1707900)
罗家敏(1995—),女,硕士研究生,研究方向为中药质量分析与评价。Tel: 17817181097 E-mail: luojiamin111@126.com
李 萍,教授,博士生导师,主要从事中药药效物质及作用机制研究。E-mail: liping2004@126.com
[责任编辑 时圣明]
