基于指纹图谱和多指标成分定量结合化学模式识别法评价不同产地草果质量
2022-05-31管红梅陈梦林王保山蒲忠慧
陈 肖,管红梅,陈梦林,王保山,代 敏,蒲忠慧, 2, 3*
基于指纹图谱和多指标成分定量结合化学模式识别法评价不同产地草果质量
陈 肖1,管红梅1#,陈梦林1,王保山4,代 敏2*,蒲忠慧1, 2, 3*
1. 成都医学院检验医学院,四川 成都 610500 2. 四川省动物源性食品兽药残留防控技术工程实验室,四川 成都 610500 3. 成都医学院 发育与再生四川省重点实验室,四川 成都 610500 4. 北京生泰尔科技股份有限公司,北京 102600
采用指纹图谱、多指标成分定量与化学模式识别相结合的方法,评价不同产地草果质量,为其进一步开发利用提供依据。采用HPLC法,流动相为甲醇-0.2 mol/L磷酸水溶液进行梯度洗脱,柱温30 ℃,体积流量1 mL/min,检测波长270 nm,对15批不同产地草果药材建立指纹图谱及6种有效成分含量测定,运用聚类分析(hierarchical cluster analysis,HCA)、主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)对草果进行化学模式识别研究。建立了15批草果药材的指纹图谱,相似度为0.737~0.991,共标定21个共有峰,指认了6个成分,含量测定结果表明不同产地草果中化学成分含量存在明显差异;HCA分析15批草果明显分为3类;PCA得到4个主成分的累计方差贡献率为85.941%;OPLS-DA表明原儿茶酸、原儿茶醛、对羟基苯甲酸可能是影响草果药材质量的差异标志物。建立的草果HPLC指纹图谱及6个成分含量测定方法的专属性强,且准确、可靠,结合化学模式识别可用于草果的药材鉴别和质量控制。
草果;指纹图谱;多指标成分;化学模式识别;质量评价;原儿茶酸;原儿茶醛;对羟基苯甲酸
草果为姜科豆蔻属多年生草本植物草果-Crevost et Lemaire的干燥成熟果实,主要分布于贵州、广西、云南等地。现代研究表明其含有挥发油、黄酮类、酚酸类、甾体类以及二苯庚烷类等化学成分[1-6],具有燥湿温中、截疟除痰之功效。草果的质量评价目前主要侧重于外观品质以及挥发油含量指标等项目[7],但不足以说明草果的内在品质,更不能对草果质量从整体上进行分析和评价。指纹图谱作为整体、稳定的化学鉴别手段,是当今国际公认的控制中药质量的质控模式[8]。随着现代分析技术的发展以及中药质量控制要求的提高,多指标成分含量测定已成为中药质量控制的关键[9-10]。因此,本研究采用指纹图谱与多指标含量测定相结合的方法,同时结合聚类分析(cluster analysis,HCA)、主成分分析主成分分析(principal component analysis,PCA)、正交偏最小二乘法-判别分析正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)等化学模式识别综合分析各主产区草果药材的成分差异,明确其产地差异及成分特征,为草果药材的鉴别及质量标准的制定提供参考依据。
1 仪器和材料
1.1 仪器
Agilent 1260 Infinity Ⅱ高效液相色谱仪(G7114A 1260 VWD Detector,LC-1260 2.4.0.628色谱工作站,美国Agilent公司);ME204型万分之一分析天平(梅特勒-托利多仪器上海有限公司);SB25-12D超声波清洗仪(宁波新艺超声设备有限公司);MiLi-Q纯水仪(美国milipore公司)。
1.2 材料
原儿茶醛(批号PS020016)、对羟基苯甲酸(批号PS010279)对照品均购自成都普思生物科技有限公司,质量分数≥98%。原儿茶酸(批号MUST-20110310)、龙胆酸(批号MUST-20082605)、香草酸(批号MUST-20072701)、对羟基苯丙酸(批号MUST-20091902)对照品均购自成都曼思特生物科技有限公司,质量分数≥98%;甲醇(色谱级,Sigma公司);其余试剂均为分析纯。
1.3 药材
共收集草果药材15批,分别来自主产区贵州(5批)、广西(5批)和云南(5批)等地。所有药材经成都医学院药学院李羿教授鉴定为姜科豆蔻属多年生草本植物草果-Crevost et Lemaire的干燥成熟果实。具体信息详见表1。
表1 草果药材来源信息
Table 1 Sources of medicinal materials of A. tsao-ko
编号产地来源收集时间 S1贵州水城北京时珍堂2020-10 S2贵州毕节北京时珍堂2020-10 S3贵州纳雍北京时珍堂2020-10 S4贵州镇宁北京时珍堂2020-10 S5贵州三穗北京时珍堂2020-10 S6广西那坡自采2019-10 S7广西南宁自采2019-10 S8广西横县自采2019-10 S9广西灵山自采2019-10 S10广西桂林自采2019-10 S11云南红河滇本草药业2020-09 S12云南怒江滇本草药业2020-09 S13云南盈江滇本草药业2020-09 S14云南文山滇本草药业2020-09 S15云南腾冲滇本草药业2020-09
2 方法与结果
2.1 色谱条件
色谱柱:Eclipse Plus C18(150 mm×4.6 mm,3.5 μm);流动相为0.2 mol/L磷酸水溶液(A)-甲醇(B);梯度洗脱:0~5 min,10%~15% B;5~10 min,15%~20% B;10~30 min,20%~40% B;30~40 min,40%~60% B;40~50 min,60%~70% B;50~60 min,70%~80% B。体积流量1 mL/min,检测波长270 nm,柱温30 ℃,进样量10 μL。
2.2 溶液的制备
2.2.1 供试品溶液 取草果粉末(过二号筛)约5.0 g,精密称定。置具塞三角瓶中,精密加入70%乙醇50 mL,称定质量,超声处理30 min,放至室温,用70%乙醇补足减失的质量、摇匀,0.45m微孔滤膜滤过,取续滤液,即得[11]。
2.2.2 混合对照品溶液 分别精密称定原儿茶酸、原儿茶醛、对羟基苯甲酸、龙胆酸、香草酸、对羟基苯丙酸对照品适量,加入甲醇溶解并定容,制成质量浓度分别为3.45、1.46、4.72、107.83、5.61、54.36 μg/mL的混合对照品储备液,备用。
2.2.3 空白溶液 以样品的提取溶剂(70%乙醇)作为空白溶液。
2.4 指纹图谱的建立及分析
2.4.1 精密度试验 精密称取草果药材粉末(S2)约5 g(过二号筛),按“2.1.2”项下方法制备供试品,按“2.1.1项下”色谱条件测定,连续进样6次,记录色谱图,以10号峰(对羟基苯丙酸)为参照峰(S,该峰分离良好,保留时间合适),计算得到各共有峰的相对保留时间的RSD均小于0.39%,相对峰面积RSD均小于1.18%,表明仪器精密度良好。
2.4.2 重复性试验 精密称取同一草果药材粉末(S2)约5 g(过二号筛),按“2.1.2”项下方法平行制备6份供试品溶液,按“2.1.1”项下色谱条件测定,以10号峰对羟基苯丙酸为参照峰(S),计算得到各共有峰的相对保留时间的RSD均小于0.67%,相对峰面积RSD均小于1.84%,表明方法重复性好。
2.4.3 稳定性试验 取同一草果供试品溶液,按“2.1.1项下”色谱条件测定,分别在0、2、4、8、12、24 h进行测定,以10号峰对羟基苯丙酸为参照峰(S),计算得到各共有峰的相对保留时间的RSD均小于0.83%,相对峰面积RSD均小于1.48%,表明供试品溶液在24 h内稳定性良好。
2.4.4 指纹图谱建立及相似度评价 精密称取15批草果粉末各5.0 g,按照“2.2.1”项下方法制备供试品溶液,然后分别按照“2.1”项下色谱条件进样测定,记录色谱图。将15批草果样品的HPLC图谱导入《中药色谱指纹图谱相似度评价系统(2008A版)》中,以S11号样品的色谱图为参照图谱,时间窗宽度为0.5 min中位数法生成对照图谱(R),经多点校正后进行色谱峰匹配生成样品叠加指纹图谱(图1);然后以对照指纹图谱为参照,进行各样品图谱的相似度评价。同时,通过将对照指纹图谱与对照品色谱图进行比对,进行色谱峰的指认。结果,15批草果样品中共标定了21个共有峰;通过与对照品色谱图比对,指认了其中6个成分,分别为原儿茶酸(3号峰)、原儿茶醛(4号峰)、对羟基苯甲酸(5号峰)、龙胆酸(6号峰)、香草酸(8号峰)、对羟基苯丙酸(10号峰)。各样品图谱与对照指纹图谱的相似度为0.737~0.991,说明15批草果样品具有很高的相似性,相似度评价结果见表2。

图1 15批草果样品的HPLC叠加指纹图谱和对照指纹图谱(R)
表2 15批草果样品HPLC指纹图谱相似度评价结果
Table 2 HPLC fingerprint similarity evaluation results of 15 batches of A. tsao-ko
编号S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15R S11.000 S20.9771.000 S30.9120.8621.000 S40.8240.8140.8221.000 S50.9860.9880.8890.8341.000 S60.9320.9610.8240.8230.9681.000 S70.8240.8590.7710.8200.8630.9241.000 S80.7520.7940.7390.7960.8200.8920.9371.000 S90.8030.7600.7770.7630.7830.8720.9270.9911.000 S100.7730.8440.7720.7650.8510.9290.9150.9400.9491.000 S110.7370.8250.8830.8580.8240.8780.8040.8330.8480.9491.000 S120.8410.8950.7640.8020.9090.9430.8920.9230.9230.9680.9441.000 S130.7530.8510.8330.8990.8240.8640.7500.8090.8230.8710.9340.8571.000 S140.8930.9400.7810.8210.9490.9710.9010.8970.8890.9550.9240.9770.8921.000 S150.8190.8990.8730.8860.8010.7560.8090.8150.8140.8520.8770.8800.8280.7901.000 R0.9350.9600.8700.8840.9710.9810.9340.9810.8940.9330.8780.9650.8310.9760.7901.000
2.5 化学模式识别
2.5.1 HCA 采用多元统计分析软件SIMCA-P 14.0对15批样品中21个共有峰的标准化峰面积聚类分析,样品被分为3类:第一类为S8、S13~S15;第2类为S2;第3类为S1、S3~S7、S9~S12。HCA结果表明不同产区草果药材的质量存在一定地域差异性,广西和贵州的大部分草果具有一定的相似性。
2.5.2 PCA 进一步探讨3个主产区草果化学成分之间的差异,将15批样品21个共有峰的峰面积导入SPSS.26软件进行PCA分析,计算相关矩阵的特征值及其方差贡献率[12]。以特征值>1为提取标准,得到草果药材指纹图谱共有峰特征值(表3),4个主成分的累积方差贡献率达到85.941%,说明4个主成分在反映3个主产地草果样品共有成分关系中起到主导作用。其中第1~4个主成分贡献率分别为为45.632%、18.466%、12.320%和9.523%。由主成分矩阵(表4)可知各个共有峰对4个主成分不同的独立方差贡献率,第1主成分主要代表了峰1、2、4、5、9、10、12;第2主成分主要代表了峰3、15、20、21;第3主成分代表了峰8、11;第4主成分代表了峰17、19。
2.5.3 OPLS-DA 在PCA的基础上进一步选择有监督模式的OPLS-DA对不同产区15份草果样品进行分析,筛选出对引起组间差异贡献率较大的成分。在建立的OPLS-DA模型中,累计解释能力参数2和2分别为0.712、0.744,预测能力参数(2)为0.916,提示本实验所建立OPLS-DA模型的稳定性及预测能力较好[13]。由OPLS-DA得分图2可知,不同批次样品可分为3类,贵州和广西大部分样品可以聚为一类,与HCA结果一致。贵州和广西位置毗邻,环境气候条件具有更多的相似性,均属于亚热带气候区。对3组数据的差异性进行整体分析变量重要性投影值(variable importance in projection,VIP)。VIP是筛选差异性化合物的重要指标,值越大,表明该色谱峰的贡献越大[14]。在0.95的置信区间内,提取模型中21个变量的VIP,见图3。选取VIP>1的14个化合物作为差异性标志物,按VIP大小排序依次为20号峰>15号峰>3号峰(原儿茶酸)>4号峰(原儿茶醛)>2号峰>9号峰>5号峰(对羟基苯甲酸)>10号峰(对羟基苯丙酸)>21号峰>1号峰>7号峰>19号峰>12号峰>13号峰,这些成分是区分不同产地草果差异的主要标志性物质,在将来的研究中建议多关注。
表3 15批草果样品主成分特征值及贡献率
Table 3 Characteristic value and contribution rate of 15 batches of A. tsao-ko
主成分特征值方差贡献率/%累积贡献率/% 19.58345.63245.632 23.87818.46664.098 32.58712.32076.418 42.0009.52385.941
表4 15批草果样品共有峰成分矩阵
Table 4 Component matrix of common peaks of 15 batches of A. tsao-ko
峰号共有峰主成分 1234 1未指认 0.901 0.256−0.048−0.152 2未指认 0.965 0.090−0.116 0.011 3原儿茶酸−0.272 0.860−0.253−0.272 4原儿茶醛 0.936 0.279−0.065 0.017 5对羟基苯甲酸 0.964 0.057−0.183 0.132 6龙胆酸 0.802−0.119 0.224 0.456 7未指认 0.804 0.458−0.017−0.102 8香草酸−0.313 0.146 0.838−0.075 9未指认 0.927 0.277−0.050 0.089 10对羟基苯丙酸 0.930 0.192−0.111−0.036 11未指认−0.557 0.233 0.605−0.425 12未指认 0.887 0.066 0.405 0.038 13未指认 0.049−0.781 0.249 0.461 14未指认 0.601 0.000 0.544−0.437 15未指认−0.103 0.808−0.101 0.258 16未指认 0.077 0.564 0.512 0.190 17未指认 0.114 0.402 0.500 0.610 18未指认−0.019−0.285 0.487 0.097 19未指认−0.579 0.203−0.232 0.643 20未指认−0.685 0.593 0.009 0.387 21未指认−0.743 0.592 0.026−0.140

图2 15批草果药材正交偏最小二乘判别分析得分图
2.6 含量测定
2.6.1 专属性试验 取“2.2”项下制备供试品溶液、混合对照品溶液以及空白溶液,0.45 μm滤膜滤过,分别按“2.1”项下色谱条件进样分析,记录色谱图。结果表明,各待测成分的色谱峰与相邻色谱峰间的分离度均大于1.5,以各成分计的理论板数均在6000以上,且空白溶液对测定无干扰,说明此方法专属性良好。专属性试验的HPLC色谱图见图4。
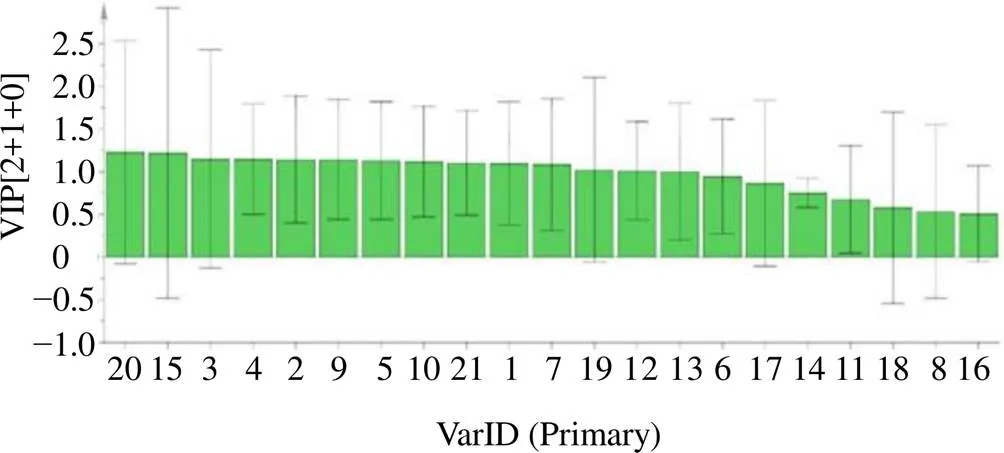
图3 15批次草果21个共有峰VIP值
2.6.2 线性关系考察 精密吸取“2.3”项下的混合对照品溶液适量,用甲醇稀释制成系列浓度的混合对照品溶液溶液。经0.45 μm微孔滤膜滤过后,取续滤液10 μL,按“2.1”项下色谱条件进样分析,记录峰面积。以进样量为横坐标(),峰面积为纵坐标(),进行线性回归,结果,各待测成分均在其相应质量范围内与其峰面积的线性关系良好(均不低于0.999 1),见表5。

3-原儿茶酸 4-原儿茶醛 5-对羟基苯甲酸 6-龙胆酸 8-香草酸 10-对羟基苯丙酸
表5 草果药材中6个成分线性关系考察
Table 5 Regression equations, correlation coefficients, linear ranges of six components of A. tsaoko
成分回归方程r线性范围/μg 原儿茶酸Y=2 795.2 X-92.9840.999 20.004~4.000 原儿茶醛Y=6 255.5 X-169.840.999 10.003~3.000 对羟基苯甲酸Y=5 863.9 X-63.0620.999 30.004~4.000 龙胆酸Y=44.433 X+4.42120.999 40.400~4.000 香草酸Y=6 407.7 X-151.940.999 70.004~4.000 对羟基苯丙酸Y=503.17 X+80.8030.999 30.200~4.000
2.6.3 精密度试验 取混合对照品储备液适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。计算得到原儿茶酸、原儿茶醛、对羟基苯甲酸、龙胆酸、香草酸、对羟基苯丙酸峰面积的RSD分别为0.94%、1.18%、0.83%、0.68%、1.04%、1.05%,表明仪器精密度良好。
2.6.4 重复性试验 精密称取同一产地(S8)的草果粉末1.0 g,按“2.2”项下方法平行制备6份供试品溶液,再按“2.1”项下色谱条件连续测定6次,记录峰面积并按标准曲线法计算样品中6种成分含量。结果,原儿茶酸、原儿茶醛、对羟基苯甲酸、龙胆酸、香草酸、对羟基苯丙酸含量的RSD分别为1.13%、0.81%、1.14%、0.90%、0.61%、1.84%,表明方法重复性良好。
2.6.5 稳定性试验 取草果供试品溶液(S8)适量,按“2.1”项下色谱条件分别于0、2、4、8、12、24 h进样测定,记录峰面积。结果,原儿茶酸、原儿茶醛、对羟基苯甲酸、龙胆酸、香草酸、对羟基苯丙酸峰面积的RSD分别为RSD分别为1.13%、0.79%、1.19%、1.09%、0.98%、1.48%,表明供试品溶液在24 h内稳定性良好。
2.6.6 加样回收率试验 精密称取已知含量的草果样品(S8)9份,分别按已知含量的50%、100%、150%加入各对照品(按“2.3”项下方法制备),再按“2.1”项下色谱条件进样测定,计算得到原儿茶酸、原儿茶醛、对羟基苯甲酸、龙胆酸、香草酸、对羟基苯丙酸的平均加样回收率分别为95.43%、97.57%、95.05%、97.28%、97.13%、95.76%,RSD分别为1.97%、1.75%、2.35%、2.69%、1.84%、2.36%,表明该方法准确度良好。
2.6.7 样品含量测定 精密称取15批不同产地草果药材粉末(过二号筛)1.0 g,分别按“2.2”项下方法制备样品溶液,按“2.1”项下色谱条件进样测定,计算6种有效成分含量,结果见表6,可见不同产地草果化学成分含量存在明显差异。通过含量测定结果箱线图分析(图5),可明确各产地草果中代表性化学成分。原儿茶酸在云南怒江(S12)采收的草果中含量最高,达到0.132 8 mg/g,云南腾冲(S15)则为最低;云南草果原儿茶醛和对羟基苯甲酸含量均在0.031 8和0.032 2 mg/g以上,整体高于其他产地,可作为区分云南草果与其他产地草果的2个指标成分;云南草果龙胆酸量在1.589 6~3.421 3 mg/g,整体高于其它产区,也可作为区分云南草果与其他产地草果的差异性成分;云南产区的香草酸含量相对较高,云南怒江含量最高,达0.048 1 mg/g;贵州产区对羟基苯丙酸的含量明显高于其它产区,可作为区分贵州草果与其他产地草果的差异性成分。广西草果龙胆酸和对羟基苯丙酸含量整体偏低。
3 讨论
本研究选择贵州、广西、云南3个草果主产区15批样品,以指纹图谱质量控制模式定性,多指标质量控制模式定量,结合结合化学模式识别全面评价不同产地草果的质量。结果表明15批草果药材指纹图谱的相似度在0.737~0.991,确定21个共有峰,指认了6个成分。通过HCA、PCA和OPLS-DA等化学计量法分析表明15批草果样品明显分为3类,4个主成分累计方差贡献率为85.941%;通过变量权重要性排序发现共有峰20、15、2、9、10(对羟基苯丙酸)、5(对羟基苯甲酸)、1、21、3(原儿茶酸)、7、19、12,这些成分可作为区分和鉴别不同产区草果药材质量的主要标志性成分,未知差异成分本课题组后续将会继续深入研究,以期为评价草果药材质量提供更为全面地参考。
表6 草果中6个成分的含量测定
Table 6 Contents determination of six components of A. tsao-ko
编号质量分数/(mg·g−1) 原儿茶酸原儿茶醛对羟基苯甲酸龙胆酸香草酸对羟基苯丙酸 S10.066 90.029 40.022 61.627 40.035 72.404 7 S20.074 10.030 40.023 51.861 70.037 31.603 3 S30.076 80.029 90.023 42.047 30.038 62.077 1 S40.078 80.029 70.028 12.343 70.040 72.260 0 S50.071 40.029 70.024 31.556 70.035 21.057 8 S60.081 60.032 10.030 60.806 40.035 90.950 9 S70.074 90.030 70.048 91.212 10.040 21.460 0 S80.062 90.031 30.031 10.820 30.036 80.409 1 S90.055 30.031 30.027 41.069 90.037 50.400 7 S100.069 70.029 70.024 20.535 40.032 61.412 9 S110.080 50.031 80.036 71.990 20.038 22.124 7 S120.132 80.037 50.046 13.421 30.048 10.357 3 S130.107 70.034 60.036 12.386 50.041 01.245 5 S140.071 80.031 90.032 21.589 60.035 41.502 3 S150.04380.031 80.033 41.710 00.036 30.903 9

图5 HPLC指纹图谱各指标成分含量测定箱线图
酚酸类化合物是草果一类重要化学成分,根据前期实验研究结果[16]和文献数据[11]表明草果中主要为苯甲酸为母核的C6-C1型酚酸类成分。其中原儿茶酸、原儿茶醛、对羟基苯甲酸、龙胆酸、香草酸等酚酸类成分是草果发挥抗菌抗炎、抗氧化等作用的主要物质基础[17-18],因此本研究主要对草果中酚酸类成分进行了含量测定。在流动相选择上发现0.2 mol/L的磷酸溶液比0.02 mol/L的稀磷酸溶液[11]色谱峰信息量多,响应值更高。含量测定结果表明草果酚酸类成分具有明显的产地差异。通过产地差异成分分析,明确了不同产地草果特征成分。云南草果原儿茶醛、对羟基苯甲酸和龙胆酸含量均整体高于广西和贵州产区,可作为区分云南草果与其他产地草果的的3个差异性成分,贵州产区对羟基苯丙酸的含量明显高于其它产区,可作为贵州草果的差异性成分,广西草果龙胆酸和对羟基苯丙酸含量整体较低。
本研究所建立的不同产地草果HPLC指纹图谱及多指标成分含量测定方法的专属性较强,且准确、可靠。结合指纹图谱和酚酸类成分的定量研究,可以为区分草果的产地以及全面、准确地控制草果的质量提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 杨志清, 徐绍忠, 张薇, 等. 云南草果茎叶挥发油含量及主要化学成分分析 [J]. 中药材, 2019, 42(2): 339-343.
[2] Hong S S, Lee J H, Choi Y H,. Amotsaokonal A-C, benzaldehyde and cycloterpenal from[J]., 2015, 56(48): 6681-6684.
[3] Kim J G, Jang H, Le T P L,. Pyranoflavanones and pyranochalcones from the fruits of[J]., 2019, 82(7): 1886-1892.
[4] 柳航, 王敏, 许耶, 等. 草果化学成分的研究 [J]. 中成药, 2020, 42(10): 2648-2651.
[5] 赵雨鸿, 沈华, 代双亿, 等. 草果总黄酮的大孔吸附树脂纯化工艺优化研究 [J]. 中国药房, 2020, 31(7): 831-836.
[6] 李志君, 万红焱, 顾丽莉, 等. 草果多酚物质提取及LC-MS/MS分析 [J]. 食品工业科技, 2017, 38(8): 294-299.
[7] 中国药典 [S]. 一部. 2020: 249-250.
[8] 刘东方, 赵丽娜, 李银峰, 等. 中药指纹图谱技术的研究进展及应用 [J]. 中草药, 2016, 47(22): 4085-4094.
[9] 佘一鸣, 胡永慧, 韩立云, 等. 中药质量控制的研究进展 [J]. 中草药, 2017, 48(12): 2557-2563.
[10] 陈丽华, 肖发林, 黄诗雨, 等. 中药质量评价研究思路及创新发展趋势 [J]. 中草药, 2021, 52(9): 2541-2547.
[11] 任洪涛, 谭年文, 周恒苍, 等. 高效液相色谱法测定草果中4种酚酸含量 [J]. 食品安全质量检测学报, 2021, 12(9): 3694-3699.
[12] 陈欢, 高萌, 罗小泉, 等. 不同产地枳壳药材中12种有效成分的主成分分析和判别分析 [J]. 中草药, 2019, 50(14): 3433-3437.
[13] 黄建猷, 胡筱希, 麦琬婷, 等. 指纹图谱及多成分定量结合化学模式识别法评价不同产地消瘤藤质量 [J]. 中草药, 2021, 52(14): 4334-4340.
[14] Gao S, Chen H G, Zhou X. Study on the spectrum-effect relationship of the xanthine oxidase inhibitory activity of[J]., 2019, 42(21): 3281-3292.
[15] 李强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望 [J]. 中草药, 2013, 44(22): 3095-3104.
[16] 沈华, 管红梅, 钟燕, 等. 草果酚酸的提取工艺优化 [J]. 中国药房, 2021, 32(14): 1698-1702.
[17] 雷智冬, 黄锁义. 草果提取方法、生物活性与临床应用研究新进展 [J]. 中华中医药学刊, 2021, 39(1): 245-249.
[18] Kumar N, Goel N. Phenolic acids: Natural versatile molecules with promising therapeutic applications [J]., 2019, 24: e00370.
Quality evaluation of-from different habitats by fingerprint combined with multi-component quantification and chemical pattern recognition
CHEN Xiao1, GUAN Hong-mei1, CHEN Meng-lin1, WANG Bao-shan4, DAI Min2, PU Zhong-hui1, 2, 3
1. School of Laboratory Medicine, Chengdu Medical College, Chengdu 610500, China 2. Sichuan Engineering Laboratory for Prevention and Control Technology of Veterinary Drug Residue in Animal-origin Food, Chengdu 610500, China 3. Sichuan Key Laboratory of Development and Regeneration, Chengdu Medical College, Chengdu 610500, China 4. Beijing Centre Biology Co., Ltd., Beijing 102600, China
Based on the method of HPLC fingerprint, multi-component quantification and chemical pattern recognition, the quality of-from different habitats was evaluated to provide basis for further development and utilization.The methanol-0.2 mol/L phosphoric acid aqueous solution was used as mobile phase in HPLC analysis with gradient elution for the fingerprint establishment of-from different habitats and the determination of six effective components. The detection wavelength was set at 270 nm, the flow rate was 1.0 mL/min, the injection volume was 10 μL, and the column temperature was 30 ℃. The combination of hierarchical cluster analysis (HCA), principal component analysis (PCA) and orthogonal partial least squares-discriminant analysis (OPLS-DA) were employed to distinguish the quality of 15 batches of-from different producing areas.The fingerprint of 15 bathes of-were established and the similarity were 0.737—0.991, a total of 21 common peaks were calibrated and six of them were identified by comparing with reference subslances; The content determination results showed that there were obvious differences in the content of chemical components of-from different habitats; The results of HCA demonstrated that there were obvious three categories distinctions; PCA analysis indicated that the cumulative variance contribution rate of four principal components were 85.941%; OPLS-DA found protocatechuic acid, protocatechualdehyde and-hydroxybenzoic acid may be the markers of quality difference between them.The established fingerprint and the content determination method of the six components were highly specific, accurate and reliable. Furthermore, combined with chemical pattern recognition, it could be used for the identification and over all quality control of-
-Crevost et Lemaire; fingerprint; multiple index components; chemical pattern recognition; quality evaluation; protocatechuic acid; protocatechualdehyde;-hydroxybenzoic acid
R286.2
A
0253 - 2670(2022)11 - 3472 - 08
10.7501/j.issn.0253-2670.2022.11.025
2021-12-09
国家自然科学基金资助项目(31970137,82102442);四川省应用基础研究项目(2021YJ0158,2020JDRC0071);四川省省级大学生创新创业训练计划项目(S202113705988);成都医学院发育与再生四川省重点实验室研究基金资助项目(SYS19-08)
陈 肖(2001—),男,四川汉源人,在读专科,主要从事中药质量分析。E-mail: 1096362973@qq.com
代 敏(1974—),女,四川达州人,博士,教授,主要从事中药抗耐药菌机制研究。E-mail: daimin1015@163.com
蒲忠慧(1982—),女,四川万源人,博士,副教授,主要从事中药药效物质基础研究。E-mail: zhonghui.pu@163.com
#共同第一作者:管红梅(1996—),女,四川资阳人,在读本科,主要从事中药质量分析。E-mail: 2665330168@qq.com
[责任编辑 时圣明]
