从药动学/药效学角度优化头孢哌酮/舒巴坦的临床给药方案
2022-05-30刘笑芬毋海兰范亚新李熠李鑫陈渊成张菁
刘笑芬 毋海兰 范亚新 李熠 李鑫 陈渊成 张菁


摘要:头孢哌酮/舒巴坦是目前临床广泛使用的一种β-内酰胺类合剂。该药抗菌谱广,主要用于治疗呼吸道感染、腹腔感染等多种感染。该药临床已使用多年,对于耐药菌的治疗地位也越来越受到广泛关注。故综述其药动学/药效学特点,总结文献报道的给药方案优化策略,以供临床使用中借鉴和参考。
关键词:药动学;药效学;药动学/药效学;头孢哌酮/舒巴坦;给药方案
中图分类号:R978.1 文献标志码:A
Pharmacokinetics/pharmacodynamics mediated dose optimization of cefoperazone/sulbactam in clinics
Liu Xiao-fen, Wu Hai-lan, Fan Ya-xin, Li Yi, Li Xin, Chen Yuan-cheng, and Zhang Jing
(Institute of Antibiotics, Huashan Hospital affiliated to Fudan University, Shanghai 200040)
Abstract Cefoperazone/sulbactam is a combination of β-lactam antibiotic with β-lactamase inhibitor. It is widely used in the treatment of respiratory tract infection, abdominal infection, and other infections. The pharmacokinetics/pharmacodynamics and the dosing optimization strategies of cefoperazone/sulbactam compound were reviewed.
Key words Pharmacokinetic; Pharmacodynamic; PK/PD; Cefoperazone/sulbactam; Dosage regimen
头孢哌酮(cefoperazone)是一种具有广谱抗菌活性的第三代头孢菌素,对大多数野生型肠杆菌科细菌都有活性,对于铜绿假单胞菌也有较好的抗菌作用[1]。头孢哌酮与舒巴坦组成的复合制剂头孢哌酮/舒巴坦(cefoperazone/sulbactam,SCF)扩大了包括鲍曼不动杆菌和产超广谱β-内酰胺酶的革兰阴性菌在内的抗菌谱,对多数产A类酶菌株保持活性,而易受C类酶影响[2]。
头孢哌酮/舒巴坦在临床中应用广泛,而在临床患者中,由于患者的基礎疾病、感染病原菌等情况复杂,合理制定用药方案仍存在较大挑战。如患者肾功能减退时,药物的分布容积(distribution volume,Vd)可因多种因素的影响而发生变化,如水肿、脱水,又如血浆白蛋白降低使游离药物增多,致分布容积增大,最终血药浓度仍可能较正常肾功能患者低。对于老年患者,由于体内各组成成分、血流量和生理功能和青壮年者相比均有较大变化,导致药物的体内过程各环节,包括吸收、分布、代谢和排泄均有变化,其中以对消除过程影响较为显著[3]。头孢哌酮/舒巴坦作为一个复方制剂,本文将从PK/PD角度综述针对不同人群如何调整用药,达到在临床上合理用药的目的。
1 头孢哌酮/舒巴坦的药动学特征及给药方案优化
1.1 健康人群的药动学特征及给药方案优化
头孢哌酮口服不吸收,一般采用静脉滴注给药。头孢哌酮3 g静脉滴注15 min,血药峰浓度(Cmax)为430.9 μg/mL,曲线下面积(AUC0-∞)为356 μg·h/mL。舒巴坦1.5 g静脉滴注15 min,Cmax可达83.4 μg/mL,AUC0-∞为77.7 μg·h/mL,见表1。单独注射头孢哌酮、舒巴坦与同时注射等量头孢哌酮/舒巴坦相比,药动学参数均无明显变化,提示两药联合后其药动学无明显相互作用[4]。
头孢哌酮和舒巴坦均能较好地分布到各组织和体液,包括胆汁、胆囊、皮肤、阑尾、输卵管、卵巢、子宫和其他组织及体液中。家兔静脉注射头孢哌酮400 mg/kg 1 h后,头孢哌酮在尿、胆汁及肾组织的浓度可以超过同时期血浓度几倍至几十倍以上[5]。肝、脾、胆囊壁、骨髓、睾丸(或卵巢)及心脏的组织体液浓度约为同时间血浓度的1/4~1/5,小肠中也有较高浓度。血供较少的组织如肌肉、骨髓、脂肪、房水及脑脊液等也能测到一定药物浓度,约为血浓度10%及以下。头孢哌酮蛋白结合率高(70%~93.5%),舒巴坦的蛋白结合率约为38%[6]。头孢哌酮在体内几乎不代谢,主要由胆汁排泄(40%以上),少部分经肾排泄(20%~30%),其半衰期(t1/2)约为1.7 h[7]。舒巴坦主要经肾排泄(90%),其t11/2约为1 h。
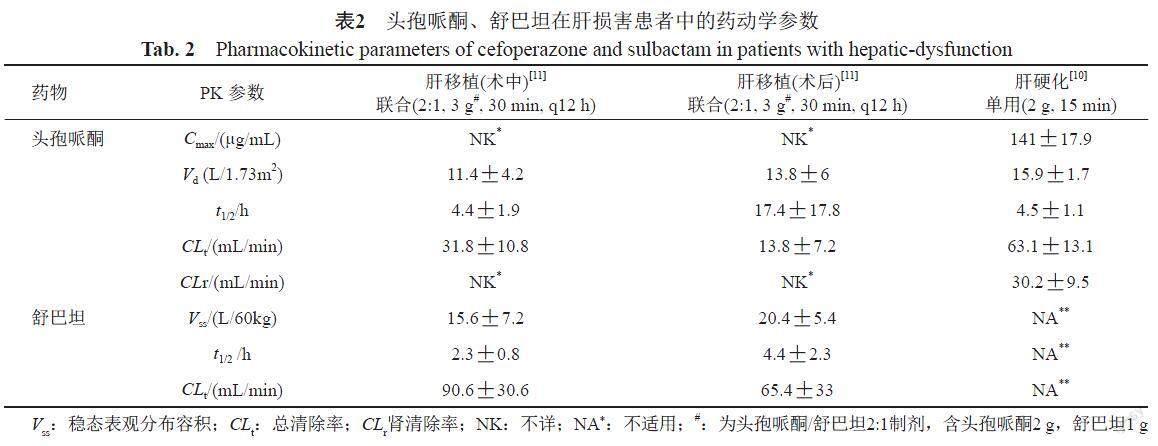
1.2 头孢哌酮/舒巴坦在肝损害患者中的药动学特征及给药方案优化
当患者有肝脏疾病和/或胆道梗阻时,头孢哌酮的t1/2通常延长,并且尿液排出量增加。肝移植患者静脉滴注头孢哌酮/舒巴坦3 g(2:1,含头孢哌酮2 g,舒巴坦1 g)30 min后,头孢哌酮和舒巴坦的清除率均为术中高于术后,两者的术后t1/2均延长,且高于术中t1/2(表2)[10-11]。
轻中度肝损害患者无需调整给药方案,然而严重胆道梗阻、严重肝脏疾病或同时合并肾功能损害时,应监测头孢哌酮血药浓度,根据需要调整用药剂量。对这些患者如未密切监测血药浓度,头孢哌酮的每日剂量不应超过2 g[10]。舒巴坦主要经肾脏代谢,肝损害的患者一般不需要调整剂量[3]。
1.3 头孢哌酮/舒巴坦在肾损害患者中的药动学特征及给药方案优化
头孢哌酮/舒巴坦3 g(2:1,含头孢哌酮2 g,舒巴坦1g)q12 h给药时,头孢哌酮药动学参数没有因肾损害或透析而发生明显变化,健康受试者和患者t1/2无明显差别。舒巴坦在肾损害患者中的总清除率和肌酐清除率高于健康受试者,t1/2明显延长至9.7 h(表3)。
患者的肌酐清除率小于30 mL/min时,头孢哌酮/舒巴坦3 g(2:1)复方制剂给药一次,给药12 h后补充等效剂量的头孢哌酮单药以降低舒巴坦每日2 g的总剂量;这种调整适用于肌酐清除率小于15 mL/min的情况;对于肾病晚期的患者进行血液透析后仍可按照该方案进行治疗[12]。
1.4 头孢哌酮/舒巴坦在老年患者中的药动学特征及给药方案优化
健康老年人静脉滴注头孢哌酮/舒巴坦(1:1,含头孢哌酮1 g,舒巴坦1 g)后的药动学参数,与成年人相比,头孢哌酮的差异不明显,而舒巴坦存在明显差异(清除率下降约54%,分布容积降低近50%,达峰浓度升高100%,AUC升高约130%)[8]。在伴有轻度肾损害和肝损害的老年人群中进行了头孢哌酮/舒巴坦3 g(2:1,含头孢哌酮2 g,舒巴坦1 g)的药动学研究,与健康成年受试者相比,头孢哌酮的药动学参数没有明显变化,舒巴坦显示出t1/2延长[13]。在伴有严重腹腔感染(肌酐清除率在25~118 mL/min之间)的老年患者中,头孢哌酮的t1/2明显延长,清除率下降[14],见表4。由于肾功能下降,老年人使用含舒巴坦制剂时,药物在体内的清除减慢,应结合肾功能情况,适当减少舒巴坦的用量;而肝功能正常时,头孢哌酮用量可不调整。
1.5 头孢哌酮/舒巴坦在腹膜透析患者中的药动学特征及给药方案优化
腹膜透析患者在给予头孢哌酮/舒巴坦3g(2:1,含头孢哌酮2g,舒巴坦1g)复合制剂时,头孢哌酮的药动学参数没有明显变化,舒巴坦在腹膜透析者中表现出t1/2延长,清除率下降[15](表5)。头孢哌酮在腹膜透析患者中无需调整剂量,舒巴坦则在体内的消除减慢,需调整使用剂量。
1.6 头孢哌酮/舒巴坦在感染患者中的药动学特征及给药方案优化
来自华山医院的周颖杰等[16]采用非对照前瞻性研究方法对头孢哌酮/舒巴坦治疗MDR糖非发酵菌医院获得性肺炎(hospital-acquired pneumonia,HAP)的临床疗效、微生物学疗效及安全性评价,自2009年1月至2012年12月入组了55例上海市华山医院的HAP患者。通过采血测定受试者用药后头孢哌酮及舒巴坦的血药浓度,计算受试者的PK参数,发现在HAP患者,头孢哌酮和舒巴坦的t1/2分别为(3.62±1.24)h和(1.66±0.61)h,较文献报道健康受试者延长;AUC0-τ分别为(521.48±204.19)mg·h/L和(80.77±41.87)mg·h/L,Vss分别为(21.04±7.88)L和(28.93±15.73)L,均较健康受试者增大;头孢哌酮稳态清除率(CLss)为(4.72±1.76)L/h,较健康受试者减少,而舒巴坦(16.88±15.69)L/h,较健康受试者增加。该研究提示对于HAP合并肾损害时,可考虑调整舒巴坦的剂量,合并肝功能异常,应注意头孢哌酮的剂量[16]。
2 头孢哌酮/舒巴坦对于部分常见临床病原的流行病学数据
头孢哌酮/舒巴坦目前临床上参照头孢哌酮的折点数据。图1列举了纳入全球50余个国家和地区的监测网络(antimicrobial testing leadership and surveillance,ATLAS)中2018—2019年4种临床常见革兰阴性菌头孢哌酮/舒巴坦的MIC分布。鲍曼不动杆菌和铜绿假单胞菌分离株主要集中于高MIC区域,而大肠埃希菌整体MIC值较低,分布相对较平均[17]。CHINET监测网中提供了几种重要临床分离菌在2009—2019年间的耐药性变迁情况的数据,如图2所示,铜绿假单胞菌、大肠埃希菌对头孢哌酮/舒巴坦耐药率变化平缓,而鲍曼不动杆菌和肺炎克雷伯菌从2016年开始有所上升。
3 头孢哌酮/舒巴坦PK/PD特征优化给药方案
头孢哌酮、舒巴坦均属于时间依赖性抗菌药物。目前较多文献及2018年中国医药教育协会感染疾病专业委员会发表《抗菌药物药动学/药效学理论临床应用专家共识》支持对于头孢菌素的药动学/药效学(pharmacokinetics/pharmacodynamics,PK/PD)指数为%fT>MIC,靶值为60%~70%[19-23]。通过增加给药次数、延长滴注时间提高%fT>MIC,可提高临床疗效[23]。
通过蒙特卡洛方法模拟不同给药方案下的达标概率(probability of target attainment,PTA),计算累积响应百分率(cumulative fraction of response,CFR),可以评价头孢哌酮/舒巴坦治疗不同细菌感染的预期治疗效果。姚欣凯等[24]模拟了16种给药方案,其中头孢哌酮/舒巴坦3.0 gq8 h对于ICU患者分離到的大肠埃希菌,其CFR均大于90%,可作为初始给药方案。辛栋轶等[25]发现3.0 g q8 h的给药方案对敏感、中介、耐药的大肠埃希菌和肺炎克雷伯菌%T>MIC值分别为104.5、83.25和62.0。刘佳等[26]模拟针对鲍曼不动杆菌(MIC50定为16 mg/L)感染患者的治疗,头孢哌酮/舒巴坦在3 g q6 h,6 g q6 h和6 g q8 h给药方案下,药效学指标达标(%fT>MIC大于40%)的概率分别为92.04%,99.63%和97.04%,由于6g q6h和6g q8h方案临床一般不采用,因此推荐临床给药方案3 g q6 h。
周颖杰等[16]按临床治愈与失败的疗效结果,以28例鲍曼不动杆菌感染的HAP受试者的血药浓度数据进行群体药代动力学分析,比较头孢哌酮和舒巴坦的%fT>MIC值。发现头孢哌酮/舒巴坦联合给药时,舒巴坦%fT>MIC值预测临床疗效的靶值为32.3%[16]。头孢哌酮%fT>MIC值以文献报道的50%为靶值,舒巴坦以该研究中寻找到的32.3%为靶值,按给药方案分组分析,MIC<8 mg/L时,3.0 g q6 h及q8 h滴注2 h给药方案,预测可以获得良好的临床疗效;MIC<4 mg/L时,3.0 g q8 h滴注1.5 h与3.0 g q12 h滴注2 h的给药方案,预测可以获得良好的临床疗效[16]。对于舒巴坦单药进行肾损害患者中的蒙特卡洛模拟,%fT>MIC的靶值为60%,患者的肌酐清除率(CLcr)为15 mL/min,MIC<4 mg/L时,给药方案为1 g q12 h时鲍曼不动杆菌的PTA可以达到90%;而患者CLcr为90 mL/min,MIC<4 mg/L时,给药方案为2 g q6 h才可使鲍曼不动杆菌的PTA可以达到90%[27]。除制定给药剂量和频次的策略以外,也有研究支持延长输注时间可能获得较好的治疗效果。Sutep等[28]研究发现在呼吸机相关性肺炎(ventilator-associated pneumonia, VAP)患者中,在血清白蛋白1.7~2.4 g/dL及CLcr为90~120 mL/min,%fT>MIC的靶值为60%时,对于高MIC(如8 μg/mL)的鲍曼不动杆菌,从1h延长至4h输注时间是有效的给药策略,1 g q6 h, 2 g q12 h, 2 g q8 h以及2 g q8 h都可以使PTA达到90%;MIC为16 mg/L时,给药方案需调整为2 g q6 h或3 g q8 h[28]。对于脓毒血症患者,%fT>MIC的靶值为60%,MIC<4 mg/L时,舒巴坦1 g,q12 h或1 g, q8 h的给药方案在延长4h输注后,PTA可达到90%以上[29]。
4 小结
头孢哌酮/舒巴坦是一个在我国已临床应用多年的经典合剂药物,对于呼吸道感染;泌尿道感染;腹膜炎、胆囊炎、胆管炎和其他腹腔内感染;败血症;脑膜炎;皮肤和软组织感染;骨骼和关节感染;盆腔炎、子宫内膜炎、淋病和其他生殖系统感染等有很好的治疗作用。但随着细菌耐药趋势的日益严峻,以及特殊人群特殊病理生理状态下的剂量优化需要,对于更合理使用头孢哌酮/舒巴坦提出了更高的需求。因此,临床实践中应结合药物的药动学/药效学特点,对于部分重症患者和高MIC病原菌感染者,可以采用增加给药频次、剂量、延长输注时间等方式来提高治疗效果。
参 考 文 献
[1]Dunn G L. Ceftizoxime and other third-generation cephalosporins: structure-activity relationships[J]. J Antimicrob Chemother, 1982, 10(Suppl C): 1-10.
[2]Williams J D. Beta-Lactamase inhibition and in vitro activity of sulbactam and sulbactam/cefoperazone[J]. Clin Infect Dis, 1997, 24(3): 494-497.
[3]汪复, 张婴元. 实用抗感染治疗学(第2版)[M]: 人民卫生出版社, 2012.
[4]Reitberg D P, Whall T J, Chung M, et al. Multiple-dose pharmacokinetics and toleration of intravenously administered cefoperazone and sulbactam when given as single agents or in combination[J]. Antimicrob Agents Chemother, 1988, 32(1): 42-46.
[5]張志林, 顾亚明, 朱悦心, 等. 头孢哌酮和头孢孟多的组织分布和肝肾毒性[J]. 新药与临床, 1987, (4): 197-201.
[6]李曌. 头孢哌酮/舒巴坦的药用价值[J]. 中外健康文摘, 2012. 9(25): 195-197.
[7]江华, 顾建伟, 顾亚明, 等. 国产头孢哌酮的体液组织分布[J]. 中国药理学通报, 1985, (2): 21-26.
[8]魏敏吉, 赵彩芸, 齐慧敏, 等. 头孢哌酮/舒巴坦(1:1)在健康成年与老年人的药动学[J]. 中国临床药理学杂志, 2007, 23(1): 28-32.
[9]Foulds G, Stankewich J P, Marshall D C, et al. Pharmacokinetics of sulbactam in humans[J]. Antimicrob Agents Chemother, 1983, 23(5): 692-699.
[10]Boscia J A, Korzeniowski O M, Snepar R, et al. Cefoperazone pharmacokinetics in normal subjects and patients with cirrhosis[J]. Antimicrobia Agents Chemother, 1983, 23(3): 385-389.
[11]Muder R R, Agarwala S, Mirani A, et al. Pharmacokinetics of cefoperazone and sulbactam in liver transplant patients[J]. J Clin Pharmacol, 2002, 42(6): 644-650.
[12]Reitberg D P, Marble D A, Schultz R W, et al. Pharmacokinetics of cefoperazone (2.0g) and sulbactam (1.0g) coadministered to subjects with normal renal function, patients with decreased renal function, and patients with end-stage renal disease on hemodialysis[J]. Antimicrob Agents Chemother, 1988, 32(4): 503-509.
[13]Meyers B R, Mendelson M H, Deeter R G, et al. Pharmacokinetics of cefoperazone in ambulatory elderly volunteers compared with young adults[J]. Antimicrob Agents Chemother, 1987, 31(6): 925-929.
[14]Schwartz J I, Jauregui L E, Bachmann K A, et al. Multiple-dose pharmacokinetics of intravenously administered cefoperazone and sulbactam when given in combination to infected, seriously ill, elderly patients[J]. Antimicrob Agents Chemother, 1988, 32(5): 730-735.
[15]Johnson C A, Zimmerman S W, Reitberg D P, et al. Pharmacokinetics and pharmacodynamics of cefoperazone-sulbactam in patients on continuous ambulatory peritoneal dialysis[J]. Antimicrob Agents Chemother, 1988, 32(1): 51-56.
[16]周颖杰. 头孢哌酮/舒巴坦(2:1)治疗多重耐药糖非发酵菌医院获得性肺炎患者的药动学及药动学/药效学研究[D].复旦大学, 2013.
[17]Antimicrobial Testing Leadership and Surveillance[EB/OL]. https://atlas-surveillance.com/.
[18]中国细菌耐药监测网[EB/OL]. http://www.chinets.com/Data/AntibioticDrugFast.
[19]Jager N G, van Hest R M, Lipman J, et al. Therapeutic drug monitoring of anti-infective agents in critically ill patients[J]. Expert Rev Clin Pharmacol, 2016, 9(7): 961-979.
[20]Guilhaumou R, Benaboud S, Bennis Y, et al. Optimization of the treatment with beta-lactam antibiotics in critically ill patients-guidelines from the French Society of Pharmacology and Therapeutics (Societe Francaise de Pharmacologie et Therapeutique-SFPT) and the French Society of Anaesthesia and Intensive Care Medicine (Societe Francaise d'Anesthesie et Reanimation-SFAR)[J]. Crit Care, 2019, 23(1): 104.
[21]Wong G, Sime F B, Lipman J, et al. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients?[J]. BMC Infect Dis, 2014, 14: 288. doi: 10.1186/1471-2334-14-288.
[22]Abdul-Aziz M H, Alffenaar J C, Bassetti M, et al. Antimicrobial therapeutic drug monitoring in critically ill adult patients: A position paper[J]. Intensive Care Med, 2020, 46(6): 1127-1153.
[23]中國医药教育协会感染疾病专业委员会. 抗菌药物药动学/药效学理论临床应用专家共识[J]. 中华结核和呼吸杂志, 2018, 41(6): 409-446.
[24]姚欣凯, 吴洪文, 刘海林, 等. 蒙特卡洛模拟法在抗菌药物治疗ICU患者大肠埃希菌感染时初始给药方案制订中的应用[J]. 中国药房, 2019, 30(17): 2394-2398.
[25]辛栋轶, 林峰, 谢觉醒, 等. 头孢哌酮舒巴坦钠不同给药方案的疗效和经济学评价[J]. 中国现代应用药学, 2016, 33(1): 110-114.
[26]刘佳, 许建国, 陆强. 蒙特卡洛模拟优化鲍曼不动杆菌感染的治疗方案[J]. 中国医院药学杂志, 2013, 33(6): 460-463.
[27]Yokoyama Y, Matsumoto K, Ikawa K, et al. Population pharmacokinetic-pharmacodynamic target attainment analysis of sulbactam in patients with impaired renal function: Dosing considerations for Acinetobacter baumannii infections[J]. J Infect Chemother, 2015, 21(4): 284-289.
[28]Jaruratanasirikul S, Nitchot W, Wongpoowarak W, et al. Population pharmacokinetics and Monte Carlo simulations of sulbactam to optimize dosage regimens in patients with ventilator-associated pneumonia caused by Acinetobacter baumannii[J]. Eur J Pharm Sci, 2019, 136: 104940. doi: 10.1016/j.ejps.2019.05.018.
[29]Jaruratanasirikul S, Wongpoowarak W, Wattanavijitkul T, et al. Population pharmacokinetics and pharmacodynamics modeling to optimize dosage regimens of sulbactam in critically ill patients with severe sepsis caused by Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2016, 60(12): 7236-7244.
