蔗糖炭化脱水实验的研究
2022-05-30陈举飞
陈举飞
关键词:问题前置;对比实验;反应物配比;充分搅拌
蔗糖炭化脱水实验,操作简单、现象明显,学生乐看、老师乐做。对该实验的深入研究、分析,能提高学生的探究能力和教师的实验教学能力。
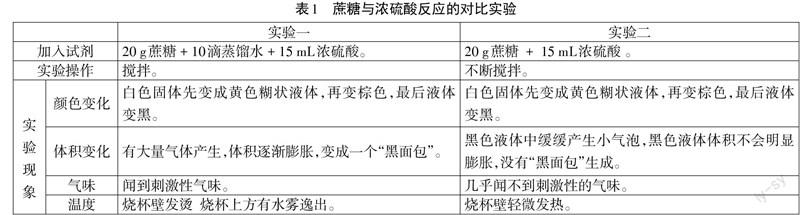
教材提示的蔗糖与浓硫酸炭化反应实验操作过程是:在烧杯中加入一定量的蔗糖,再向蔗糖中滴入几滴蒸馏水将蔗糖润湿,然后通过玻璃棒向烧杯中加入一定量的浓硫酸,用玻璃棒充分搅拌[1]。
实验过程中,可以观察到:烧杯中的蔗糖晶体先由白色变黄色,再变棕色,接着变黑色;然后黑色混合物体积逐渐膨胀,最后形成一个“黑面包”,同时闻到刺激性气味。
实验完成后,学生常常会问:既然是蔗糖的脱水炭化,为什么还要在加浓硫酸之前加蒸馏水呢?我们老师常想:怎样操作才能让这个实验的速度更快、现象更明显、污染物排放更少呢?
一、探究加入蒸馏水的作用
对于“蔗糖的脱水反应为什么还要加蒸馏水?”的问题,我们可以采取问题前置的方法,把课后学生给老师的提问变成课堂上老师对学生的提问,引导学生通过自主探究,解决问题。
在演示实验结束,学生对实验操作流程和实验现象都有了充分的了解之后,老师向学生提出问题:不加蒸馏水实验会有什么变化?水在实验中起什么作用?让学生思考,设计实验方案,再进行实验验证。
学生设计的实验方案,大多都是增加一个只加蔗糖和浓硫酸,不加蒸馏水的实验进行对比,通过对比实验,探寻实验中加入蒸馏水的作用。在学生动手完成实验之前提醒他们,要从尽可能多的方面仔细观察实验现象(见表1)。
学生观察到两个实验的现象除了在是否生成“黑面包”上有明显的不同外,还在温度、产生气体多少两个方面也有明显的差距。进而引导学生思考——是什么原因造成了两个实验现象的差异呢?
通过独立思考、小组讨论,学生分析得出两个实验现象不同的原因是:加入适量的蒸馏水→增加浓硫酸稀释时释放的热量→升高反应混合物的温度→推动发生反应:C+2H2SO4(浓)△△ CO2↑+2SO2↑+2H2O,反应产生大量气体,使混合物体积膨胀,最后形成“黑面包”[2]。
在学生分析得出结论后,再引导学生进一步设计实验方案来验证他们的推测。经过思考,学生通常会呈现两种实验方案。
方案一:继续向实验二得到的盛有黑色混合物的烧杯中滴加适量的蒸馏水,观察实验现象。
方案二:将实验二得到的盛有黑色混合物的烧杯加热,观察实验现象。
学生分小组讨论,分析两种实验方案的优点和不足:方案一的操作比较简单,却忽略了这一过程中包含浓硫酸的稀释。稀释浓硫酸时,正确的操作是把浓硫酸倒入水中,不能把水倒入浓硫酸里面。方案二的操作相对复杂,但安全性高。自然地,选择方案二进行实验。
实验三:将实验二得到的盛有黑色混合物的烧杯加热,发现随着温度的升高,烧杯中逐渐产生大量气体,刺激性的气味逐渐浓烈,黑色混合物体积逐渐膨胀,最后也会变成“黑面包”。证明上述分析是正确的。
上述实验使学生对蔗糖的脱水反应有了更深的理解,但也容易使一部分学生形成:蒸馏水有帮助浓硫酸使蔗糖发生脱水反应的作用。因此,有必要继续追问学生:蒸馏水对蔗糖在浓硫酸作用下发生脱水反应有帮助吗?最后引导学生明确:蔗糖的脱水反应不需要蒸馏水,但蒸馏水能起到加快反应速率、使实验现象更明显的作用。
该实验探究的开展,需要以浓硫酸与碳发生氧化还原反应的知识作基础。因此,在教学内容的呈现顺序上,要先学习浓硫酸的氧化性,后学习浓硫酸的脱水性,学生对演示实验的分析、探究实验的设计才有支撑。
二、探究适宜的实验条件和实验操作
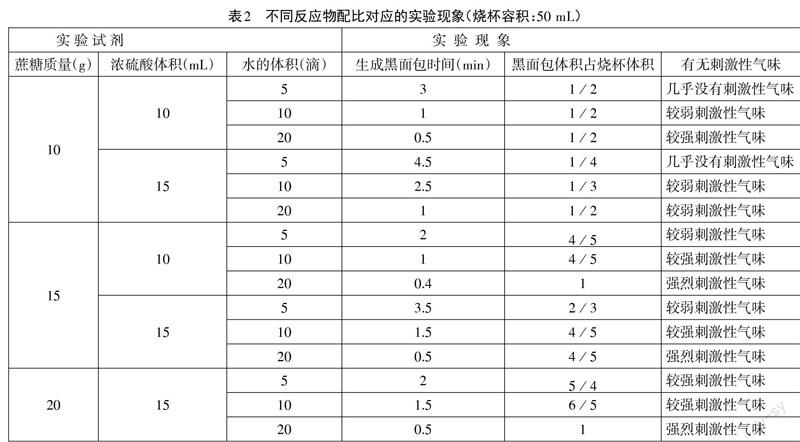
对于我们教师更多关注的“怎样操作才能让这个实验的速度更快、现象更明显、污染物排放更少?”等问题,需要不断探索、反复试验,才能确定适宜的实验条件和合理的实验操作。表2是部分实验结果。
通过上述对比实验,可以发现:蔗糖的质量相同时,(1)加入蒸馏水越少,蔗糖晶体由白色变黄色,再变棕色,最后变黑色的过程越清晰;加入蒸馏水越多,蔗糖晶体由白色变黄色,再变棕色,最后变黑色的过程越快速,蒸馏水过多时,一加入浓硫酸混合物立即变为黑色,不利于学生观察、理解蔗糖的脱水过程。(2)加入的蒸馏水越多,混合物体积膨胀越大、速率越快,逸出的刺激性气体也越多。(3)加入浓硫酸过多时,混合物的体积膨胀反而较小、产生“黑面包”速率较慢。
综合来看:一般选择50 mL烧杯、20 g蔗糖、10滴蒸馏水、15 mL 98%浓硫酸来完成这个实验比较适宜。既能清楚观察到烧杯中的蔗糖晶体由白色变黄色,再变棕色,最后变黑色的过程,又有较快的“黑面包”生长速率,能够满足课堂演示的要求。实验过程中刺激性气味很轻,具有污染物排放较少的优点。实验结束后,向烧杯中缓慢加入适量稀碱溶液,就能较好消除实验残余物的污染。
在反复多次的实验中笔者还注意到,即使反应物的配比完全相同,实验现象有时还是有明显的差异。搅拌时间越长,“黑面包”反而生长得越慢、体积越小。特别是当加入的水量较少时,不停的搅拌,只能在烧杯中看见小的气泡,烧杯中黑色混合物的体积几乎不会膨胀,也就没有黑面包生成[3]。这与我们已有的认知:快速不停的搅拌能使反应物混合更充分、接触面积更大,能加快反应速度相矛盾——原因是快速不停的搅拌增加了熱量的散失,反而不利于温度上升(特别是加入的水量较少时,浓硫酸稀释释放的热量本来就少),影响了碳与浓硫酸的反应。
当加入的水量较多时,不需要搅拌反应物已能自动混匀,反应速率已经较快,搅拌反而让“黑面包”的结构变得疏松不均匀,逸出较多的气体污染物,有害师生健康,也不利于环境保护。合理的操作是:蔗糖、水、浓硫酸按适当比例混合后,用玻璃棒稍加搅拌,混匀之后即停止搅拌,静置,混合物体积逐渐膨胀,且速度越来越快,很快就会充满烧杯。回头再读教材上的操作提示:“充分搅拌”而不是“不停搅拌”,就是让反应物混匀即可。描述简练准确,需要我们认真领会。
夏天和冬天,环境温度相差比较大,反应物的量相同,实验现象也有明显差异。冬天环境温度低,要适当增加蒸馏水的量。
