让实验现象从“无”到“有”的初中化学对比实验教学设计
2017-04-04顾鸣英
顾鸣英
摘要:初中化学中不少实验如氢氧化钠与盐酸,二氧化碳与水、氢氧化钠反应等无明显现象,从而导致了学生的认知困难。为此,在初中化学教学中通过设置对比实验,使现象从“无”到“有”,具体包括:用指示剂检验酸碱性、测量反应前后的温度、检测反应物减少和生成物产生等,让学生利用间接的实验现象或手段感知反应的发生及其微观过程,深刻理解“无明显现象”化学反应的本质。
关键词:“无明显现象”实验;间接直观实验法;对比实验;初中化学
文章编号:1005–6629(2017)2–0074–05 中图分类号:G633.8 文献标识码:B
初中化学学习中许多化学变化常伴随明显现象的产生,如放热、发光、变色、放出气体、生成沉淀等等。“有明显现象”的化学反应实验有助于学生判断变化中新物質的产生,分析化学变化的特征,从而解释化学变化的本质。
然而,在实际的变化中并不是每个化学反应都伴随明显的化学现象,比如二氧化碳与水的化合反应、与氢氧化钠反应生成易溶的无色碳酸钠和水,氢氧化钠与盐酸的中和反应在变化过程中也没有特别明显的可观察的现象,我们经常称之为“无明显现象”的化学反应。针对这些物质之间的化学反应,学生无法通过实验现象的观察来判断物质之间发生的化学变化,分析物质发生化学反应的特征,理解化学反应的微观本质,因此产生认知上的困难。
怎样让学生在已有的生活经验和化学知识基础上深刻理解无明显现象的变化确实发生了呢?间接直观实验法通过利用一定的测量手段,放大或凸显原本不够明显的物质相互作用的变化特征,或是选择间接变量进行测量或表征,形成“有明显现象”可供观察的实验。本文利用间接直观实验法,将原本无明显现象的化学反应设计成为可供观察的有明显现象的实验,帮助学生深入认识常见的化学反应。
1 利用指示剂的变色对比实验,感知化学反应新物质的产生
可溶性的无色酸碱溶液发生中和反应过程没有明显的现象,但是溶液的酸碱性却发生了突变。依据化学反应过程中溶液酸碱性的变化,利用酸碱指示剂石蕊或者酚酞的变色,说明物质的酸碱性发生了变化,明确指示出反应过程物质的成分发生了变化;也可以测定溶液酸碱度,从酸碱度的数值变化学生可以间接判断化学反应的进行过程,感知新物质的产生。
如氢氧化钠与盐酸发生中和反应利用酸碱指示剂变色和pH测定反应过程中溶液酸碱度的变化,设计定性或者定量的测定溶液酸碱性对比实验(见表1)。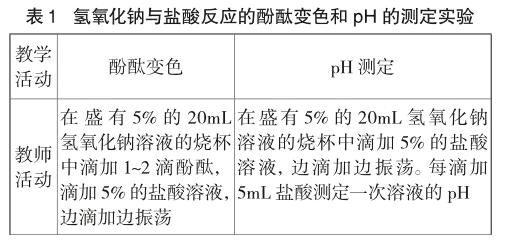
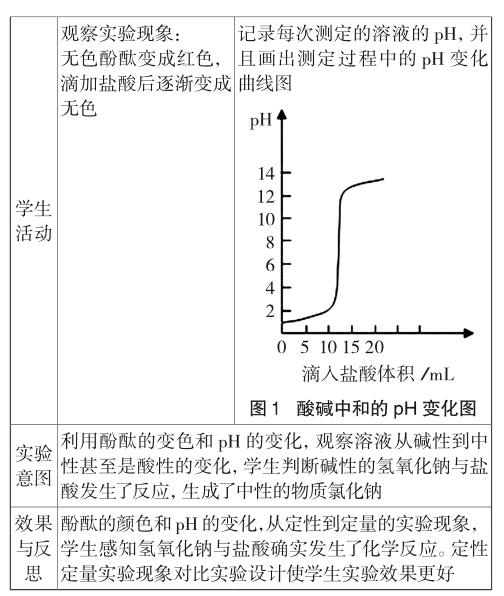
又如二氧化碳与水反应后生成碳酸,无明显现象,若在水中滴入紫色石蕊试液,再通入CO2气体紫色石蕊试液变红色,说明发生了化学变化。但是在这个实验中学生往往会产生疑问,二氧化碳是酸性氧化物能否也能使紫色石蕊试液变红色?于是设计了一组石蕊试剂变色的对比实验,学生通过观察石蕊的变色判断二氧化碳与水反应生成了新物质碳酸,显酸性(见表2)。
利用指示剂显色对比,直接观察反应过程中物质酸碱性的变化,从而判断物质的成分发生变化,感知化学反应中新物质的产生,理解无色的可溶性酸和碱、二氧化碳和水等物质之间发生的化学反应。
2 间接检测物质成分的对比实验,解释说明化学反应的微观构成
化学反应的发生实质就是反应物变成了生成物,反应过程中可以检测化学反应过程物质的成分发生的变化,用间接直观的实验检测化学反应过程中物质的成分,判断化学反应的发生,分析解释化学反应的微观构成。
无色碱溶液与酸性氧化物反应后生成无色可溶于水的盐溶液,无法观察到明显的实验现象。在化学反应过程中反应物在不断地减少,生成物在不断地产生。依据间接直观的实验检测反应物成分的减少和生成物成分产生,判断化学反应的发生,解释说明化学反应中物质的微观构成,分析化学反应中微观粒子的变化。
二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,即无色的碳酸钠溶液,反应物减少,生成物(Na2CO3)产生。从检验反应物(CO2)减少和生成物(Na2CO3)的产生角度,设计对比实验,分析化学反应的本质。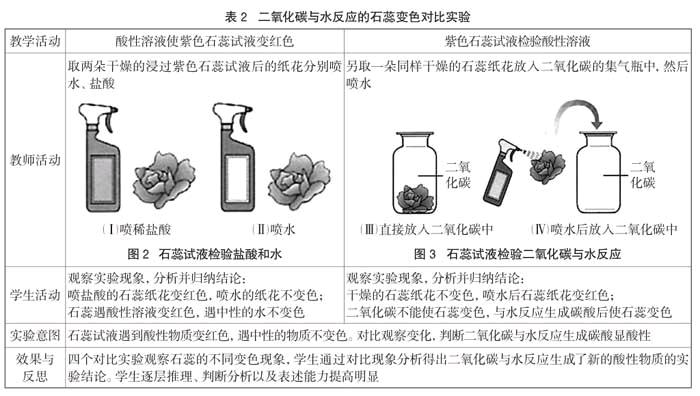
反应物二氧化碳是气体,化学反应后气体量减小,容器内气压减小。设计喷泉装置、反应容器连接U形管或盛水的容器,反应后会发生液体倒流现象,反应容器内连接橡皮球或用软塑料瓶做反应容器,反应后发生形变,这些装置凸显气体量减少,气压明显变小的现象,明确知道反应物气体的减少,化学反应中物质成分发生质的变化,微观构成也变化了(见表3)。
上述实验都是二氧化碳与氢氧化钠溶液反应,但学生质疑也可能是二氧化碳与水反应产生了相同的现象。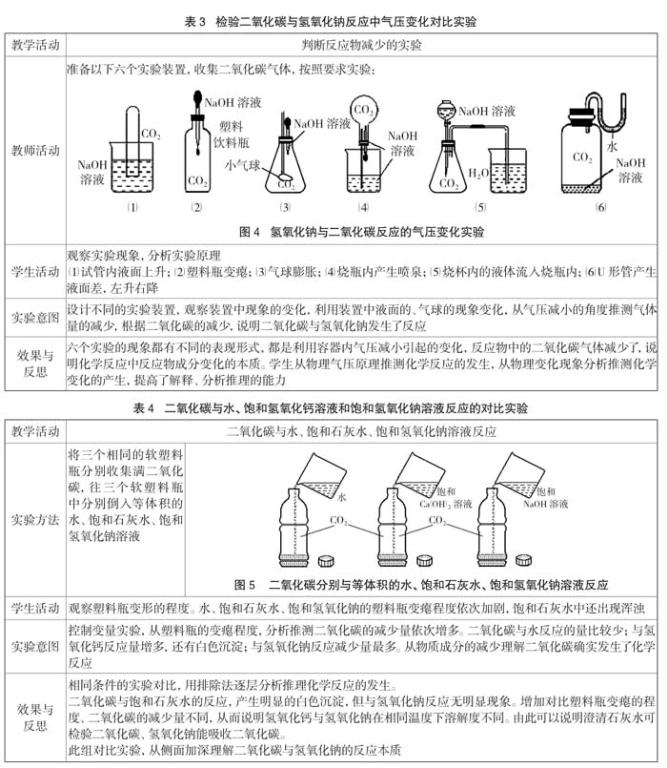
由于对比实验的不严谨,控制变量的不一致,使分析解释化学反应出现了偏差,学生产生了二氧化碳与水反应的疑惑,若改用相同材质的塑料瓶,用控制变量法来设计对比实验,可排除二氧化碳与水反应的疑问(见表4)。
从反应物的成分减少设计的对比实验,从宏观的气压减少,推测反应物二氧化碳气体的减少,用物理变化的现象,分析推断物质成分的变化,理解二氧化碳与氢氧化钠发生化学变化的本质。
化学变化的本质是产生新物质,二氧化碳与氢氧化钠反应后的产物是碳酸钠和水。组成碳酸钠的碳酸根是检验的特征成分,选择不同类别物质(酸碱盐)进行检验实验(见表5)。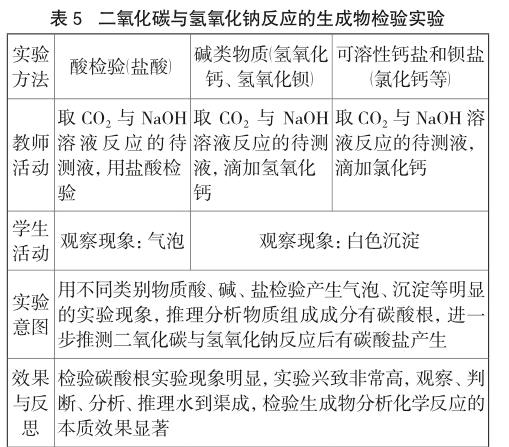
碳酸根用不同种类的酸碱盐检测可以产生明显的气泡或者沉淀现象。酸检验碳酸根产生弱酸碳酸,可以观察到气泡现象。用可溶性的氢氧化钙或氢氧化钡、可溶性的钙盐或钡盐检验碳酸根,有明显的白色沉淀产生,放大的实验现象检测生成物的微观粒子,以确定化学反应的发生以及化学反应中微观粒子的变化。
从“无”现象到“有”现象的实验探究中间接地呈现明显现象,激发学生好奇心,深入思考化学反应的特征,分析化學反应的微观变化,推测物质之间发生反应的逻辑关系,提升学习化学的思维品质,教学效果特别明显。
3 利用温度计测定反应中温度变化对比实验,分析判断化学反应的特征
化学反应过程中还存在能量的变化,可以利用实验仪器来放大不明显的现象,凸显实验现象,进一步判断新物质的产生,体会化学反应的发生。
酸碱中和反应是放热反应,有时放出的热量少一般很难观察和体验。使用温度计测量中和反应过程中温度的升降是一个较好的方法。利用明显的温度变化,凸显中和反应中的放热现象,明确化学反应的发生,从而分析氢氧化钠和盐酸两种物质的反应特征(见表6)。
4 从“无”到“有”间接直观实验法的教学过程:质疑-假设-检验-分析
在《上海市中学化学课程标准》中,对氢氧化钠与盐酸反应,二氧化碳与水、氢氧化钠反应的性质没有明确的实验要求,学习水平层次要求比较模糊,但教科书的内容和考试手册上的要求以及这些化学反应的原理和解释却是在理解、掌握甚至应用层面上。因此,在实际教学中直接设计二氧化碳与水、氢氧化钠反应,盐酸与氢氧化钠反应的实验情境,让学生观察实验现象,判断化学反应的发生,推测生成物质、分析化学反应原理显得特别重要。但是二氧化碳与水反应、二氧化碳与氢氧化钠反应、氢氧化钠与盐酸反应,却都没有明显的现象,有些现象甚至出乎学生意料之外,于是开始质疑这些化学反应的发生。针对这一问题,利用间接直观实验法,对这些学习难点的教学过程通常可以依照如下环节来展开:情境引入提出质疑-进行假设设计方案-实验检验分析现象-结论获得解释原理。具体而言,学生在教师的引导下将“无明显现象”实验转化成“有明显现象”的对比实验——间接直观实验法:利用指示剂显色、检验反应过程中物质的成分、测定反应中温度的变化等手段去放大和凸显实验现象,使学生深入思考、理解化学反应发生的特征和本质,分析解释化学反应中物质的微观粒子构成。
5 结语
从“无”到“有”的对比实验,将化学学习中难以分析和理解的化学反应难点,转化成直观的实验现象,使学生易于理解和说明化学反应的特征、物质成分和微观构成,从而掌握化学反应的本质。
此外,从“无”到“有”的对比实验往往是讨论一个探究性问题。在解决探究性问题过程中,学生不仅深刻理解了学习难点,还会引发多个知识的综合应用,促进了学生化学知识的整理、综合、拓展,使化学知识结构和方法得到重构、实验能力和逻辑推理能力得到提高,培养了学生严谨的科学研究态度。
参考文献:
[1]王荣桥.谈探究氢氧化钠性质实验的五个误区[J].化学教学,2016,(7):63.
